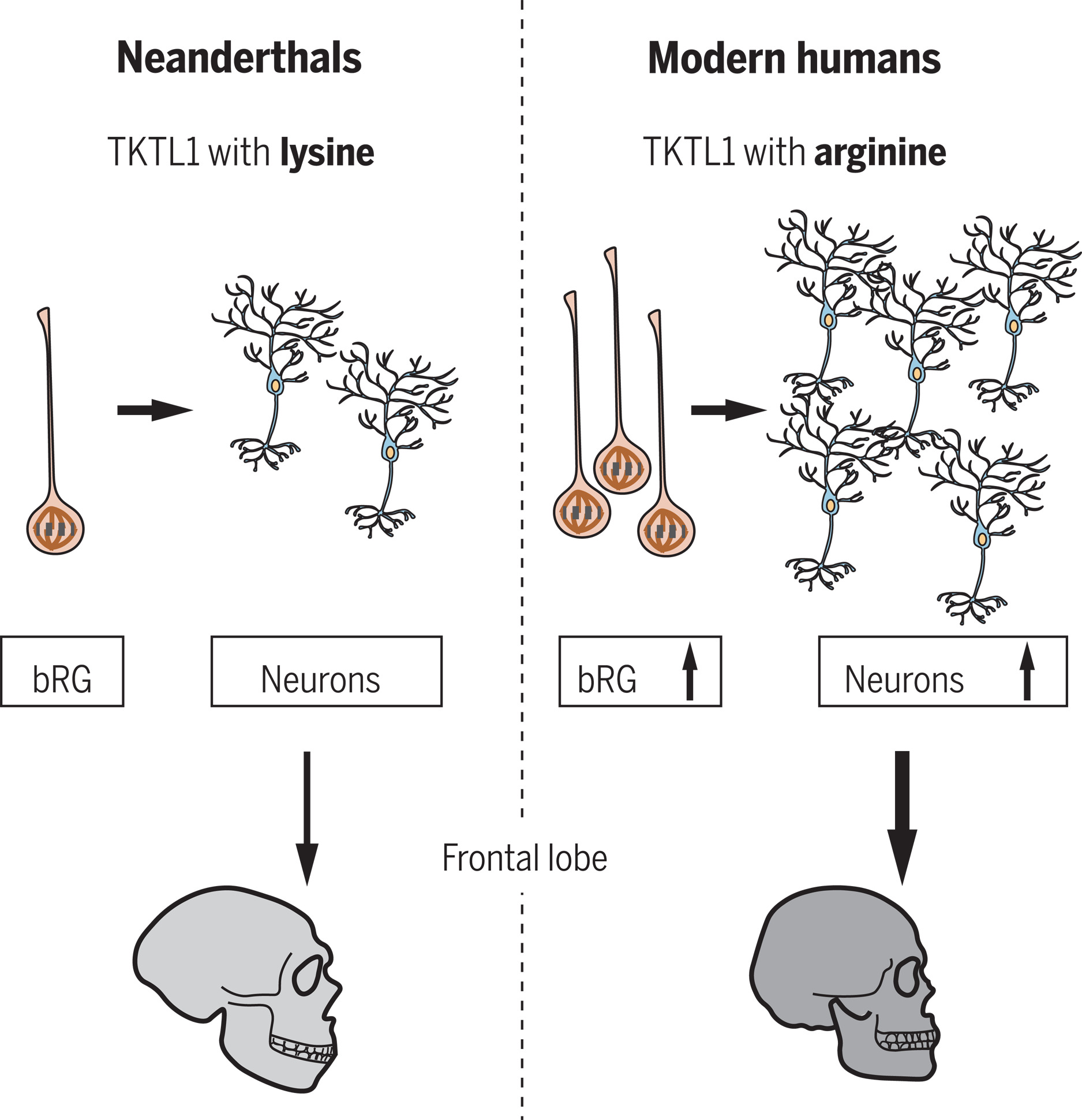
【2022 年諾貝爾生理或醫學奬】復現尼安德塔人消逝的 DNA,也映襯我們何以為人
人對自身歷史的好奇歷久彌新。最近十年古代 DNA 研究大行其道,光是發表於 Cell、Nature、Science 的論文就多到要辛苦讀完,加上其他期刊更是眼花撩亂。「古代遺傳學」的衝擊毋庸置疑,開創者帕波(Svante Pääbo)足以名列歷史偉人;然而,得知 2022 年諾貝爾生理或醫學獎由他一人獨得 ,還是令人吃驚——諾貝爾獎竟然會頒給人類演化學家?
諾貝爾獎有物理獎、有化學獎,但是沒有生物學獎,而是「生理或醫學獎」。帕波獲獎的理由是:「發現滅絕人類的基因組以及研究人類演化」。乍看和生理或醫學沒有關係,深入思考……好像還真的沒有什麼關係。
偷用強者我朋友的感想:「應該就是選厲害的。第一個和生理或醫學無關的生理或醫學獎得主,聽起來滿屌的」。
帕波直接的貢獻非常明確,在他的努力下,重現消失數萬年的尼安德塔人(Neanderthal)基因組。他為什麼想要這樣做,過程中經歷什麼困難,發現又有什麼意義呢?
喜愛古埃及的演化遺傳學家
帕波公元 1955 年在瑞典出生,獲獎時 67 歲。他從小對古埃及有興趣,大學時選擇醫學仍不忘古埃及,但是一生都在追求新奇的帕波,嫌埃及研究的步調太慢,後來走上科學研究之路。1980 年代初博士班時期,他使用當時最高端的分子生物學手段探討免疫學,成果發表於 Cell 等頂尖期刊,可謂免疫學界的頂級新秀。
然而,他始終無法忘情逝去的世界。1984 年美國的科學家獲得斑驢的 DNA 片段,轟動一時。斑驢已經滅絕一百年,能夠由其遺骸取得古代 DNA,令博士生帕波大為震撼。他很快決定結合自己的專業與興趣,嘗試由古埃及木乃伊取得 DNA,並且獨立將結果發表於 Nature 期刊。
博士畢業後,帕波義無反顧地轉換領域,遠渡美國追隨加州柏克萊大學的威爾森(Allan Wilson) 。威爾森在 1970 年代便開始探討分子演化,後來又根據不同人類族群間粒線體 DNA 的差異,估計非洲以外的人群,分家只有幾萬年,支持智人出非洲說。
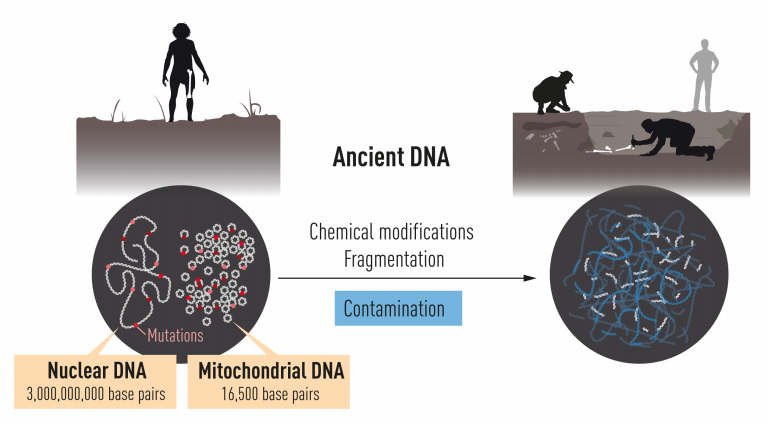
帕波正式投入相關研究後意識到,從古代樣本取樣 DNA 的汙染問題相當嚴重。這邊「汙染」的意思是,並非抓到樣本內真正的古代 DNA 目標,而是周圍環境、實驗操作者等來源的 DNA;包括他自己之前的木乃伊 DNA,很可能也不是真正的古代 DNA。另一大問題是,生物去世後 DNA 便會開始崩潰,經歷成千上萬年後,樣本中即使仍有少量遺傳物質殘存,含量也相當有限。
帕波投入不少心血改善問題。例如那時新發明的 PCR 能精確並大量複製 DNA,他馬上用於自己的題目(更早前是利用細菌,細菌繁殖時順便生產 DNA)。多年嘗試後,他決定放棄埃及木乃伊(埃及木乃伊的基因組在 2017 年成功),改以遺傳與智人差異較大的尼安德塔人為研究對象。
取得數萬年前尼安德塔人的 DNA
根據現有的證據,尼安德塔人是距今約 4 萬到 40 多萬年前的古人類。確認為尼安德塔人的第一件化石,於 1856 年在德國的尼安德谷發現,並以此得名(之前 2 次更早出土化石卻都沒有意識到)。這是我們所知第一種,不是智人的古代人類(hominin)。
對於古人類化石,一百多年來都是由考古與型態分析。帕波帶著遺傳學工具投入,不但增進考古和古人類學的知識,也拓展了遺傳學的領域。他後來前往德國的慕尼黑大學,幾年後又被挖角到馬克斯普朗克研究所,領導萊比錫新成立的人類演化部門,多年來培養出整個世代的科學家,也改變我們對人類演化的認知。
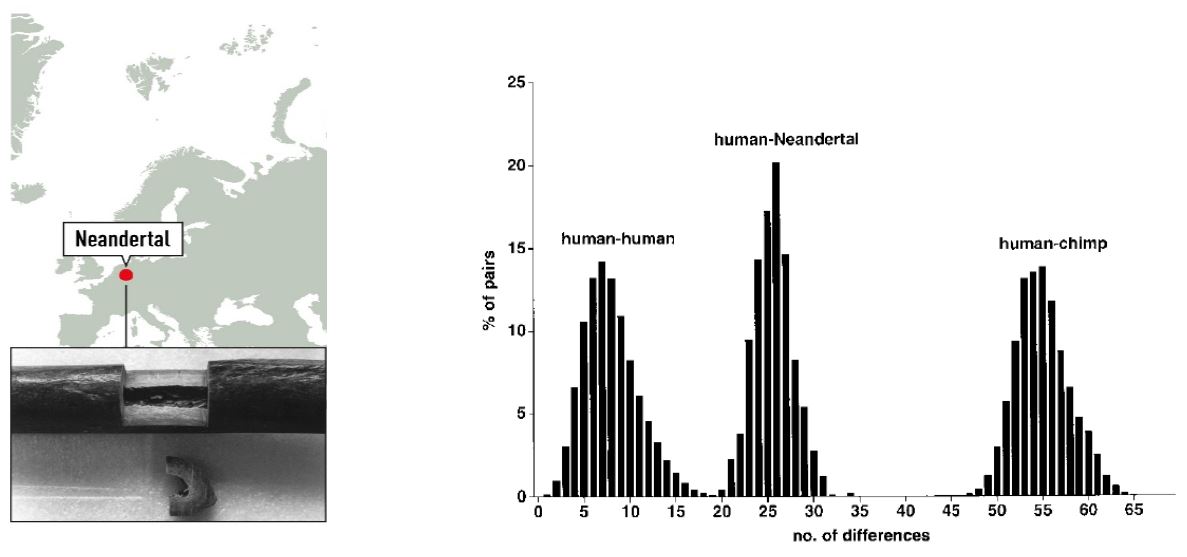
不同個體的粒線體 DNA 之間差異,智人與黑猩猩最多,智人與智人最少,智人與尼安德塔人介於期間。圖/取自 參考資料 2 帕波在 1996 年首度取得尼安德塔人的 DNA 片段,來自粒線體。他為了確認結果,邀請一位美國小女生重複實驗,驗證無誤,她就是後來也成為一方之霸的史東(Anne Stone) 。比較這段長度 105 個核苷酸的片段,尼安德塔人與智人間的差異,明顯超過智人與智人。
然而,粒線體只有 16500 個核苷酸,絕大部分遺傳訊息其實藏在細胞核的染色體中。想認識尼安德塔人的遺傳全貌,非得重現細胞核的基因組。
可是一個細胞內有數百套粒線體,只有 2 套基因組,因此粒線體 DNA 的含量為細胞核數百倍;而且染色體合計超過 30 億個核苷酸,數量無比龐大。可以說,細胞核基因組可供取材的 DNA 量少,需要復原的訊息又多,比粒線體更難好幾個次元。
方法學與時俱進:從 PCR 到次世代定序
一開始,帕波與合作者使用 PCR,但是帕波知道這是死路一條。取樣 DNA 會破壞材料,尼安德塔人的化石有限;PCR 一次又只能復原幾百核苷酸,要完成 30 億的目標遙遙無期。
帕波持續努力克服難關。2000 年人類基因組首度問世,採取「霰彈槍」定序法,大幅提升效率;也就是將 DNA 序列都打碎,一次定序一大堆片段,再由電腦程式拼湊。帕波因此和 454 生命科學公司 合作,改用新的次世代定序法,偵測化石中的古代 DNA。2006 年發表的論文可謂里程碑,報告次世代定序得知的 100 萬個尼安德塔人核苷酸,足以進行一些基因體學的分析。
帕波當時在美國的合作者魯賓(Edward Rubin) 持續使用 PCR,雙方分歧愈來愈大,終於分道揚鑣。所以很可惜地,2010 年尼安德塔人基因組論文發表時,魯賓沒有參與到最後。這是人類史上第一次,取得滅絕生物大致完整的基因組,也是帕波獲頒諾貝爾獎的直接理由。
鐵證:尼安德塔人與智人有過遺傳交流
這份拼湊多位尼安德塔人的基因組,儘管品質不佳,卻足以解答一個問題:尼安德塔人與智人有過混血嗎?答案是有,卻和本來想的不一樣。尼安德塔人沒有長居非洲,主要住在歐洲、西南亞、中亞,也就是歐亞大陸的西部。假如與智人有過混血,歐洲人應該最明顯。結果並非如此。
帕波的組隊能力無與倫比,他廣邀各領域的菁英參與計畫,不只取得 DNA 資料,也陸續研發許多分析資料的手法,其中以哈佛大學的瑞克(David Reich) 最出名。
分析得知,非洲以外,歐洲、東亞、大洋洲的人,基因組都有 1% 到 4% 能追溯到尼安德塔人(後來修正為 2% 左右)。所以雙方傳承至今的混血,發生在智人離開非洲以後,又向各地分家以前;並非尼安德塔人主要活動的歐洲。
首度由 DNA 定義古代新人類:丹尼索瓦人
復原古代基因組的工作相當困難,不過引進次世代定序後,從不可能的任務降級為難題,尼安德塔人重出江湖變成時間問題。出乎意料,同樣在 2010 年,帕波戰隊又發表另外 2 篇論文,描述一種前所未知的古人類:丹尼索瓦人(Denisovan)。不是藉由化石,而是首度由 DNA 得知新的古代人種。
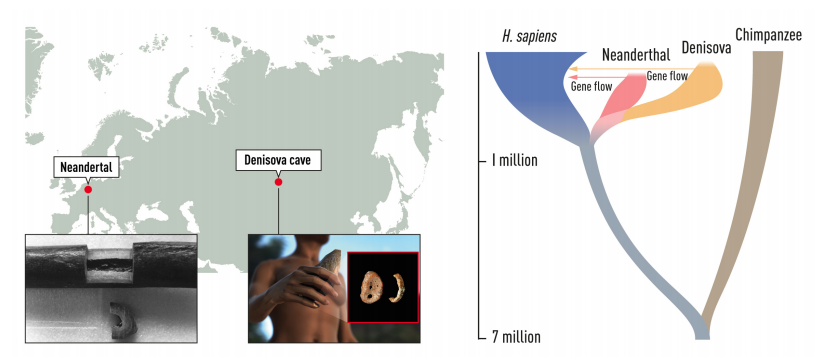
根據細胞核基因組,尼安德塔人、丹尼索瓦人的親戚關係最近,智人比較遠,三群人類間有過多次遺傳交流。圖/取自 參考資料 1 丹尼索瓦人得名於出土化石的遺址(地名來自古時候當地隱士的名字),位於西伯利亞南部的阿爾泰地區,算是中亞。帕波對這兒並不陌生,之前俄羅斯科學家在這裡發現過尼安德塔人化石,而且由於乾燥與寒冷,預計化石中的古代 DNA 保存狀況應該不錯。
帕波戰隊對丹尼索瓦洞穴中的一件小指碎骨定序,首先拼裝出粒線體,驚訝地察覺到這不是智人,卻也不是尼安德塔人,接下來的細胞核基因組重複證實此事。它們變成前後 2 篇論文,帕波出名的不喜歡物種爭論,不使用學名,所以直稱其為「丹尼索瓦人」。
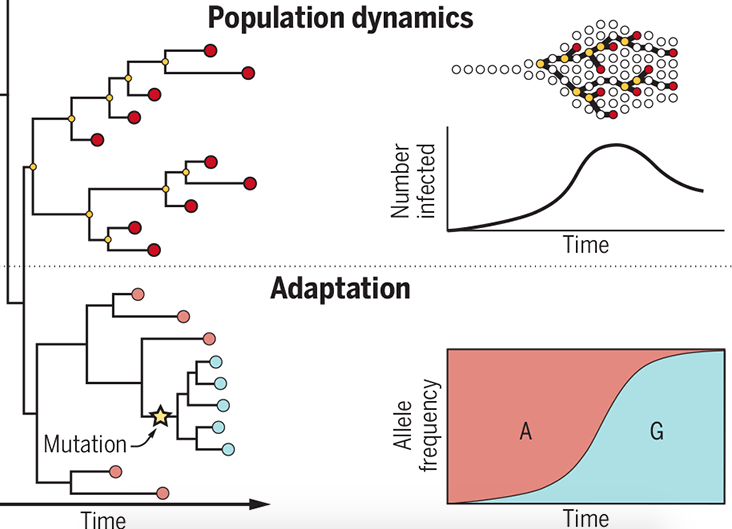
還有幾顆丹尼索瓦洞穴出土的牙齒也尋獲粒線體,而且這些臼齒特別大,型態前所未見。奇妙的是,丹尼索瓦人粒線體、基因組的遺傳史不一樣;和智人、尼安德塔人相比,尼安德塔人的粒線體比較接近智人,細胞核基因組卻比較接近丹尼索瓦人。
這反映古代人類群體間的遺傳交流相當複雜,不只是智人、尼安德塔人,也不只有過一次。後來又在丹尼索瓦洞穴發現一位爸爸是丹尼索瓦人、媽媽是尼安德塔人的混血少女,更是支持不同人群遺傳交流的直接證據。
遠觀丹尼索瓦洞穴。圖/取自論文〈Age estimates for hominin fossils and the onset of the Upper Palaeolithic at Denisova Cave 〉的 Supplementary information 回溯分歧又交織的人類演化史
重現第一個尼安德塔人基因組後,帕波戰隊持續改進定序與分析的技術,也獲得更多樣本,深入不同族群的分家年代、彼此間的混血比例等問題,新知識不斷推陳出新。
丹尼索瓦人方面,如今仍無法確認他們的活動範圍,不過很可能是歐亞大陸偏東部的廣大地區。一如尼安德塔人,丹尼索瓦人也與智人有過遺傳交流。
最初估計某些大洋洲人配備 4% 到 6% 的丹尼索瓦人血緣,後來修正為 2% 左右(不同方法估計的結果不一樣,總之和尼安德塔血緣差不多)。不同智人具備丹尼索瓦 DNA 的比例差異頗大,某些大洋洲人之外,東亞族群也具備些許,歐亞大陸西部的人卻幾乎沒有。
至今年代最古早的人類 DNA,來自西班牙的胡瑟裂谷(Sima de los Huesos),距今 43 萬年左右(最早的是超過一百萬年的古代象,由受到帕波啟發的其餘團隊發表)。根據 DNA 特徵,胡瑟裂谷人的細胞核基因組更接近尼安德塔人,可以視作初期的尼安德塔人族群。然而,他們的粒線體卻更像丹尼索瓦人。
帕波開發的研究方法,不只針對消逝的智人近親,也能用於古代智人與其他生物,累積一批數萬年前智人的基因組。釐清近期的混血事件外,還能探討不同人群當初分家的時期。估計尼安德塔人、丹尼索瓦人約在 40 多萬年前分家,他們和智人的共同祖先,又能追溯到距今 50 到 80 萬年的範圍。
智人何以為智人?遠古血脈的傳承,磨合,新適應
消逝幾萬年的尼安德塔人、丹尼索瓦人,皆為智人的極近親。由於數萬年前的遺傳交流,仍有一部分近親血脈流傳於智人的體內。這些血脈經過數萬年,早已融入成為我們的一部分。
智人的某些基因與基因調控,受到遠古混血影響。最出名的案例,莫過於青藏高原族群(圖博人或藏人)的 EPAS1 基因繼承自丹尼索瓦人,比智人版本的基因更有利於適應缺氧。另外也觀察到許多案例,與免疫、代謝等功能有關。
近年 COVID-19(武漢肺炎、新冠肺炎)席捲世界,觀察到感染者的症狀輕重受到遺傳差異影響;其中至少兩處 DNA 片段,一處會增加、另一處降低住院的機率,都可以追溯到尼安德塔人的遠古混血。
非洲外每個人都有 1% 到 2% 血緣來自尼安德塔人,不同人遺傳到的片段不一樣。將不同智人個體的片段拼起來,大概能湊出 40% 尼安德塔人基因組(不同算法有不同結果),也就是說,當初進入智人族群的尼安德塔 DNA 變異,不少已經失傳。
失傳可能是機率問題,某一段 DNA 剛好沒有智人繼承。但是也可能是由於尼安德塔 DNA 變異,對智人有害或是遺傳不相容,而被天擇淘汰。遺傳重組之故,智人基因組上每個位置,繼承到尼安德塔變異的機率應該差不多;可是相比於體染色體,X 染色體的比例卻明顯偏低;這意謂智人的 X 染色體,不適合換上尼安德塔版本。
智人之所以異於非人者幾希?藉由比較智人的極近親尼安德塔人,能深入思考這個大哉問。是哪些遺傳改變讓智人誕生,後來又衍生出什麼不可取代的遺傳特色?另一方面也能反思,某些我們以為專屬智人的特色,其實並非智人的專利。
分析遺傳序列,畢竟只是鍵盤辦案,一向雄心壯志的帕波,當然想要更進一步解答疑惑。比方說,尼安德塔人、智人間某處 DNA 差異對神經發育有什麼影響?體外培養細胞、模擬器官發育的新穎技術,如今也被帕波引進人類演化學的領域。
瑞典與愛沙尼亞之子,德國製造,替人類做出卓越貢獻的人
回顧完帕波到得獎時的精彩成就,他的工作與生理或醫學有哪些關係,各位讀者可以自行判斷。我還是覺得沒什麼直接關係,如遠古混血影響病毒感染的重症機率這種事,那些 DNA 變異最初是否源自尼安德塔人,其實無關緊要。不過多少還是有些影響,像是為了研究古代基因組而研發出的基因體學分析方法,應該也能用於生醫領域。
《尋找失落的基因組》台灣翻譯本。 帕波 2014 年時發表回憶錄《尋找失落的基因組》,自爆許多內幕。台灣的翻譯出過兩版,可惜目前絕版了。我在 2015 年、2019 年各寫過一篇介紹。書中有許多值得玩味之處,不同讀者會看到不同重點,有興趣可以找來閱讀,看看有什麼啟發。
主題是諾貝爾獎就不能不提,帕波得獎也讓諾貝爾新添一組父子檔,他的爸爸伯格斯特龍(Sune Karl Bergström) 是 1982 年生理或醫學獎得主。為什麼父子不同姓?因為他是隨母姓的私生子,父子間非常不熟。
他的媽媽卡琳.帕波(Karin Pääbo)是愛沙尼亞移民 瑞典的化學家,2007 年去世前曾在訪問提及,她兒子在 13、14 歲時從埃及旅遊回來,對科學產生興趣。帕波獲頒諾貝爾獎後受訪提到,可惜媽媽已經去世,無法與她分享榮耀。移民異國討生活的單親媽媽,能夠養育出得到諾貝爾獎的兒子,也可謂偉大成就。
人類演化的議題弘大淵博,但是究其根本,依然要回歸到一代一代的傳承。每個人都無比渺小,卻也是全人類中的一份子,親身參與其中。諾貝爾生理或醫學獎 2022 年的頒獎選擇,乍看突兀,仔細思索卻頗有深意。帕波的研究也許很不生理或醫學,卻再度強化諾貝爾奬設立的精神:「獎勵替人類做出卓越貢獻的人」。
延伸閱讀
參考資料
Press release: The Nobel Prize in Physiology or Medicine 2022 . NobelPrize.org. Nobel Prize Outreach AB 2022. Wed. 5 Oct 2022.Advanced information. NobelPrize.org. Nobel Prize Outreach AB 2022. Wed. 5 Oct 2022. Geneticist who unmasked lives of ancient humans wins medicine Nobel Ancient DNA pioneer Svante Pääbo wins Nobel Prize in Physiology or Medicine Nature 論文蒐集「Nobel Prize in Physiology or Medicine 2022 」 Estonian descendant Svante Pääbo awarded Nobel prize 本文亦刊載於作者部落格 《盲眼的尼安德塔石匠》 暨其 facebook 同名專頁 。

姓名:簡榮廷 筆名:板橋笑笑生包博 email: jtchien0925@gmail.com 以及 jchien2@emory.edu 美國艾默里大學(Emory University)電腦科學-生物醫學資訊組博士候選人。費德智庫共同創辦人。Sequegenic 生技公司共同創辦人。專長次世代定序科技,機器學習與數據探勘,生物醫學技術,系統生物學。目前於National Yerkes Primate Research Center 之 Malaria Host-Pathogen Interaction Center 團隊下進行瘧疾研究,從基因體學,系統生物學到流行病學全方位更深入的研究瘧疾以期瞭解其機轉並帶動疫苗以及藥物之研發。


 姓名:簡榮廷 筆名:板橋笑笑生包博
email:
姓名:簡榮廷 筆名:板橋笑笑生包博
email: