最近 COVID-19(武漢肺炎、新冠肺炎)成功入侵台灣,造成不少社區傳播,大家必需做好長期抗戰的準備,妥善安排資源,不論生理、心理狀態都要注意,不該太過輕忽,也不可過度緊張,否則過早崩潰,豈不前功盡棄?

瘟疫蔓延之下,遺傳定序是掌握情報的重要手段。這回台灣便透過定序得知,所有在外廣傳的病毒,遺傳上皆可追溯到華航、諾富特飯店最初的感染。
掌握此一關鍵情報以後,台灣當局暫時決定節省資源,短期內除非特殊案例,否則不再全部定序確診者。
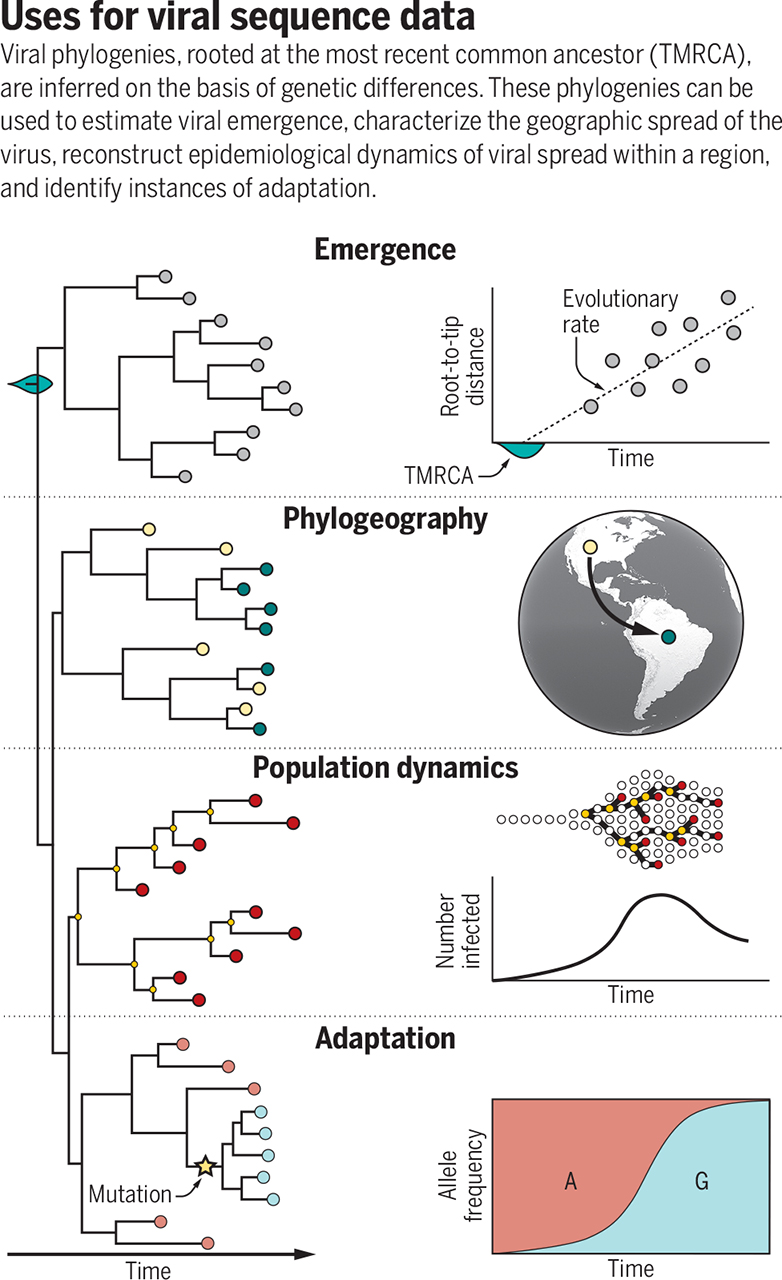
由病毒與病毒的連結,判斷人與人的連結
藉由比對遺傳序列,確認病毒與病毒之間的連結,進而判斷人與人之間的連結,是定序最直接的功能。
SARS 二世冠狀病毒(SARS-CoV-2)是 RNA 病毒,由大約 3 萬個 RNA 組成基因組。過去一年來的追蹤發現,除了極少數例外,病毒突變累積的速度一般不快,平均一個月只有 2 到 3 處改變,也就是平均 11 到 15 天新增一處。

病毒從感染到傳染給下一個人,大部分人的潛伏期未滿 14 天。絕大多數時候,再傳染給下一個人,以及下下一位,甚至是再傳好幾次之內,病毒的遺傳組成都沒有任何改變,或是只有一兩處變化。
- 不過事實上病毒曾經出現過的新突變不少,只是多數沒有傳播成功。延伸閱讀:冠狀病毒常有新突變,不過很少傳染成功
兩位有接觸過的感染者之間,病毒的差異在一兩處以下,便有機會是直接傳染,由此便能追蹤人與人的連結。不過在廣傳的情況下,可能許多感染者都帶有一樣的病毒,即使病毒遺傳序列完全一樣,也未必是源自特定哪一個傳染源。
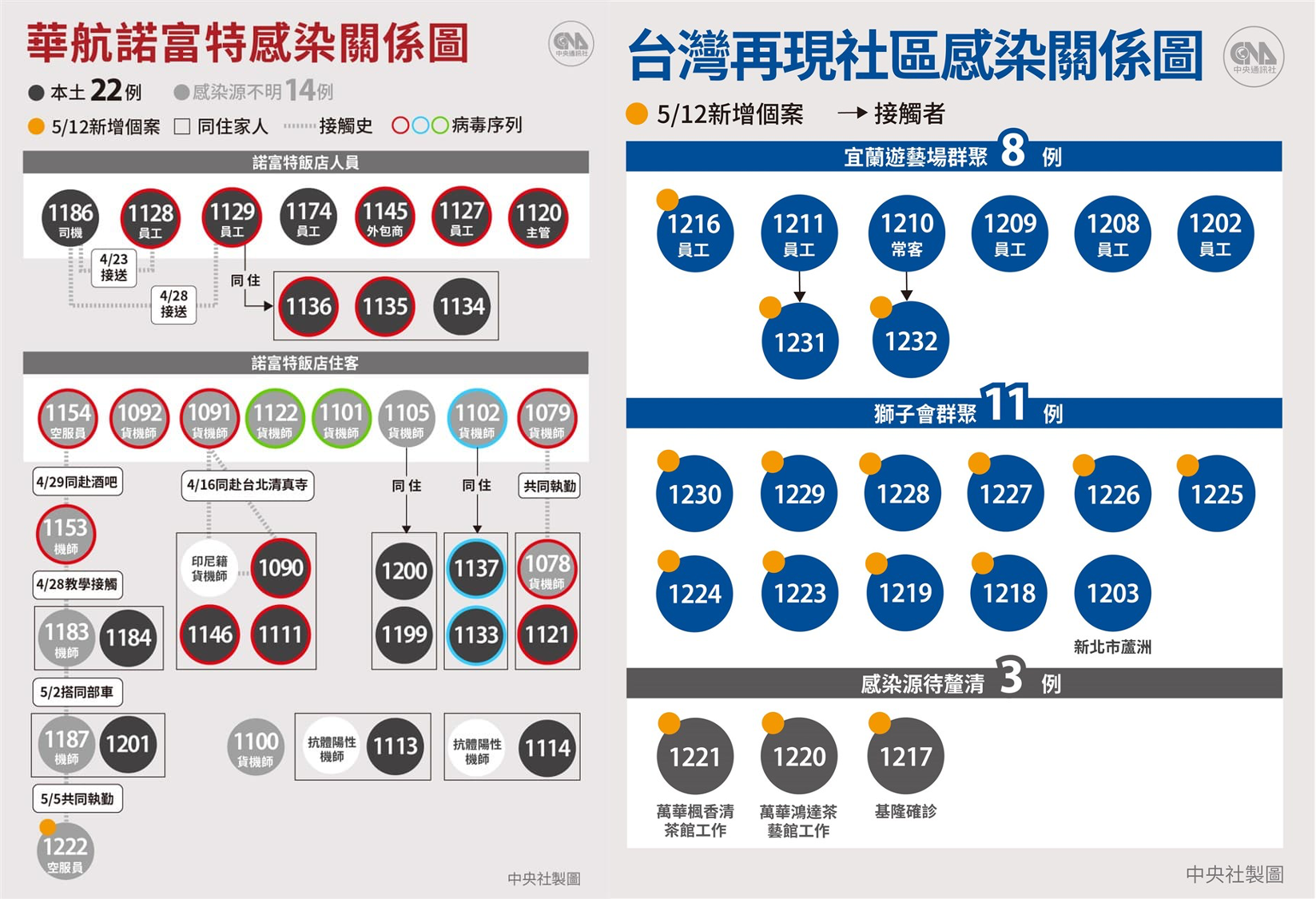
追蹤傳染的源頭與發展
台灣 5 月過後的社區傳播,幾乎可以確認源自一個月前,華航與諾富特飯店的傳染源。那群確診者中多數有定序,皆為最初源自英國的總加速師病毒「B.1.1.7」衍生改版,根據細微差異又可以區分為 3 款。
而隨後的獅子會、萬華、宜蘭、基隆各地確診者的病毒序列,彼此間似乎略有差異,卻依然和華航相關的那 3 款中,其中一款非常類似。
由此推論,即使各地本土感染最初的源頭不清楚,應該還是來自當初航空業者不小心引進的病毒,沒有額外的不明來源。
掌握此一重要訊息後,短期內定序就不再是第一優先的任務。但是這不意謂台灣之後不再需要定序,除了偵測其他可能的境外入侵,我們仍然必需追蹤病毒在本土的演化。

病毒入侵台灣,傳播到各地以後,有各自的發展方向,也會累積不同的突變。定期在各地取樣定序,可以追溯病毒在台灣傳播的過程,有沒有發生變化。
比對不同樣本間的遺傳差異,可以獲知許多情報。如果發現許多人的病毒配備不同變異,便能推論感染規模不小,不同傳染鏈的病毒獨自產生不ㄧ樣的突變,分別傳染給不同人。假如各地病毒沒什麼差異,可能意謂傳播鏈其實不廣,只有少數傳染源,短期內造成相對高比例的傳染。
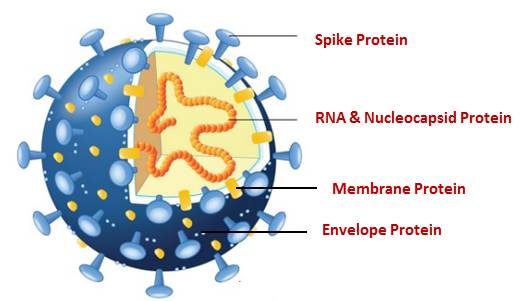
偵測「適應」:更強的病毒來襲,注意!
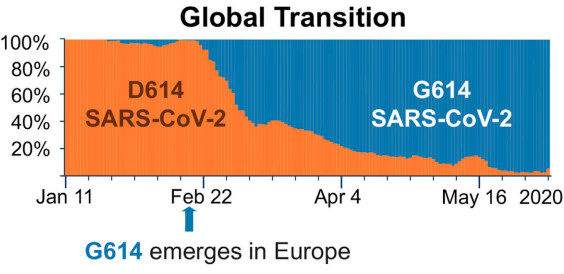
病毒的定序,也能即時追蹤是否有適應發生。這方面最明確的實例,是去年初誕生的 D614G 突變。
病毒以表面的 S 蛋白質(spike protein)接觸、感染宿主細胞,而上頭的 D614G 突變能增強傳染力,相比同類之下更有優勢;D614G 誕生後的存在感一路攀升,最後幾乎徹底取代源自武漢的原版同類。
在 D614G 的基礎上,各地病毒們又各顯神通,獨立累積新的變異,適應新的情境。激烈競爭下,英國誕生的 B.1.1.7、南非的 B.1.351、巴西的 P.1,以及更多新型號病毒陸續脫穎而出。
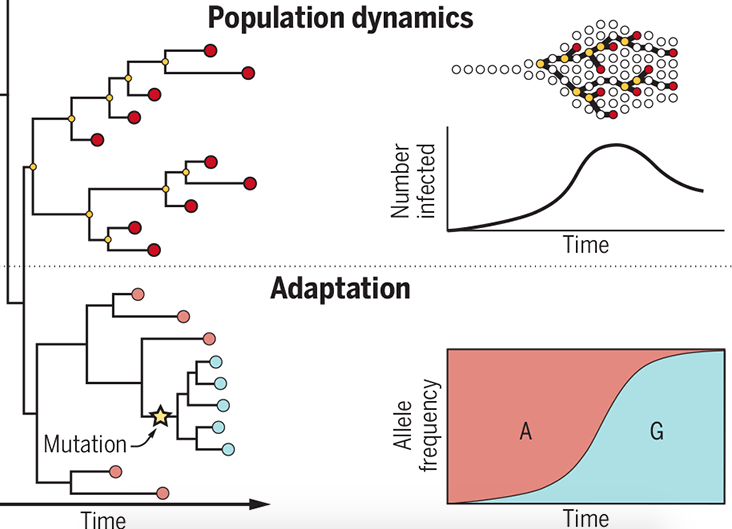
病毒突變是正常的,多數突變反而不利生存,容易被淘汰,但是某些特定位置的突變卻可能帶來優勢,有些能增強傳染,有些能抵制抗體,這些都會令病毒更難對付。
例如當下在台灣廣傳的總加速師「B.1.1.7」,便擁有更強的傳染力。(殺傷力則不是那麼確定,不同研究結論不同,反正沒有降低就是。)
假如某些突變具備優勢,存在感上升的機率更大。
定序病毒基因組除了能追蹤動向,倘若見到如存在感迅速上升之類的狀況,便能及早警覺,也許有新的敵人降臨惹!
瘟疫蔓延時,檢驗找到確診者,阻止新的傳播是當務之急,定序不見得要馬上進行,不過仍然可以先保留樣本,之後慢慢補進度。
了解我們「正處於疫情的什麼階段」是非常重要的一件事,對過去一段時間的認識愈多,愈能掌握目前的狀況,以及預先規劃未來的走向。定序就是一種獲得情報的方法。
延伸閱讀
- 陳建仁與各國專家對自身國內防疫的看法
- 集權卻不威權獨裁—台灣「辛辛納圖斯式」防疫
- 中間宿主和武漢市場—病毒起源的兩大迷思
- 長期感染武漢肺炎,一個人體內的病毒演化生死鬥
- 在世界各地都取得優勢,不只是運氣好?——冠狀病毒的D614G突變(上)
- 結構強化的病毒,傳染力更強——冠狀病毒的D614G突變(下)
參考資料
- Insights from SARS-CoV-2 sequences
- Assessing transmissibility of SARS-CoV-2 lineage B.1.1.7 in England
- Increased mortality in community-tested cases of SARS-CoV-2 lineage B.1.1.7
本文亦刊載於作者部落格《盲眼的尼安德塔石匠》暨其 facebook 同名專頁。