只要控制一個基因,就有黃狗、棕狗、黑狗變化
黑狗、灰狗、棕狗、黃狗、乳牛狗、白狗……狗的毛色非常多變,受到多個基因影響,其中一個基因叫作 Agouti。一項研究調查各種毛色的狗與狼,發現透過不同的調控方式,只要操縱同一個基因,便能產生黑狗到黃狗的深淺變化。
所謂「不同的調控方式」其實是兩段 DNA 序列的組合,在狗被馴化以前已經存在;回溯其演化過程,除了新突變,也涉及未知古狼的遺傳交流。

影響色素的 Agouti(也叫 ASIP)基因不只狗有 ,鼠、兔等哺乳類也都具備。此一基因的蛋白質產物,是個會影響毛囊生產色素的訊號分子,如果不存在,毛囊會生產偏深的 eumelanin 色素;假如存在,會促進偏淺的 pheomelanin 色素形成。
狗狗們都配備一樣的 Agouti 基因,但是基因表現的高低,會導致毛色由淺到深的差異,趨勢是 Agouti 表現愈多,毛色便會愈淺。
不同顏色的狗,基因的編碼 DNA 序列都一樣,那麼基因表現的差異,應該是取決於調控的非編碼序列差異。倘若某些 DNA 變異是影響毛色的原因,我們應該可以看到,具備某款變異的狗是一個顏色,其他變異的狗是另一個顏色。
釐清毛色的遺傳調色盤
為了找到基因型與表現型的關係,研究者定義從很黑到淺黃 5 群不同毛色,比較大家 Agouti 基因周圍的差異。
基因表現受到旁邊的啟動子(promoter)影響,狗的 Agouti 基因有 3 個啟動子,一個距離最遙遠,不同毛色的狗都一樣;而另外兩個啟動子,不同毛色的狗序列有異,看似為影響毛色深淺的成因。
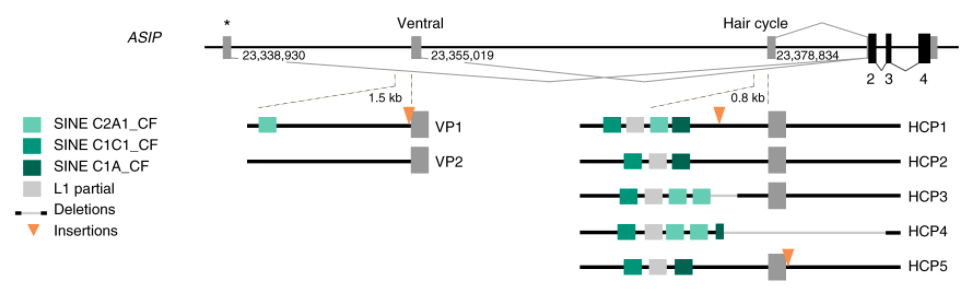
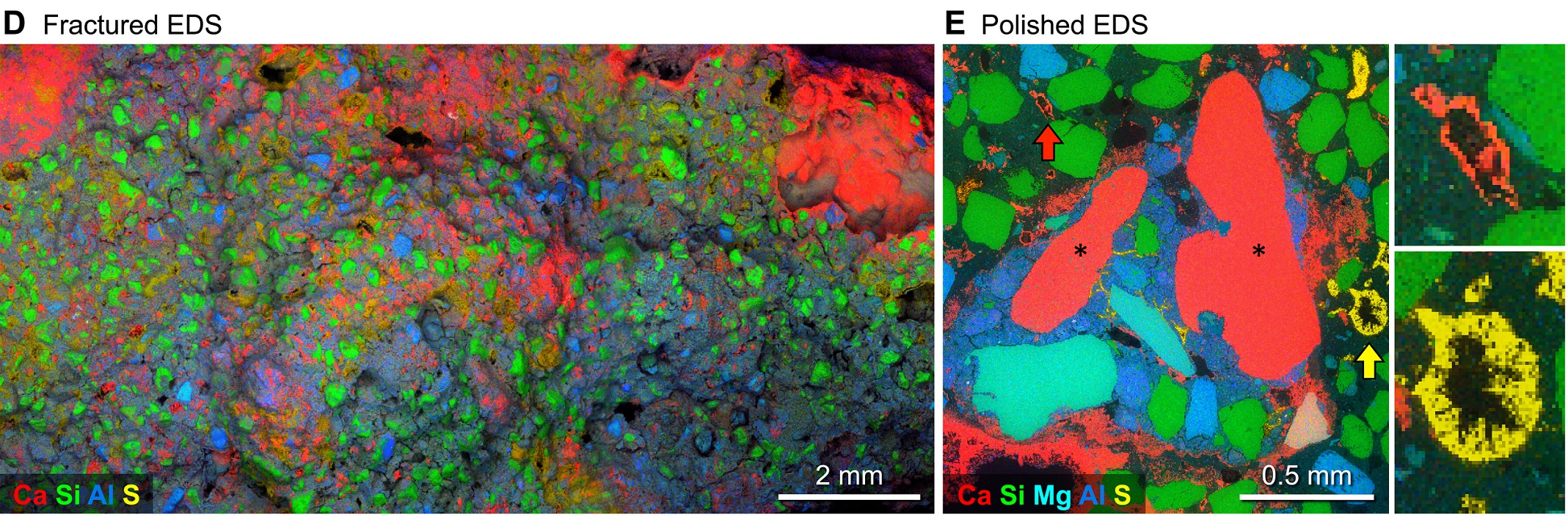
一個啟動子叫作 hair cycle promoter,簡稱 HCP,位置就在基因前方,跟編碼 DNA 連在一起,照序列差異可分為 5 款。另一個啟動子叫作 ventral promoter,簡稱 VP,位置離基因比較遠,可以分為 2 款。
比較各種 HCP 啟動子,5 款中有 3 款會讓基因失去活力;毛色不太受到 Agouti 影響之下,配備 HCP3、HCP4、HCP5 的狗狗都會走深色系。
其餘 2 款,HCP2 令基因表現較低,使得毛色較深;HCP1 讓基因表現較高,毛色較淺,不過仍然會有些色素,毛色將是淺黃狗,不至於到白狗。
另一個啟動子 VP,配備 VP1 的表現較高,毛色淺;配備 VP2 則表現較低,毛色深。
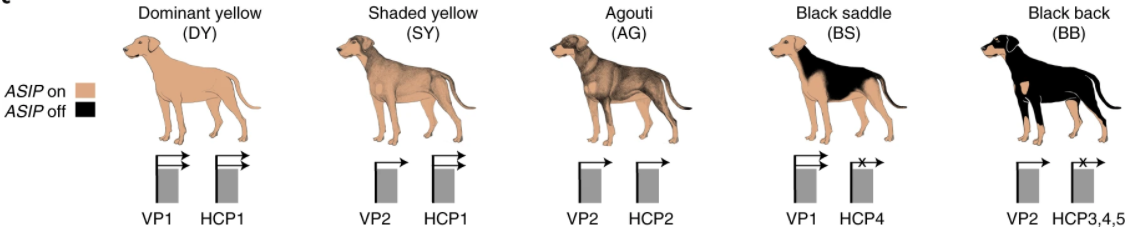
兩段啟動子的序列搭配,可以形成多種組合,例如 VP2 加 HCP4 會是最深的黑狗,VP2 加 HCP1 是棕狗,VP1 加 HCP1 則是最淺的黃狗。
至此,研究者們釐清了毛色表現型與基因型的關係,不過這是怎麼演化而來的呢?進一步分析發現好像有點複雜,有意思的是,VP 與 HCP 的演化史很不一樣。
- 延伸閱讀:《哈士奇的藍眼睛,基因》。之前研究眼睛顏色也發現過,狗的基因不變,調控改變造成顏色不同這回事。

祖傳的毛色調控零件
同一生物分家後,若是不再遺傳交流或受到天擇影響,累積 DNA 改變將隨著時間愈來愈多。因此將大家的遺傳序列擺在一起畫演化樹,呈現的關係通常會符合親戚分家的順序。較晚分家的成員,在演化樹上會比較近,較早分家的則比較遠。
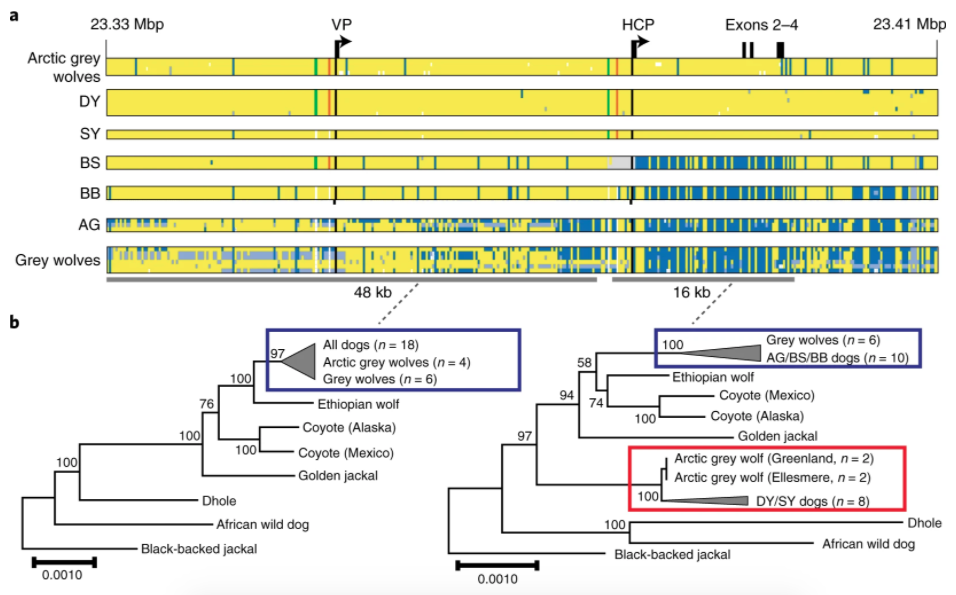
Agouti 基因兩個啟動子周圍的序列,畫出來的演化樹不一樣。只看遠離基因的 VP 周圍序列(48 kb),狗、灰狼、胡狼、豺等親戚,呈現的演化樹和物種關係一致。意思是這段序列的演化,應該是照著親戚分家的過程累積差異。
由序列判斷,VP2 是原本的遺傳型號,後來才衍生出 VP1。長眠於西伯利亞東北部的亞納古狼(Yana),已經配備讓毛色變淺的 VP1,所以這個突變誕生的年代,肯定比他活跳跳的 3.35 萬年前更早,也非常可能早於狗的馴化。
與未知古狼遺傳交流,獲得遠古調控零件
然而,包含基因編碼部分的 HCP 周圍序列(16 kb),各親戚畫出來的演化樹,和物種關係不一樣。狗和灰狼血緣最近,演化樹上卻被歸類到兩個不同分枝。
非洲的豺(dhole) 最早分出,和物種的關係一致。但是在此之後,先分家的是淺色狗和北極狼(Arctic gery wolf),本該與淺色狗被歸為同一群的深色狗和灰狼,之間還夾著衣索比亞狼( Ethiopian wolf)、郊狼(coyote)、亞洲胡狼(golden jackal),這些親戚關係差異更大的物種。
很明顯,HCP 此一調控基因表現的零件,有狼沒有照著祖傳繼承。詳細考量 DNA 差異,論文推論最可能的狀況是:狗、灰狼、圖博狼(Tibetan wolf,也叫西藏狼、喜馬拉雅狼)、郊狼、亞洲胡狼等親戚,在共同祖先的時期配備 HCP2,很近期的某群狗又衍生出毛色變深的 HCP5。
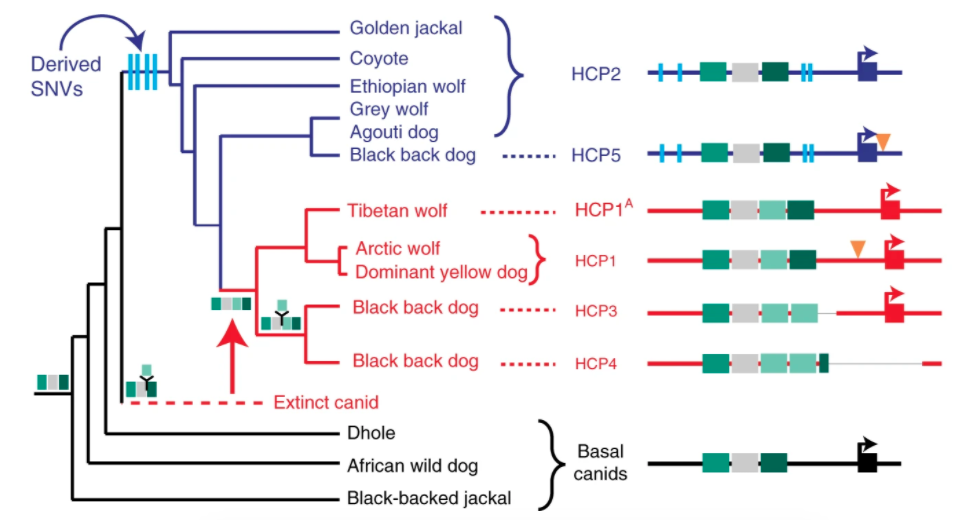
而圖博狼、北極狼與狗的 HCP1 是哪來的?依照演化關係推論,它本來應該存在於某種未知的古狼,其演化位置處於和豺分家之後,亞洲胡狼、郊狼、灰狼分家之前(約超過 200 萬年)。某個時刻未知古狼基因突變,誕生了 HCP1,又透過情慾交流使 HCP1 傳進其他狼群。
目前資訊不可能得知未知古狼是誰,遺傳交流發生在什麼時候,論文也沒有太多著墨。我們不要太在意細節!只能看出圖博狼似乎保留變化最少的 HCP1 型號,北極狼與狗的 HCP1 改變較多;而某些黑狗的祖先,又衍生出令毛色變深的 HCP3 和 HCP4。
毛色變淺,有助於適應雪地環境?
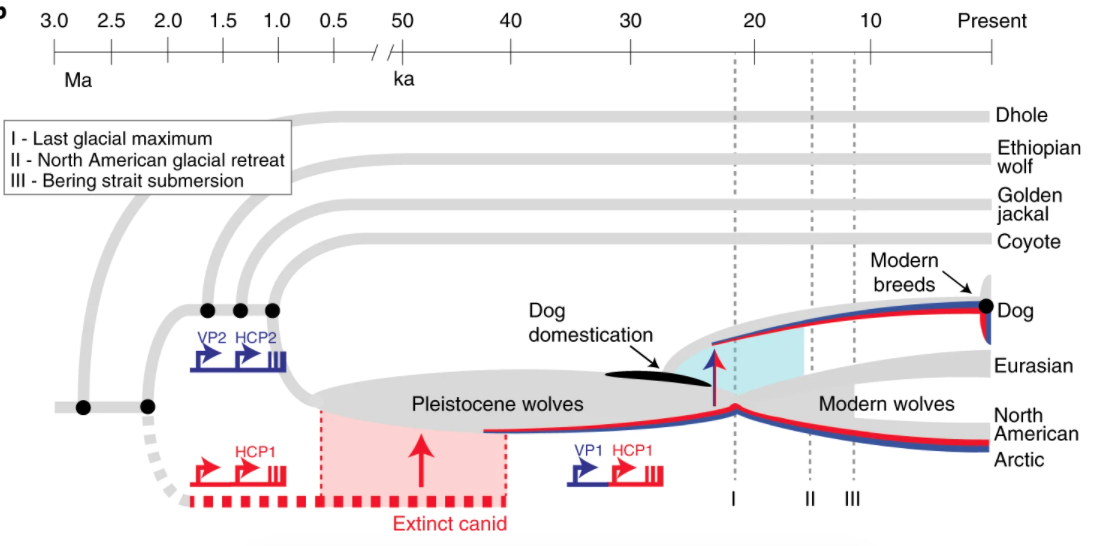
論文推論,情慾流動而來的 HCP1 能幫助適應雪地。因為住在北極區的灰狼,以及青藏高原與蒙古的圖博狼,兩地環境頗有相似,都配備會讓毛色變淺的 HCP1。

控制毛色的 2 個遺傳零件,最淺組合為 VP1 加 HCP1。現代各地的灰狼中,只有北美洲部分灰狼長這樣,主要住在北極區,歐亞大陸都沒有。
已知的古代樣本中, VP1 加 HCP1 組合最早見於距今 3.35 萬年的亞納古狼;可以推論人類尚未馴化狗以前,古代早有野生的淺毛狼存在。
不過他的近親兼鄰居,3.5 萬年前也住在西伯利亞東北部的泰梅爾古狼(Taimyr)毛色倒是比較深。不見得住在雪地,一定要長成淺毛。
- 延伸閱讀:西伯利亞古狼,冰河時期結束後滅團
你要淺色狗,還是深色狗?
狗最初馴化的狀況,可謂曖昧難解。狗源自某群灰狼,在距今 1.5 到 4 萬年前馴化(亞納古狼的分家時間更早,並非狗的直系祖先),但是具體的時間、地點,一次、兩次或更多次都不清楚。
綜合現有資訊推測,大部分毛色的可能組合,在一萬年前都已經存在;接下來的發展,應該同時受到環境適應與人為偏好影響。
論文分析中,最早的淺黃狗距今 4800 年,位於愛爾蘭;可是遺傳上分家很早的澳洲野犬(Dingo)、新幾內亞唱犬(New Guinea singing dog)也是黃狗,可見黃毛狗的基因歷史悠久。
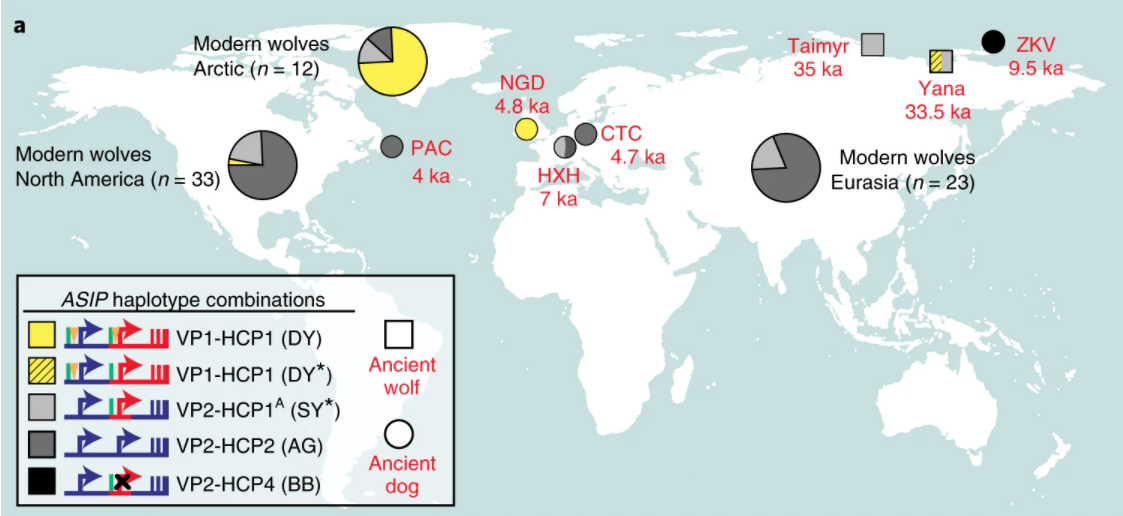
出土於西伯利亞東北部的若霍夫島(Zhokhov Island,ZKV),距今 9500 年的古狗,遺傳是 VP2 加 HCP4,應當為毛色最深的黑狗。他可謂白雪中的黑色雪橇犬,這是人類為了方便識別,有意挑選的結果嗎?
令毛色變淺的遺傳零件 VP1 和 HCP1,在狗馴化之前已經存在。但是使得毛色變深的突變們,其實也一直誕生,而且是在狗馴化之後多次發生:HCP2 衍生出 HCP5、HCP1 變成 HCP3、HCP1 變成 HCP4。若霍夫古狗的 HCP4 便是早期案例。
最後歸納一下重點。新研究釐清了狗、狼毛色與遺傳的關係:Agouti 基因的兩個調控零件搭配組合,能形成由黑到黃的深淺毛色。毛色既有的可能性中,野生狼受到環境影響;馴化狗出現以後,除了環境適應,還取決於人為的偏好。
延伸閱讀
- 哈士奇的藍眼睛,基因
- 天殺的月月!你的狼性呢?從 DNA 追尋狗勾起源!
- 西伯利亞古狼,冰河時期結束後滅團
- 狗狗源始-2萬多年前的西伯利亞?
- 短篇是誰把狗帶到澳洲?澳洲野犬dingo可能的來歷
- 與狼混血,讓藏獒適應高海拔
- 貓貓的世界征服史:從抓老鼠到沙發馬鈴薯
- 讓南非桑族膚色變淺的基因,2000年內情慾流動來到
參考資料
- Bannasch, D. L., Kaelin, C. B., Letko, A., Loechel, R., Hug, P., Jagannathan, V., … & Leeb, T. (2021). Dog colour patterns explained by modular promoters of ancient canid origin. Nature ecology & evolution, 1-9.
- Dog coat patterns have ancient origin
- Genetic enigma solved
- Bergström, A., Frantz, L., Schmidt, R., Ersmark, E., Lebrasseur, O., Girdland-Flink, L., … & Skoglund, P. (2020). Origins and genetic legacy of prehistoric dogs. Science, 370(6516), 557-564.
- Sinding, M. H. S., Gopalakrishnan, S., Ramos-Madrigal, J., de Manuel, M., Pitulko, V. V., Kuderna, L., … & Gilbert, M. T. P. (2020). Arctic-adapted dogs emerged at the Pleistocene–Holocene transition. Science, 368(6498), 1495-1499.
- Ramos-Madrigal, J., Sinding, M. H. S., Carøe, C., Mak, S. S., Niemann, J., Castruita, J. A. S., … & Gopalakrishnan, S. (2020). Genomes of Pleistocene Siberian wolves uncover multiple extinct wolf lineages. Current Biology.
本文亦刊載於作者部落格《盲眼的尼安德塔石匠》暨其 facebook 同名專頁。