本文轉載自諾貝爾化學獎專題系列 ,原文為《【2004諾貝爾化學獎】蛋白質的分解機器 》
譯者前言:今年的諾貝爾化學獎又落入了生化學家的口袋,連續兩年頒給生化學者並不常見,我想這應該是反映了現在化學研究的熱門趨勢。今年的諾貝爾化學獎讓我們注意到細胞是如何精妙的去控制它的蛋白質系統,昨日(十月六日)我在中研院生醫所聽了一場 2002 年諾貝爾生理及藥學獎的得主 H. Robert Horvitz 的演講,那是另一個熱門的題目:細胞凋亡,真是一場精采的演講,同樣的我們看到這些蛋白質的另一種運作。前幾日與一位生技系的學生聊到他未來想走的方向,言談之間他似乎認為蛋白質的化學已經熱門了好一陣子了,恐怕熱潮已過。不過從現實來看,在諾大的生命體系中,我們對它的瞭解實在是太少了,由這些蛋白質的研究看來,我覺得蛋白質的化學仍應是方興未艾吧!
後記: 詹健偉是我在 2003 年教過的學生,他原在植微系,後來轉入了生化科技系,從起初對生物系統的興趣加上對化學的熱愛導致他轉入生化科技的領域,然而這些年他逐漸的體認:「只有化學才能完美的解釋生物體系」,現在他已經決定投入“化學生物學”的領域。健偉是個認真的學生,他讀我的翻譯文章極為仔細,更進一步的從一個學生化的背景看出我許多翻譯的謬誤以及不通順之處。約莫半年前碰到他,他主動的提及願意幫我修改,一直到最近才讓我如願。有學生如此,是我的福分,感謝健偉也祝福他!
— 蔡蘊明 謹誌於 2006 年 10 月 9 日
一個人的細胞中含有上百萬種的不同蛋白質,它們具有無數的重要功能:例如以酵素(或稱為酶)的型式存在的化學反應加速者,以荷爾蒙的型式存在的訊息傳導物質,在免疫的防禦上扮演要角以及負責細胞的型態和結構。今年的諾貝爾化學獎得主:席嘉諾佛(Aaron Ciechanover)、赫西柯(Avram Hershko)以及羅斯(Irwin Rose)研究在細胞中如何對一些不需要的蛋白質加上一種稱為泛素(ubiquitin)的多胜肽標籤,藉以調節某些蛋白質的存在,他們的研究在化學知識上有重要的突破。這些被加上標籤的蛋白質,接著會在一個稱為蛋白解體(proteasome)的細胞"垃圾處理機"中迅速的降解。
透過他們發現的這個蛋白質調節系統,這三位學者使得我們能在分子的層次瞭解細胞如何的控制許多重要的生化程序,例如細胞週期、DNA 的修補、基因的轉錄以及新合成之蛋白質的品質管制。有關這種形式之蛋白質凋亡控制的新知識也使得我們能解釋免疫防禦系統如何的運作,這個系統的缺陷可造成包括癌症在內的不同疾病。
被貼上毀滅標籤的蛋白質 分解是否需要能量? 當大部分的注意力和研究都集中在企圖瞭解細胞如何的控制某些蛋白質的合成時(這方面的研究產生了五個諾貝爾獎),與其相反的蛋白質降解則一直被視為是較不重要的。其實有一些簡單的蛋白質降解酶是早就知道的,一個例子就是胰蛋白酶(trypsin),這是一個存在於小腸中,將食物中的蛋白質分解為胺基酸的一種酵素。類似的,有一種稱為溶體(lysosome)的細胞胞器也早就被研究過,它的功能是把由細胞外吸入的蛋白質降解。這些降解程序的共通性在於這些功能不需要能量。
不過早在 1950 年代的實驗就顯示要分解細胞本身所具有的蛋白質是需要能量的,這個現象一直困擾著研究者,這個矛盾也就是今年的諾貝爾化學獎的背景:亦即細胞內蛋白質的分解需要能量,但是其它蛋白質的分解卻不需要額外的能量。解釋這個需要能量的蛋白質分解過程是由 Goldberg 與其研究夥伴在 1977 年踏出了第一步,他們從一種稱為網狀紅血球(reticulocyte)之未成熟的紅血球,製造出一個不含細胞的萃取物,倚賴ATP(ATP = adenosine triphosphate;是一種細胞的能量貨幣)的能量,這種物質可以催化不正常蛋白質的分解。
運用這個萃取物,今年的三位諾貝爾化學獎得主在 1970 年代後期及 1980 年代初,透過一系列劃時代的生化研究,成功的顯示在細胞中的蛋白質分解,是透過一系列一步步的反應,導致要被摧毀的蛋白質被掛上一個稱為泛素(ubiquitin)的多胜肽標籤。這個過程使得細胞可以非常高的專一性分解不需要的蛋白質,而且就是這一個調控的過程需要能量。與可逆的蛋白質修飾例如磷酸化(1992 年的諾貝爾生理醫學獎)不同之處是:被聚泛素化(polyubiquitination)調控的反應,常是不可逆的,因為被掛上標籤的蛋白質最後被摧毀了。大部分的這些工作是在以色列 Haifa 大學的赫西柯以及席嘉諾佛在休假年,於美國費城的 Fox Chase 癌症中心的羅斯博士的實驗室所完成的。
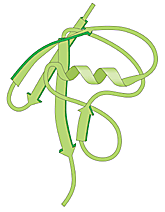
泛素的標籤 這個後來被發現用在需要分解掉的蛋白質上所貼的標籤,早在 1975 年就從小牛胸腺中被分離出來,它是一個由 76 個胺基酸所組成的多肽,該分子被認為參與在白血球的成熟過程中,其後由於這個化學分子在各種不同的組織和生物體中(細菌除外)亦被發現,因此被賦予了泛素(ubiquitin)的名稱(ubique在希臘文中有到處或廣泛的意思)(圖一)。
(圖一)泛素:一個共通的多胜肽代表"死亡之吻" 發現由泛素所媒介的蛋白質分解 在赫西柯取得博士學位之後,研究了一陣子肝細胞中倚賴能量的蛋白質分解,不過在 1977 年決定改為研究上述的網狀紅血球萃取物,這個萃取物含有大量的血紅素,嚴重的影響實驗,在企圖利用層析法來去除血紅素時,席嘉諾佛以及赫西柯發現這個萃取物可被分成兩個部分,二者個別都沒有生化活性,但是他們發現一旦二者混合在一起,那個倚賴 ATP 的蛋白質分解活性就恢復了。在 1978 年他們發表了其中一個部分中的具活性物質,是一個對熱穩定的多肽,分子量只有 9000,他們稱之為 APF-1,這個物質後來證實為泛素。
席嘉諾佛,赫西柯,與羅斯在 1980 年發表了兩份決定性的突破工作,在這之前 APF-1 的功能是完全不清楚的。這頭一份報告顯示 APF-1 是以共價鍵(就是一種很穩定的化學鍵結)與萃取物中的各種不同蛋白質結合。在第二部份的報告更進一步的顯示有許多個 APF-1 鍵結在同一個目標蛋白上,此一現象被稱為聚泛素化(polyubiquitination)。我們現在知道這個將目標蛋白質多次泛素化的步驟,是一個導致蛋白質在蛋白解體(proteasome)中降解的啟動信號;也就是這個聚泛素化反應,在蛋白質貼上降解的標籤,或可稱其為"死亡之吻"。
就這麼一擊,這些完全未預期的發現,改變了其後的研究方向:現在就可以集中力量開始鑑定那些將泛素接上蛋白質標靶的酵素系統。由於泛素普遍的存在於各種不同的組織和生物體中,大家很快的體認到,由泛素所媒介的蛋白質分解對細胞一定是很普遍而重要的。研究者更進一步的推測,那個倚賴 ATP 的能量需求,可能是為了讓細胞控制這個程序的專一性。
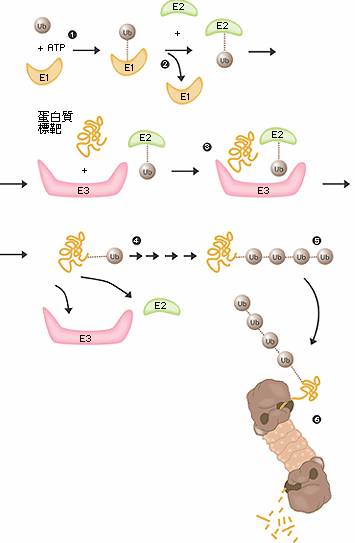
這個研究領域就此大開,而在 1981 到 1983 年間,席嘉諾佛,赫西柯,羅斯與他們的博士後研究員及研究生發展了一套“多重步驟泛素標籤化假說”,這個假說是基於三個新發現之酵素的活性,他們稱這三個酵素為 E1、E2與E3(圖二)。我們現在知道一個尋常的哺乳類細胞含有一個或數個不同的 E1 酵素,大約幾十個 E2 酵素,以及幾百個不同的 E3 酵素,就是這個 E3 酵素的專一性,決定了在細胞中要為哪些蛋白質貼上標籤,然後在垃圾處理機中摧毀。
到這個節骨眼為止,所有的研究都是在沒有細胞的系統中進行的,為了也能夠研究泛素所媒介的蛋白質降解之生理功能,赫西柯與其協同工作人員發展了一種免疫化學方法:用數種放射性胺基酸,以瞬間脈衝的方式來培養細胞,可標定細胞內某一個瞬間所合成的蛋白質。但是泛素中剛好沒有這幾種胺基酸,所以在這瞬間合成的泛素並未被放射性標記。利用泛素的抗體,可以將 "泛素-蛋白質"複合體自該細胞中分離出來,而其中的蛋白質的確具有放射性標記。實驗結果顯示,細胞中也確實以泛素系統來分解有缺陷的蛋白。我們現在知道細胞中大約 30% 的新合成蛋白質都會被垃圾處理機分解,因為它們沒有通過細胞的嚴格品質管制。
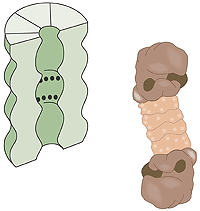
(圖二)泛素所媒介的蛋白質降解 E1 酵素活化泛素分子,這個步驟需要 ATP 形式的能量。 泛素分子被轉移到另一個不同的酵素 E2。 E3 酵素可辨認需要摧毀的目標蛋白質,"E2-泛素"複合物和"E3酵素"結合的位置,非常接近目標蛋白質。這個非常接近的距離,使得泛素標籤足以被轉移到目標蛋白上。 E3 酵素釋放出具有泛素標記的蛋白質。 最後一步重複數次直到一個由泛素分子構成的的短鏈接在目標蛋白質上。 這個泛素的短鏈在垃圾處理機的開口處被辨識後,泛素標籤脫落而蛋白質被允許進入並被切成碎片。 蛋白解體-細胞的垃圾處理機 什麼是蛋白解體?一個人類細胞含有約 30,000 個蛋白解體,這個桶狀的結構體可以基本上將所有的蛋白質分解為七到九個胺基酸長短的胜肽,蛋白解體的活性表面是位於桶的內璧,也就是與細胞的其它部份是分隔開來的,唯一能進入蛋白解體的桶中活性表面的方式是必須透過"鎖",鎖能夠辨認接有多個泛素構成的短鏈之蛋白質,藉由 ATP 的能量將蛋白質變性(denature),並在泛素構成的短鏈移除後允許蛋白質進入,並將之降解,降解出來的胜肽由蛋白解體的另外一端釋放出來。因此蛋白解體本身並不能挑選蛋白質,決定哪一些蛋白質需要貼上銷毀的標籤,是 E3 酵素的工作。(圖三)
(圖三)細胞的垃圾處理機。黑點代表具有蛋白質分解活性的表面。 最近的研究 當貼上泛素標籤的蛋白質分解過程背後的生化機制在 1983 年被暴露後,它在生理學上的重要性尚未能完全掌握,雖然知道它在銷毀細胞內具有缺陷的蛋白質上是非常重要的,但是再進一步的,就需要一個突變的細胞來研究泛素的系統,藉著仔細的研究一個突變的細胞與正常的細胞在不同的生長條件下有何不同,希望知道細胞中有哪些反應是與泛素的系統有關,這才能得到更清晰的概念。
一個突變的老鼠細胞在 1980 年由一個東京的研究小組分離出來,他們的突變老鼠細胞含有一個因為突變之故而對溫度非常敏感的蛋白質。在較低溫度時它能發揮應有的功能,但是在高溫時則否,因此在高溫時培養的細胞會停止生長。此外,在高溫時它們顯示其 DNA 的合成會有缺陷以及一些其它的錯誤功能。一群在波士頓的研究人員很快的發現這個突變鼠細胞中對熱敏感的蛋白質是泛素活化酵素 E1,顯然泛素的活化對細胞的運作及複製是不可或缺的,正常蛋白質分解控管不僅對細胞中不正確蛋白質的銷毀很重要,也可能參與了細胞週期、DNA 的複製以及染色體結構的控管。
從 1980 年代末期開始,研究者鑑定出許多生理上很重要的基質是泛素所媒介的蛋白質分解機制中的標靶,在此我們僅提幾個最重要的為例子。
避免植物的自我授粉 大部份的植物是兩性或雌雄同株的,自我授粉將會導致基因多樣性的逐漸喪失,長期而言將造成該物種的完全絕滅,因此為了避免這個情形,植物利用泛素所媒介的蛋白質分解機制來排除"自身"的花粉,雖然完整的機制尚未明朗,但是已知 E3 酵素參與了運作,而且當加入蛋白解體的抑制劑時,排除自身花粉的能力就被削弱。
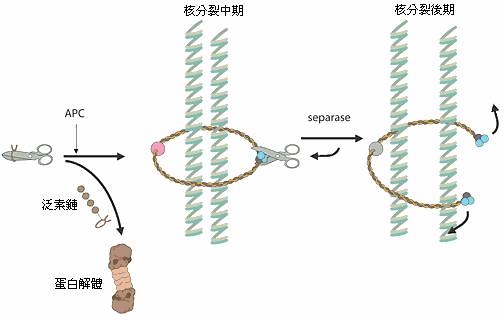
(圖四)細胞週期中控制染色體分離的機制:剪刀代表分解蛋白質的酵素而綁住剪刀的繩子代表它的抑制劑,APC 將這條繩子貼上標籤造成繩子的分解,剪刀就會釋放出來,接著將那條綁在染色體周圍的繩子切斷,最後造成染色體分離。 細胞週期的控制 當一個細胞要複製自己的時候會有許多的化學反應參與其中,在人體中的 DNA 有六十億個鹼基對必須複製,它們聚集成必須拷貝的 23 對染色體。普通的細胞分裂(也就是有絲分裂),形成生殖細胞(減數分裂),都與今年的諾貝爾化學獎的研究領域有許多交集。在此運作的 E3 酵素稱為"有絲分裂後期促進複合體"(anaphase-promoting complex簡稱 APC),其功能在檢查細胞是否離開了有絲分裂期,這個酵素複合體也被發現在有絲分裂及減數分裂過程中,對染色體的分離扮演了重要的角色。有一個不同的蛋白質複合體,它的功能就好像是一條綁在染色體周圍的繩子,將一對染色體綁在一起(圖四)。在一個特定的訊號出現後,APC 會在一個"降解蛋白質酵素"的抑制劑上貼上標籤,因此這個抑制劑就會被帶到蛋白解體中分解掉,而前述的那個降解蛋白質的酵素就會被釋放出來,在經過活化後將那條綁在染色體周圍的繩子切斷,一但繩子脫落,那一對染色體就會分離。在減數分裂時,錯誤的染色體分裂,是造成孕婦自然流產最常見的原因;一條多出來的人類第 21 號染色體會導致唐氏症;大部份的惡性腫瘤會具有數目改變的染色體,其原因也是由於有絲分裂時錯誤的染色體分裂。
DNA 的修補,癌症以及細胞凋亡 蛋白質 p53 被封為"基因體的守護神",它也是一個腫瘤抑制基因(tumor-suppressor gene),這個意思是只要細胞能製造 p53 就可以阻擋癌症的發生。可以非常確定的,在所有人類癌症中有至少一半的蛋白質是突變的。在一個正常細胞中,蛋白質 p53 一直不斷的被製造和分解,因此其數量是很低的,而它的分解是透過泛素標籤化過程以及負責與 p53 形成複合體的相關 E3 酵素來調控;當 DNA 受到損傷後,蛋白質 p53 會被磷酸化而無法與 E3 酵素結合,p53 的分解無法進行,因此細胞內的 p53 數量迅速增高。蛋白質 p53 的功能是作為一個轉錄因子(transcription factor),換言之就是一個調控某些基因表現的蛋白質。蛋白質 p53 會與控制 DNA 修補以及細胞凋亡的基因結合,並調控該基因,當它的數量升高時會影響細胞週期藉以保留時間給 DNA 修補的運作,倘若這個 DNA 的損傷過於嚴重,計劃性細胞凋亡將會啟動而導致細胞的"自殺"。
人類乳突病毒的感染與子宮頸癌的發生有極大的關聯性,這個病毒避開了 p53 所控制的關卡,它的方法是透過它的蛋白質去活化並改變某一個 E3 酵素(稱為 E6-AP)的辨識行為,E6-AP 被騙去將蛋白質 p53 貼上死亡的標籤而造成 p53 的消失,這個後果是被感染的細胞無法正常的修補其 DNA 所受到的傷害或者引起計劃性細胞凋亡,DNA 突變的數目增加最後終於導致癌症的發生。
免疫與發炎反應 有某一個轉錄因子調控著細胞中許多與免疫防禦及發炎反應有關的重要基因,這個蛋白質,亦即這個轉錄因子,在細胞質中是與一個抑制蛋白質結合在一起的,在這個結合的狀態下,此一轉錄因子是沒有活性的。當細胞暴露到病毒時或有其它的訊號物質出現時,這個抑制蛋白質就會被磷酸化,接著被貼上銷毀的標籤而送到蛋白解體中分解掉,此時被釋放出來的轉錄因子被運送到細胞核中,在那裡它與某些特定的基因結合,進而啟動這些基因的表現。
免疫防禦系統中,被病毒感染的細胞,會利用泛素-蛋白解體系統,將病毒蛋白質降解到適當大小的多肽,這些多肽會被呈獻到細胞的表面。T 淋巴細胞會辨識這些多肽然後攻擊這些細胞,這是我們的免疫系統對抗病毒感染的一項重要防禦方式。
纖維囊腫症(cystic fibrosis) 一個稱為纖維囊腫症的遺傳疾病,簡稱 CF,是由一種不具功能的細胞膜氯離子通道(稱為 CFTR;纖維囊腫跨膜通道傳導調節蛋白)所造成。大部份的纖維囊腫病患都具有一個相同的基因損傷,也就是一個在 CFTR 蛋白質上缺少了一個苯丙胺酸的胺基酸。這個突變導致了這個蛋白質的錯誤摺疊結構,使得該錯誤摺疊蛋白被保留在細胞的蛋白質品管系統中,這個品管系統要確實的將此一錯誤摺疊的蛋白質透過泛素-蛋白解體系統銷毀,而不能將之傳送到細胞膜上,一個沒有正常氯離子通道的細胞將無法透過細胞膜傳送氯離子,這就影響到肺部以及一些其它組織的分泌系統,造成肺黏膜液的增加而破壞其功能,更大幅的增加其受到感染的危險性。
這個泛素系統已經成為一個很有趣的研究領域,可用來發展治療各種疾病的藥物,在此的工作方向可以利用泛素所媒介的蛋白質分解機制去避免某些特定蛋白質的分解,也可以設計成讓這個系統將某一個不想要的蛋白質清除。已經有一個在進行臨床實驗的藥,那是一個稱為 Velcade(PS341)的蛋白解體抑制劑,可以用來醫治多重性骨髓瘤(multiple myeloma),這是一種會影響體內製造抗原的細胞的一種癌症。
今年的得獎者從分子的基礎上解釋了一個對高等細胞而言極為重要的蛋白質控制系統,由泛素所媒介的蛋白質分解機制所控制的細胞功能,現在一直不斷的有新的發現,而這方面的研究也在世界各地無數的實驗室中進行著。
參考資料 這份文章是譯自諾貝爾獎委員會公佈給大眾的閱讀資料:
http://nobelprize.org/chemistry/laureates/2004/public.html
有意進一步的瞭解就得詳讀以下資訊:
http://nobelprize.org/chemistry/laureates/2004/adv.html
原文附有一個很精采的動畫,對這個蛋白質控制系統有畫龍點睛之妙,推薦各位看看:
http://nobelprize.org/chemistry/laureates/2004/animation.html