治療血癌的醫療新科技 CAR-T,是一種把 T 細胞做成活的藥品,釋放到身體內治療癌症的新療法,能夠把血液和淋巴系統裡的癌細胞清理得乾乾淨淨。
2022 年 11 月出現了一種新的免疫療法,目前已通過人體臨床一期試驗。其能夠攻克肺癌、乳癌、大腸癌等會長出實體腫瘤的癌症,而這些實體癌就是目前 CAR-T 還難以突破的瓶頸。
究竟這是什麼樣的療法?有沒有副作用呢?又有哪些障礙等待突破?
可以治療哪些癌症
這次公開的新醫療技術還沒有全球一致的名稱,我們暫時先採用生醫領域對這類操控 T 細胞科技的俗稱:個人化 T 細胞受體 T 細胞療法(personalized TCR T-cell therapies;本文使用「TCR-T 療法」稱之),目前已通過人體臨床一期試驗,其結果發表於《Nature》期刊。
TCR 為 T 細胞受體(T cell receptor)的縮寫,是位在細胞表面的一種蛋白質。T 細胞則是人體白血球的一種,可以將其比喻成一批 24 小時在體內巡邏的軍隊,T 細胞會使用 TCR 來分辨正常細胞和外來異物,一旦偵測到病毒、細菌或癌細胞,就會馬上發動攻擊,把它們殺掉。
接著,我們進一步來看《Nature》上的 TCR-T 人體試驗報告。結果表明,一期臨床試驗總共治療 16 位病人,其中 5 個人腫瘤大小維持不變或縮小了一點,11 個人的腫瘤還是繼續長大。
看到這結果你可能會想:效果明明很差啊!
是這樣的,TCR-T 療法對於專業人士來說,有三大看點:
- 這 16 名患者都是實體癌症的患者,實體腫瘤是目前各種細胞療法公認,最難攻克的敵人,而且佔了超過九成的所有癌症患者人數。
- 受試病人的癌症種類分散:11 人是大腸直腸癌、2 人是乳癌,肺癌、卵巢癌、皮膚惡性黑色素瘤各 1 人。
- 治療後的病理檢查證實,TCR-T 療法使用的改造 T 細胞有聚集在腫瘤組織,並且留下了發動攻擊的痕跡。也就是說,TCR-T 確實能向導向飛彈一樣,準確追蹤癌細胞,而且不只追得到,還能展開轟炸!
這次的人體臨床試驗是為了確定 TCR-T 療法的安全性,因此先使用較低的劑量來治療;試驗結果驗證了其可行性,副作用也在可接受範圍內。故接下來的目標為調整出最佳劑量和確認治療條件,且有機會成為泛用型的療法,可治療多種癌症,不侷限於只能針對單一癌種。
製作原理與方法
TCR-T 療法可謂「基因工程+數位科技」攜手合作的成果。
概略來說,TCR-T 是融合了兩股力量才能實現的:一為電腦的演算法,用來推測要怎樣修改 T 細胞裡的特定基因;另一個是基因剪刀 CRISPR-Cas9,按照計算出來的結果去編輯細胞基因。
CRISPR 是這幾年非常熱門的基因編輯技術,簡單來說,這項技術運用了一套特殊的蛋白質加上核酸標記,能夠準確的切下一小段 DNA 序列,然後嵌入人工設計的 DNA;在這裡,我們需要改寫的就是 TCR 的基因。
人體的細胞會把自己內部製造、或是外來入侵的蛋白質用酵素切碎成片段,接著把這些碎片搬運到細胞表面,放置在一種叫做「第一型主要組織相容性複合物」(Major Histocompatibility Complex class I;簡稱 MHC-I)的分子的頂端。T 細胞會用 TCR 去判讀 MHC-I,如果發現某個細胞表面出現異常的碎片,便會判斷這個細胞已經被病毒、細菌感染或發生病變,馬上出手清除。
TCR-T 療法便是用人工去改寫 T 細胞裡的 TCR 基因,使轉譯出來的 TCR 蛋白質分子結構發生變化,讓 T 細胞變得能夠認出癌細胞碎片,消滅掉腫瘤細胞。
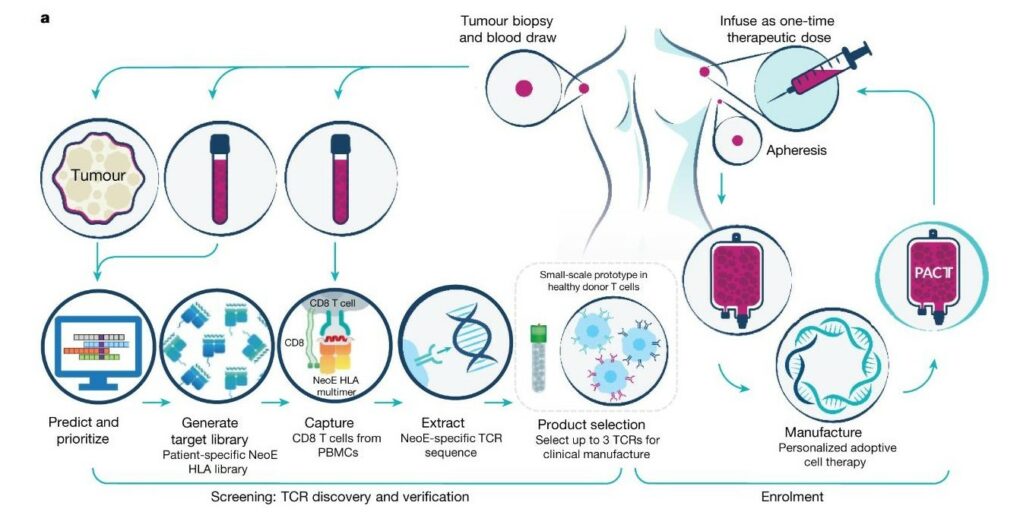
製造 TCR-T 和進行治療的過程相當繁複,可拆解成 8 個步驟:
- 從患者身上抽血,並切下一小部分腫瘤組織,利用 DNA 定序,比對人體細胞和癌細胞的 DNA,找出腫瘤細胞的突變。
- 建一個 DNA 資料庫收錄這些腫瘤細胞突變,接著設計演算法,來預測哪些突變產生的蛋白質碎片最可能「挑釁」到 T 細胞,激起免疫反應。
- 從患者的血液樣本裡篩選 T 細胞,目標是找出 T 細胞帶有、能對這些蛋白質碎片產生反應的 TCR。
- 截錄這些 TCR 的基因片段,加以微調、複製。
- 用 CRISPR-Cas9 來改造沒有攻擊癌細胞能力的 T 細胞,插進新的 TCR 基因片段。
- 把這批改造後的 T 細胞放進培養槽,分裂繁殖成更大的數量,接著冷凍儲存。
這時製備作業就已經完成,相當於養了一批腫瘤特種部隊,專門去獵殺癌細胞,接下來就是治療患者的階段了。 - 先讓患者接受化療,減少體內免疫細胞的數量。
- 把改造過的 T 細胞解凍注射進患者體內,觀察破壞腫瘤的療效,同時也要留意 T 細胞可能引發的副作用。
而 TCR-T 有可能導致的副作用有:「細胞激素症候群」或「神經毒性症候群」,例如受試病人中就有人因為細胞激素上升而發燒,也有 1 人發生腦炎,走路和寫字都困難。
新 CAR-T 療法持續進化
若將 CAR-T 和 TCR-T 比較,可以把 CAR-T 想像成是 T 細胞直接加裝追蹤系統的外掛,提升命中機會;而 TCR-T 則像是精準育種後的 T 細胞,挑選出有效的基因,用來修飾 T 細胞,強化原本就有的火力,讓它發揮得更好。
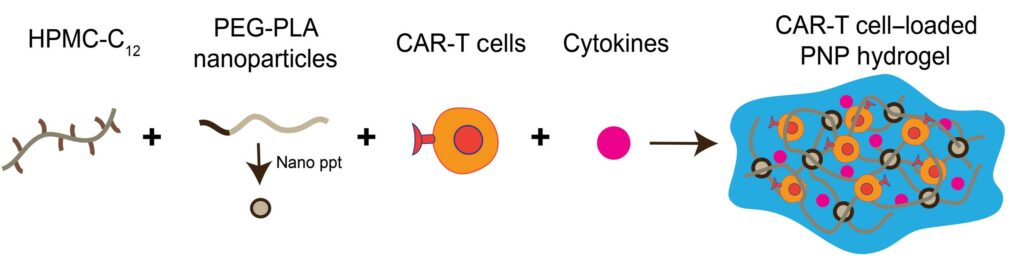
CAR-T 療法亦持續突破,不斷進化出新型態的技術。現在已經發展出一種新技術,把一批 CAR-T 細胞封裝在特製的水凝膠裡面,其內還摻著能提高細胞活性的細胞刺激因子,打進人體後會慢慢崩解融化,釋放出裡面的 CAR-T 細胞;該技術發表在 2022 年 4 月的《Science》。
CAR-T 療法原始的做法是:把 CAR-T 細胞用吊點滴的方式注射到靜脈血管裡,順著血液循環去攻擊癌細胞;但是這樣做,CAR-T 細胞可能在人體環境裡面不斷消耗掉活力,如果攻擊對象是實體腫瘤的話,很容易後繼無力,沒辦法消滅掉腫瘤。此外,實體腫瘤還有各種方法來武裝自己,例如:改變腫瘤微環境來抑制 CAR-T 細胞的活性。
有了水凝膠封裝的方式,就可以緩緩一直釋放出 CAR-T 細胞,把細胞濃度維持在一定的範圍內,並且不斷釋出刺激因子,提升細胞活性,等於和腫瘤打持久戰,一點一滴把實體腫瘤瓦解掉。
還有一種對策:讓 CAR-T 細胞自帶興奮劑。
在腫瘤微環境之中,除缺乏氧氣外,腫瘤本身還會分泌出許多化學物質,抑制了 CAR-T 細胞的活性。
解決方法就是:在 CAR-T 細胞中再插進一段基因,讓細胞表面多長出另一種蛋白質,一旦碰觸到癌細胞,就會啟動 T 細胞裡的細胞激素分泌機制,這種細胞激素對於 T 細胞來說就如同興奮劑,能夠提升活性。
也就是說,CAR-T 一邊在奮力廝殺的時候,一邊還自己分泌能夠刺激自己興奮的物質,強化攻擊力和延長續航力,使 CAR-T 能夠破壞實體腫瘤;這項研究也於 2022 年底發表在《Science》。
隨著醫學科技進步,不論是 CAR-T 還是 TCR-T,是否能達成剷除實體腫瘤的終極目標、治好疾病,二者的發展令人期待。
歡迎訂閱 Pansci Youtube 頻道 獲取更多深入淺出的科學知識!
參考資料
- Foy, S.P., Jacoby, K., Bota, D.A. et al. Non-viral precision T cell receptor replacement for personalized cell therapy. Nature (2022). https://doi.org/10.1038/s41586-022-05531-1
- Grosskopf, A. K. et al. Delivery of CAR-T Cells in a Transient Injectable Stimulatory Hydrogel Niche Improves Treatment of Solid Tumors. Science Advances (2022), 8(14). https://doi.org/10.1126/sciadv.abn8264