本文轉載自諾貝爾化學獎專題系列,原文為《【2002諾貝爾化學獎】質譜與核磁共振》
- 譯者/蔡蘊明|台大化學系名譽教授
今年的諾貝爾化學獎是由三位學者所共享,他們的研究涵蓋了兩個重要領域:質譜與核磁共振。這三位得獎者是美國 Virginia Commonwealth 大學的 John B. Fenn,日本島津(Shimadzu)公司年僅四十三歲的研發工程師田中耕一(Koichi Tanaka)以及瑞士理工學院的 Kurt Wuthrich,前二者所專精的是質譜方面的研究,而後者是由於在核磁共振方面的研究而得獎。他們最主要的貢獻,是利用這些工具來解決巨大的生化分子之結構問題,他們的成就代表了一個革命性的突破,使得"化學生物"(chemical biology)成為現今的"大科學"(big science)。化學家們現在已經可以快而準確的鑑定一個試樣中含有的蛋白質為何物,他們也能夠繪出蛋白質分子在溶液中的三度空間圖像,也就是說,化學家已有能力"看到"蛋白質並瞭解它們在細胞中如何的作用。
生化分子的革命性分析方法
為什麼要研究生化的高分子
所有的生物體 ─ 細菌,植物及動物 ─ 都含有相同型態的大分子或高分子,而這些分子與我們所謂的生命是息息相關的。在細胞中所發生的現象是由核酸(例如DNA)來控制的,我們可稱之為細胞的"導演",而各種蛋白質則是細胞的"主角"。每一個蛋白質都具有一種功能,並可隨著環境而變化。例如血紅素將氧氣輸送到人體內的各個細胞。
個別蛋白質的研究並非一項新的研究領域,然而蛋白體學(proteomics),也就是研究不同的蛋白質如何相互的聯合以及合併與其它的物質在細胞中共同運作,卻是一個在過去數年間極速成長的新興領域。隨著一個個生物體的基因之定序完成,以及相關的尖端研究不斷向前挺進,新的問題亦隨之而產生:人類約三萬個左右的基因,其密碼是如何的對應到千百來種不同的蛋白質?如果一個基因損傷或缺少了,會發生什麼狀況?像阿茲海默症或狂牛症是如何發生的?上述的新化學領域是否可運用到更快速的診斷出以及醫治好這些威脅到人類的疾病?
要想解決類似這樣的問題,化學家不斷的追求有關蛋白質的更多知識,以及瞭解它們如何相互聯合或與其它的分子聯合而在細胞中運作,這是因為它們的結合將會影響其結構,而在蛋白質結構上一點點的變化,就會對其功能有決定性的影響,因此下一步就是要掌握其活動狀況:當蛋白質相互作用的那一瞬間,蛋白質分子是何長相?尤其是在那決定性的一刻又如何?若想要瞭解,那我們就必須擁有“目睹”的能力。
質譜 ─ 一個鑑定分子的方法
質譜現在能讓我們利用分子的質量快速的鑑定出一個試樣中的化合物結構,這項技術早就被化學家運用在小型與中型的分子鑑定工作上,這項工具靈敏到能探察非常少量的分子。例如在吸毒以及藥物濫用的檢查,食品的控管以及環境的檢測等方面,質譜的運用在現今已是如例行公事般的尋常。
其實早在十九世紀末頁,質譜就已奠下了基礎,在 1912 年,湯木森(Joseph J. Thompson)就報告了第一例的小分子結構分析。好幾個二十世紀的諾貝爾獎工作就是直接倚賴質譜分析,例如 Harold Urey 發現氘(1934年諾貝爾獎),以及"碳足球"富勒烯(fullerenes 又稱碳六十)的發現,導致 Robert Curl、Harold Kroto 與 Richard Smalley 得到 1996 年的諾貝爾獎。
當然將質譜運用在高分子上的目標早就吸引了許多的科學家,在 1970 年代已經能成功的將高分子轉化成氣相的離子,稱為脫附技術(desorption technology),這成為過去二十年間在此領域中革命性進展之基礎。
雖然與其它的小分子比較,高分子的確很大,但實際上一個單一的高分子仍然是極為渺小的,例如血紅素的一個分子的質量只不過是10-19克左右,那麼要如何量度這麼小的質量呢?關鍵就在於如何讓蛋白質分子相互分開,並形成一片可自由飛翔,並且攜帶電荷的蛋白質離子雲霧,緊接著量度這些離子質量(因之而能鑑定蛋白質)的常用方法,就是在一個真空室中將它們加速,然後量度其飛行時間(Time Of Flight, TOF),它們達到目的地的先後與其質量以及電荷有關,越輕而且電荷越高者,越快抵達。
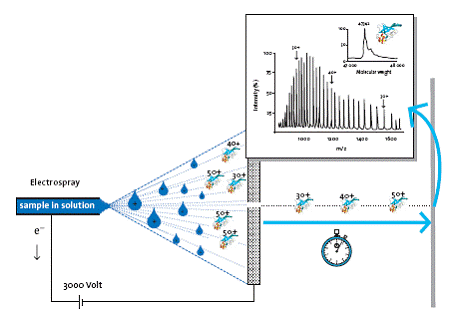
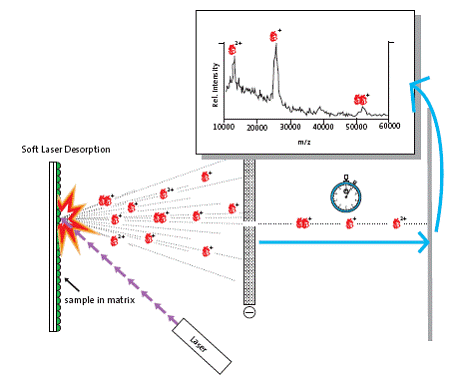
現今有兩種做法能使得蛋白質轉變為氣態離子而不會改變其結構與形體,這兩種方法背後的發明者就是今年共享一半諾貝爾獎的兩位學者。其中由 John B. Fenn 所發展的方法是運用一個很強的電場將試樣噴灑出去(稱為電灑法,見圖一),而產生一個個帶電荷並能自由飛翔的離子。另一種方式是運用一個強烈的雷射脈衝,在適當的條件下(視能量,與試樣的結構和化學環境而定)運作,試樣可接受雷射脈衝的能量而被釋放成為自由的離子(見圖二),頭一個展示這種"輕雷射脫附"(soft laser desorption)現象可運用在蛋白質這種大分子的人就是田中耕一(Koichi Tanaka)。
Fenn 的貢獻 ─ 透過噴灑的飛翔
在 1988 年 John B. Fenn 發表了兩篇後來被視為突破性的質譜論文,那是有關電灑高分子的研究。在第一篇論文中,他研究具有未知質量的聚乙二醇(polyethylene glycol)的質譜,發現可以運用他的方法處理具有高分子質量及高電荷的大分子。他的第二篇論文顯示這個方法亦可運用在中等大小的蛋白質上。離子的釋出是藉由一個電場將試樣噴灑出去,形成許多帶電荷的水滴,當水滴中的水蒸發之後就剩下了帶電而且可自由翱翔的赤裸裸蛋白質分子,這個方法被稱為電灑游離法(electrospray ionization , ESI)。
當這些分子具有很高的電荷時,質量/電荷的比值就會小到可用普通的質譜儀來分析。另一個好處就是相同的分子可能攜帶不同的電荷,因此會得到一系列的訊號,雖然這個現象使得圖譜變得複雜,甚至對早先的研究者造成困擾,但這也產生了更多的資訊,使得鑑定的工作變得較容易。
田中耕一的貢獻 ─ 透過轟擊的翱翔
在同時,於世界的另一端也正進行著另一份精采的工作,在日本東京的島津儀器公司,有一位年輕的日本工程師田中耕一,發表了另一種截然不同的技術來解決那最重要的第一步。在 1987 年的一項學術會議中(並於一年後發表論文),田中耕一展示蛋白質分子可藉由輕雷射脫附(soft laser desorption , SLD)的技術而游離。有別於電灑法,一個處於固相或粘稠的液相狀態的試樣以一束雷射脈衝撞擊,試樣接受能量之後被炸成許多小塊塊,然後分子相互分離,釋出自由翱翔的完整離子,其電荷不高,然後藉由一個電場加速,並透過其飛行時間的長短探測之。田中耕一是展示可運用雷射的技術於生化高分子上的第一人,其原理是現今許多極為有用的雷射脫附技術的基礎,特別是簡稱為 MALDI(Matrix-Assisted Laser Desorption Ionization,基質輔助雷射脫附游離),SELDI(Surface Enhanced Laser Desorption Ionization,表面強化雷射脫附游離),以及 DIOS(Direct Ionization On Silicon)等三種方法。
質譜的應用
電灑游離法(ESI)與輕雷射脫附法(SLD)可運用在許多領域。這個在現在生化分析中已經成熟的方法,在數年前還不過是個夢想。研究蛋白質之間的作用對瞭解生命體中的訊號系統是非常重要的,這些以非共價鍵結合的生化分子錯合體,可以運用 ESI 來研究,這種方法優於其它方法的原因,在於具有快速,靈敏以及能發現作用機制的多項好處。質譜分析的方法相對而言算是便宜的,這也使得此項技術迅速的擴散到世界上各各角落的實驗室中。現在輕雷射脫附法(MALDI 的形式)與電灑游離法已成為分析胜肽,蛋白質與碳水化合物的標準方法,它們可以迅速的分析出一個完整的細胞或活組織中的蛋白質成分。從下面所列現今的一些研究領域之例子,就可看出今年的諾貝爾獎工作所衍生的運用之廣泛:
- 製藥的發展:先期的藥物研發已進行了型態的改變。搭配分離的技術,ESI-MS 可以做到每天分析好幾百個化合物。
- 瘧疾:科學家最近發現了新的方法來研究瘧疾的擴散。借助輕雷射脫附法,現在已可進行早期診斷,人類血紅素上攜帶氧的部份在此處用來吸收雷射脈衝的能量。
- 卵巢癌,乳癌與攝護腺癌:過去這一年中對於各種不同的癌症之早期診斷方法,以更快的速度被發表出來。只要能取得癌細胞所附著的表面,然後以輕雷射脫附法分析,化學家能比醫生更迅速的發現癌症。
- 食物的品管:ESI 技術也在小分子的分析上有所進展。在過去這幾個月,我們發現某些製備食物的方法會產生一些有害人體健康的分子,例如可導致癌症的丙烯醯胺(acrylamide),藉著質譜,食物可以在不同的階段接受迅速的分析,藉著溫度以及材料的改變,有害物質的產生可以避免或減少。
生化高分子的核磁共振
質譜可針對譬如說蛋白質所提出的"哪一種?"與"有多少?"的問題給予答案。簡言之,核磁共振則可回答"長相如何?"。即使是最大的蛋白質在任何顯微鏡底下的解析度仍然很低,因為它仍然太小了,為了要能得到一張蛋白質真正長相的圖片,就必須用其它的方法,核磁共振(NMR,nuclear magnetic resonance)的技術就是其中之一。透過核磁共振光譜訊號的解釋,我們就可以對所研究的分子繪出一張三度空間的圖像。其巧妙之處在於試樣可以是一種溶液態,如果是蛋白質的話,那正是細胞中的自然情況。
在核磁共振發展之前,以晶體的 X 光繞射光譜來決定蛋白質分子的三度空間結構是唯一的方法,在 1957 年發表了第一個真正的蛋白質(肌紅蛋白)之三維結構,這使得 Max Perutz 因此於 1962 年得到諾貝爾化學獎。這種結晶學是基於 X 光在蛋白質晶體中的繞射現象,導致了更進一步的一些諾貝爾獎工作之發展。化學家一直在尋求另一種與 X 光結晶學互補的方法,能夠決定分子在溶液相中之結構,因為這較能模擬生化分子在自然界中存在的狀態。
物理學家 Felix Bloch 與 Edward Purcell 早在 1945 年就發現,將某些原子核置於一個強大的磁場中時,透過所謂的核轉量(nuclear spin),會吸收無線電波的頻率,這個發現導致他們得到了 1952 年的諾貝爾物理獎。在這之前幾年也已發現核磁共振的頻率不但與磁場的強度以及核種有關,同時也與這個原子週遭的化學環境有關,更進一步的,不同的核之核轉量會相互影響而在光譜中產生一些細部結構,換言之會因此在核磁共振光譜中產生更多的訊號。
早期 NMR 的運用受限於其低靈敏度:它需要非常濃的溶液,不過在 1966 年,瑞士的化學家 Richard Ernst(1991年諾貝爾化學獎)的研究顯示,若改變過去慢慢改變掃描頻率的做法,而以一個短而強的無線電波脈衝施於樣品,則可以大幅提昇其靈敏度。他的貢獻也包括了在 1970 年代所發展的方法,能決定在一個分子中每一個核的相鄰關係,因此透過 NMR 光譜的判讀就可以推導出該分子的長相,也就是它的結構。這種方法對於相當小的分子是很成功的,然而對於大的分子就很難分辨不同的核之訊號,這種分子的光譜就好像一塊草皮一般(每一根草代表一根訊號),含有上千根的訊號,造成無法區辨哪一個訊號是屬於哪一個核的。最後解決了這個問題的科學家就是瑞士的化學家 Kurt Wuthrich。
Kurt Wuthrich ─ 顯示NMR可運用在蛋白質上
在 1980 年代初期,Kurt Wuthrich 發展了一個如何將 NMR 運用到像蛋白質這樣的生化分子的想法,他發明了一種系統化的方法將訊號與正確的氫核配對,此法稱為循序指認法(sequential assignment),堪稱為現今所有 NMR 結構分析的基石。他又展示接著如何找出許多對氫核之間的距離,然後運用一個基於距離與幾何結構的數學方法,搭配以上的資訊,計算出該分子的三維結構。
在 1985 年 Wuthrich 的方法第一次成功的解出了一個蛋白質的完整三維結構,到目前為止,在所有上千已知的蛋白質結構中約有 15-20% 是透過 NMR 決定的,其它的則主要是利用 X 光結晶學而定的,加上少數幾個是運用電子繞射或中子繞射的方法。
NMR運用於生化分子的領域
在許多方面,NMR 與 X 光結晶學的方法在結構的決定上是互補的,如果一個蛋白質用這兩種方法都分析一遍,前者在溶液中後者則是晶體的形式,通常會得到一致的結果,例外常是發生在一些表面較易受到環境影響的區域 ─ 在晶體中緊密堆積的蛋白質分子相互的影響,在溶液中包圍著分子的溶劑分子的影響。雖然 X 光結晶學的方法強在能非常準確的決定非常大的三維結構,NMR 的方法也有其獨到之處,因為它可以決定在溶液中的結構,代表我們可以模擬真正的生理條件。它最強的地方在於顯示出分子中沒有結構性或動態最高的區域,它可探知其游動性與活動狀況,以及瞭解在蛋白質的鏈上這些運作如何變化。利用同位素的標籤,亦有助我們對結構的鑑定。
一個利用 NMR 決定蛋白質結構的例子是有關一種稱為 prion 的蛋白質,這個蛋白質攸關好幾種危險的疾病,例如狂牛症(1997年 Stanley Prusiner 所得的諾貝爾醫學獎)的發生。Wuthrich 與其工作夥伴運用 NMR 的技術顯示一個正常的 prion 蛋白質具有兩個部份:此一蛋白質約有一半在水溶液中具有一個整齊而且相當堅固的三維結構,而另一半則不具結構性而且游動性很高。
NMR 亦可以運用在其它的生化高分子的結構與動力研究上,例如 DNA 或 RNA。
NMR 也運用在製藥工業中,解決一些蛋白質以及其它可能可以作為新藥目標的高分子的結構,以及瞭解進一步的性質問題。藥物分子的設計就是要能與蛋白質結合 ─ 就像鑰匙與鎖的關係。NMR 或許在工業上面最重要的運用就是在尋找具有潛力,能與特定生化高分子作用的藥物分子,如果一個小分子與一個大的分子結合時,那個大分子的 NMR 光譜通常會有所改變,因而此法可用在發展新藥時,迅速的在早期篩選大量的可能候選者。
結語
在過去這五年,我們看到了在生命科學領域中所出現的"全像"概念,例如基因體學,蛋白質體學以及代謝體學的興起,這種思維主要的觀念是採取一種整體而大規模的研究策略,而非如早期的研究般,採取簡化策略,以解決問題為出發點。現在我們已經可以描述一個生命體中的整個基因體,同樣的,現在也已經可以開始考慮,在一個活的細胞中某一階段所參與的整組蛋白質的運作,只不過尚未能達到定量的階段。這個概念也同樣的運用在整個代謝物流上。這些新的可能性,有一部份是源自於新方法的發展,其中質譜與 NMR 在生物高分子上的運用應為重要的例子。不過隨伴著以企業化方式大幅度的繪製生命體中分子性質的圖譜之時,我們仍有更殷切的需求,深入的瞭解在分子的層次,生化過程是如何發生的。在這個由基本的生化科學所構成的世界裡,質譜及 NMR 在生物高分子上的運用,已成為增進對生命的瞭解之過程中,重要的基石。
參考資料
蔡蘊明譯自諾貝爾化獎委員會公佈給大眾的新聞稿:
http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2002/popular.html
若需要進一步的資訊,請至以下網頁點選:
http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2002/advanced-chemistryprize2002.pdf














-200x200.jpg)