文/駱宛琳
不久前,號稱東方諾貝爾獎的唐獎 (Tang Prize)在生技醫藥領域,頒給致力於癌症免疫治療的詹姆斯•艾利森(James Allison)博士和本庶佑(Tasuku Honjo)博士。而最新一期的《自然》期刊,更是一連刊了五篇癌症免疫治療相關研究的最新突破[1-5]。2014年即將進入尾聲,而在癌症治療上,則發布了個振奮人心的好消息!
什麼是癌症免疫療法(Cancer Immunotherapy)呢?簡單來說,就是利用病人本身的免疫反應機制來對抗癌細胞。我們的免疫細胞除了抵抗外來病毒、病原菌,平時也到處巡邏確保身體內我們自己的細胞沒有病變成不正常的細胞。而這種「檢查哨」的角色,必須經過嚴密調控,以防止免疫細胞不會錯亂並攻擊正常細胞,造成正常組織損傷或誘發自體免疫疾病。對免疫細胞來說,腫瘤內的「微環境」通常都不太利於活化免疫細胞,使得腫瘤內部常處在偏向免疫抑制的狀態。癌症免疫療法就是希望能透過各種已知使免疫細胞反應更活躍的方法,重新活化免疫細胞,讓免疫細胞能成功辨識並殺死腫瘤細胞[6, 7]。
類似癌症免疫療法的構想可以追溯到1910年代由William Coley醫師所提出來的假說[6, 8]。Coley醫師認為手術後的癌症患者,如果併發細菌感染,可以降低癌症復發的機率。Coley醫師在病患腫瘤內注入高溫殺死的細菌,希望藉由激發病患的自體免疫反應來控制腫瘤,注射後,部分病患身上可觀察到腫瘤逐漸消失了[6, 8]。如今,科學家對於免疫反應機制有更深層的瞭解,也發展出許多促進或活化免疫系統,以對抗癌症細胞的治療策略。其中一種眾所矚目的治療方法,就是艾利森博士及本庶佑博士所研究的「免疫檢查點療法」(checkpoint blockade)[6, 7]。
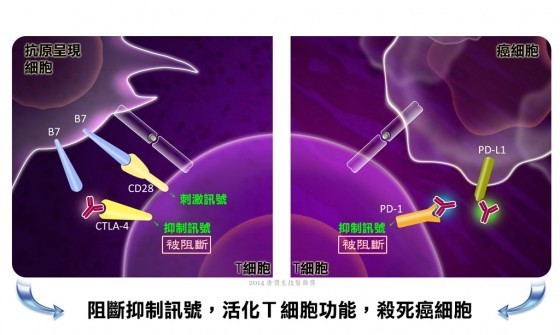
癌症細胞能夠誘使免疫細胞啟動「抑制免疫反應」的訊息傳導,而免疫檢查點療法是透過阻斷這些「抑制免疫反應」的訊息傳導,使免疫細胞即使在腫瘤內部(不利免疫細胞發揮功能的環境)也能夠被活化,完成消滅腫瘤細胞的任務。主要的治療靶點,是CTLA-4和PD-1這兩個表現在T細胞表面的免疫抑制受體[6, 7]。當CTLA-4和PD-1與各自的配體結合時,抑制T細胞免疫反應的訊息傳導會被啟動,於是T細胞的功能與活動力會因此降低。以PD-1受體來說,很多腫瘤細胞會表現其配體PD-L1,當PD-L1和PD-1結合後,表現PD-1的T細胞會因此死亡。目前阻斷PD-1或CTLA-4功能的抗體已由美國FDA核准為治療癌症的試驗用新藥。在臨床治療上,許多使用後的病患也能穩定控制病情。但是,免疫檢查點療法並非期待免疫系統將癌細胞趕盡殺絕,科學家也沒有誇下海口說這樣的治療策略能夠完全「治癒癌症」。或許對於治療癌症而言,我們也許並不是需要真正的「治癒」,而是透過免疫系統的監控,讓癌細胞對正常生理與病患日常生活的影響力降到最低,變成能和平共處的慢性病。
另外,免疫檢查點療法目前僅發現在特定的癌症與部分病人上有顯著的療效,約有半數的腎臟癌、肺癌,和黑色素細胞癌之病例,證實使用該方法能夠延長病患的生命。但在最新一期的《自然》期刊上所發表的五篇相關論文,除應用免疫檢查點療法於不同癌症上,也找出部分病人在接受治療後有良好反應的主要原因。
Antoni Ribas博士的研究團隊發現,對免疫檢查點療法有明顯反應的病患,在治療前,腫瘤周圍會聚集較多的CD8+ T細胞(一種可以直接殺死目標細胞的T細胞), 而且PD-1與PD-L1 的表現較高[3]。以直觀來說,腫瘤內PD-L1表現特別高的病人,理當會對阻斷PD-1訊息傳導途徑的抗體治療反應較明顯。但是,Ribas的研究團隊認為,關鍵不僅是腫瘤內癌細胞PD-L1的表現量,在治療前腫瘤邊緣所聚集的CD8+ T細胞數量,與這些細胞所表現的PD-1與PD-L1也相當重要。於是Ribas研究團隊的發現,可提供另一種方式評估臨床上病患是否適合接受免疫檢查點療法。
而分別由Nicholas Vogelzang與Stephen Hodi所主導的兩個團隊,發現透過抗體阻斷PD-L1(目前所用的抗體為阻斷PD-1)的功能,能應用於多種不同癌症,而且目前臨床實驗中觀察到的副作用也較低於原本的免疫檢查點療法 [1, 2]。另一方面,Robert Schreiber與Lelia Delamarre的研究團隊則分析癌細胞所表達的癌細胞抗原[4, 5],發現癌細胞所表現的特殊抗原,不一定來自與腫瘤疾病進程有關的基因。
這些關於癌症免疫治療最新研究,不僅為癌症病患捎來了好消息,也在癌症醫療上建立了新的里程碑。
參考資料:
- Powles, T. et al. MPDL3280A (anti-PD-L1) treatment leads to clinical activity in metastatic bladder cancer. Nature (2014) 515, 558–562.
- Herbst, R. S. et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients. Nature (2014) 515, 563–567.
- Tumeh, P. C. et al. PD-1 blockade induces responses by inhibiting adaptive immune resistance. Nature (2014) 515, 568–571.
- Yadav, M. et al. Predicting immunogenic tumour mutations by combining mass spectrometry and exome sequencing. Nature (2014) 515, 572–576.
- Gubin, M. M. et al. Checkpoint blockade cancer immunotherapy targets tumour-specific mutant antigens. Nature (2014) 515, 577–581
- Coley, W. The Treatment of Inoperable Sarcoma by Bacterial Toxins (the Mixed Toxins of the Streptococcus erysipelas and the Bacillus prodigiosus). Proc R Soc Med. (1910); 3(Surg Sect): 1–48.
- Wolchok, J. et al. Cancer: Antitumour immunity gets a boost. Nature (2014) 515, 496–498
- Leslie, M. Multiple boosts for cancer immunotherapy. Science (2014) Latest News.