德國 CureVac 藥廠於 6月 16日發佈新聞稿,宣布其研發的 COVID-19 疫苗(CVnCoV)失敗:在三期試驗中期分析的保護力僅 47%,低於世界衛生組織(WHO, World Health Organization)的 50% 低標。最終分析出來的保護力也僅有48%。
為什麼同為 mRNA 疫苗,輝瑞 (BNT) 與莫德納 (Moderna) 能大獲成功、CureVac 卻令人大失所望呢?

mRNA 疫苗有什麼特別?
在 COVID-19 之前,疫苗只能用整顆病毒,或病毒蛋白質製成 [1],而 mRNA 疫苗是一種極特殊、極有突破性的概念,它有著前輩欠缺的優勢:
研發過程迅速、靈活
mRNA 的製程不用養細胞等繁瑣的步驟,只要知道病毒的基因序列,就能著手研發。去年(2020)1月,新冠病毒 (SARS-CoV-2) 的基因上傳 25 天後,莫德納就已做出首批 mRNA 疫苗。速度與靈活度都遠勝於傳統疫苗。
模仿自然感染,同時活化體液、細胞免疫
各類疫苗技術中,mRNA 疫苗非常接近自然感染。它能讓細胞表面和體液中產生病毒蛋白,同時活化抗體和T細胞。相較於其他疫苗技術如蛋白質、死病毒疫苗,mRNA 疫苗理論上能更全面性地誘發免疫力 [2]。
同時 mRNA 疫苗尚有「無須佐劑」、「難以人工培養病原之疾病也能克服」等優勢,這些都是傳統技術難以觸及的境界。
以下是 mRNA 疫苗注射後,發揮作用的步驟 [1][3][4]:
- 注射 mRNA 疫苗於肌肉,局部組織出現發炎反應
- mRNA疫苗的成分進到身體後,會依不同的細胞有不同反應:
- 肌肉、纖維細胞吸收內含 mRNA 的脂質奈米顆粒(LNPs, lipid nanoparticles)
- 單核球(monocytes,巨噬細胞大姐姐活化之前)、樹突細胞趕赴現場,吸收脂質奈米顆粒
- 部分脂質奈米顆粒循環至淋巴結,被其中的細胞捕獲、吸收
- 脂質奈米顆粒被細胞吞噬後,內含的mRNA逃脫並進入細胞質。
- 細胞將外來mRNA誤認為自己人,轉譯出棘蛋白。這些棘蛋白浮現於細胞膜表面且分泌到體液中。
- T細胞等淋巴球被棘蛋白活化,進而啟動整個免疫系統。
話說回來,輝瑞和莫德納的mRNA疫苗,都以超過九成的高保護力震驚世界。那麼同為 mRNA 疫苗的 CureVac 失敗得如此徹底,到底發生了什麼事?
CureVac 失敗可能原因:未修飾的鹼基?
CureVac 的新聞稿,將失敗歸咎於變異株。然而有些研究者並不認同此一聲稱,因為另兩款mRNA疫苗,對付變異株表現相當優秀。輝瑞疫苗對抗 α 變異株(B.1.1.7,俗稱英國變異株)有 92% 效力,對抗 δ 變異株(B.1.617.2,俗稱印度變異株),則有 83% 的保護力 [5, 6]。
因此部分科學家認為問題出在疫苗本身。
賓州大學的德魯・魏斯曼(Drew Weissman)就認為,CureVac 的 RNA 鹼基未做任何修飾,因此細胞能認出疫苗中的 mRNA 為外來物,從而引起發炎等免疫反應,讓 mRNA 被快速分解,進而削弱了 CureVac 的效果 [5, 6]。
上世紀末,科學家就發現細胞會辨認外來的 mRNA、快速地分解它,進而導致任何mRNA 療法都無法持久,因此研究了許多方法試圖克服。最常見的策略有以下兩種:
策略1:替換某些RNA 鹼基
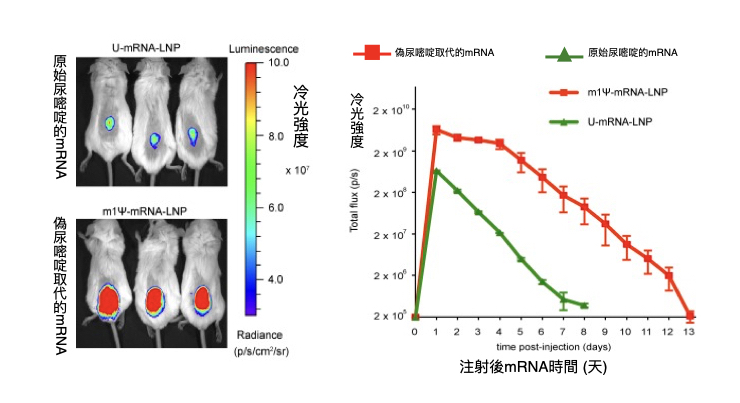
德魯・魏斯曼和卡林柯(Katalin Karikó)的策略偏重在「欺騙」。他們模仿細胞內原生的 RNA(如tRNA)特徵,於 2005 年,研發出替換 RNA 鹼基的技術。將尿嘧啶,換成偽尿嘧啶(m1Ψ, N1-methylpseudouridine),有機會欺騙細胞、讓它誤以為此 mRNA 是自己體內的成分,以減少人體排斥 mRNA 疫苗 [7]。
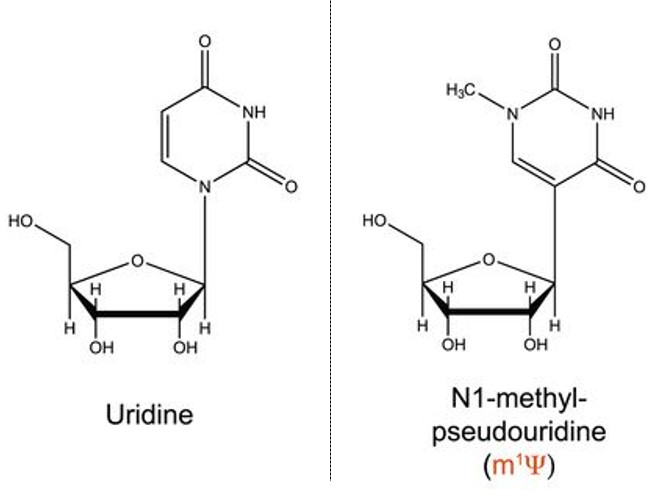
如下圖,動物實驗也證實,將 mRNA 的 U 換成 m1Ψ,能大幅地減緩 mRNA 的分解速率,提高疫苗的成功率。
此技術被輝瑞、Moderna採用,很可能也是其疫苗成功的關鍵。
策略2:各種方法優化mRNA鹼基序列
而 CureVac 的策略偏重在「優化」,尋找各式各樣可延長 mRNA 壽命、提高轉錄效率的手段,如:「優化非翻譯區」和「優化鹼基序列」 [3, 8, 9]。
「優化非翻譯區」是指在 mRNA 中「不會被轉譯成蛋白質的區塊」(如:5’ UTR),引入能增強轉譯效益的序列。而「優化鹼基序列」是指在「不改變轉譯後胺基酸」序列的前題下,調整 AGUC 鹼基的比例(如:減少 U 比例、增加 GC 比例) [8-10]。
CureVac 累積了非常多不同物種、不同蛋白質的 mRNA 資料,在設計疫苗時,希望藉此客制化地調整 mRNA、設計出較不易被細胞辨認、分解的 mRNA。
由一期試驗結果,推測失敗的可能原因
那麼 CureVac 失敗的可能原因是什麼呢?有人認為「未修飾的 mRNA」引起發炎、分解疫苗;也有人認為是「劑量不足」 [5, 6]。
我認為這兩個論點都正確,很可能互為因果。可能是疫苗成分「被判定為外來物」,導致 mRNA 分解過快、疫苗失敗。同時當疫苗成分被判定為外來物,也會引起嚴重發炎反應、無法再提高劑量而導致「劑量不足」,在此情況下,產生的保護力難以和另兩支 mRNA 疫苗比肩。
mRNA疫苗設計策略簡單比較[2]
| 各項比較\疫苗 | 輝瑞 | 莫德納 | CureVac |
|---|---|---|---|
| 對抗分解策略 | 替換尿嘧啶為偽尿嘧啶 | 替換尿嘧啶為偽尿嘧啶 | 優化非翻譯區和鹼基序列 |
| 劑量 (μg) | 30 | 100 | 12 |
| 保護力(%) | 94 | 94 | 47 |
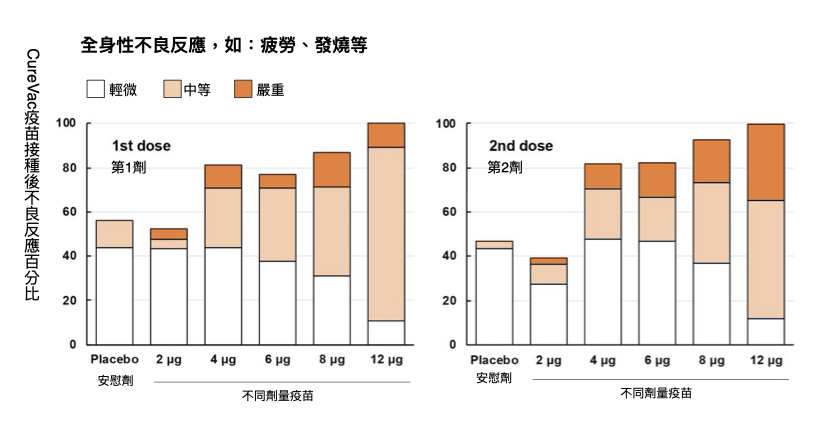
下圖為該疫苗一期試驗中,受試者不良反應結果 [11]。圖中可發現,最高劑量、也是三期試驗採用的 12μg 組別,出現全身性不良反應,如:發燒、疲勞、頭痛⋯⋯的比例有 100%,也就是「所有人都感到不舒服」。而「中等」和「嚴重」的比例也很高,超過九成的受試者感到「超過輕微程度的不舒服」。
從 CureVac 一期試驗可判斷,12μg 產生的不適感,應該頗為驚人。此結果也間接支持德魯・魏斯曼教授的觀點 :CureVac 的 RNA 鹼基未做任何修飾,因此細胞認出 mRNA 為外來物、引起發炎、快速分解。
CureVac失敗替免疫橋接研究打上問號
我國食品藥物管理署在 6 月 10 日公布了國產 COVID-19 疫苗的緊急使用授權標準,將以「抗體中和病毒效價」做為評估國產疫苗的療效。換言之,食藥署傾向認定「抗體中和病毒效=疫苗保護效力」 [12]。
但 CureVac 的失敗,恐怕替食藥署敲了一記警鐘。

而一篇有關免疫橋接研究的重要研究,5月發表在《Nature Medicine》,研究團隊也假設「抗體中和病毒效價=疫苗保護效力」。他們使用七種疫苗的中和抗體效價、三期試驗保護力進行計算,獲得兩者之間關係的模型,該模型的預測能力,在後來的某些疫苗有得到某種程度的驗證。
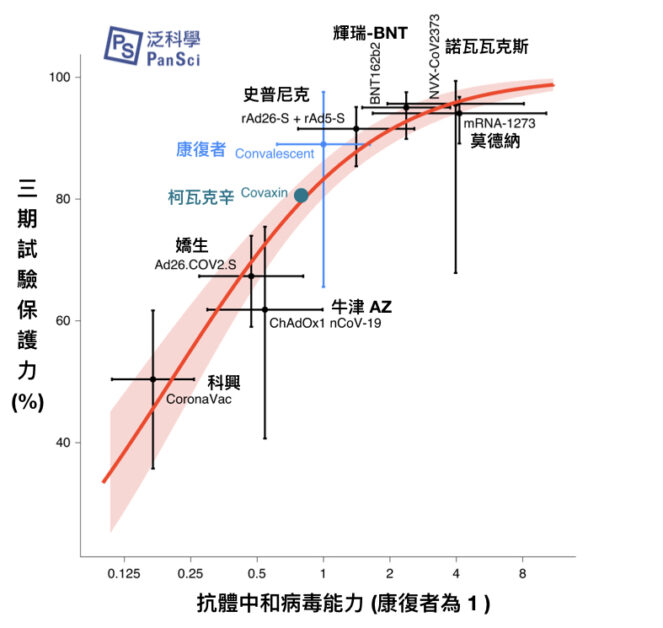
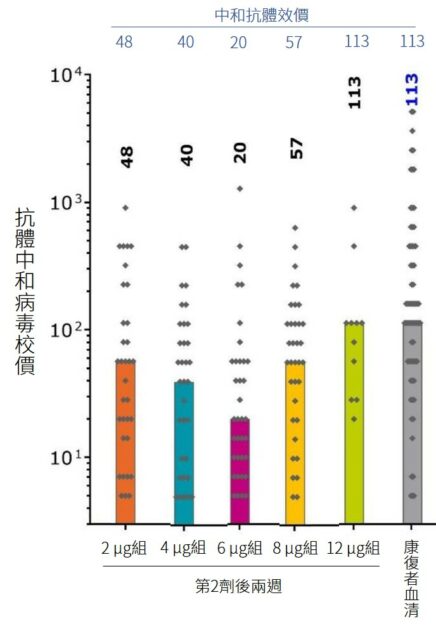
但是,CureVac在此則成為了反例。CureVac 一期的抗體中和病毒效價,和康復者血清相等、比值為1[11]。由前述的研究推估,則 CureVac 三期試驗的保護力應會超越 AZ 牛津疫苗;不幸的是在三期臨床試驗目前已有的結果揭露,實際上 CureVac 的保護力僅有 47%。
CureVac 的挫敗,不只影響 mRNA 疫苗,其他科學領域對於免疫橋接,也有待更深入的研究。
對台灣而言,更重要的啟示是:「抗體中和病毒效價」也許不能代表「疫苗保護效力」。後續如免疫橋接研究是否可持續作為判斷 EUA之基準等議題,將需要更多基於科學的公開討論與研究。
保持冷靜,繼續前進。Keep Calm and Carry On.
參考文獻
- 蔣維倫 (2021) 拯救世界的 mRNA 疫苗—疫苗科學的里程碑(四)。泛科學
- 張金堅,許辰陽等 (2020) 新冠肺炎 (COVID-19) 的免疫學探討。臺灣醫界
- Rein Verbeke, Ine Lentacker, Stefaan C. De Smedt and Heleen Dewitte (2021) The dawn of mRNA vaccines: The COVID-19 case. Journal of Control Release. DOI: 10.1016/j.jconrel.2021.03.043
- About mRNA-1273, Moderna’s Potential Vaccine Against COVID-19. Youtube Channel of Moderna. 2020/03/21
- Jon Cohen (2021) What went wrong with CureVac’s highly anticipated new mRNA vaccine for COVID-19? Science. DOI: 10.1126/science.abk0458
- Elie Dolgin (2021) CureVac COVID vaccine let-down spotlights mRNA design challenges. Nature. DOI: https://doi.org/10.1038/d41586-021-01661-0
- 科學月刊 (2021) 終結疫情、治癒癌症,從魯蛇到英雄! 拯救世界的 mRNA 療法和它的母親。泛科學
- Karl-Josef Kallen, Regina Heidenreich, Margit Schnee. et. al. (2013) A novel, disruptive vaccination technology. Human Vaccines & Immunotherapeutics. DOI: 10.4161/hv.25181
- CureVac官網
- Rauch S., Lutz J., Kowalczyk A., Schlake T., Heidenreich R. (2017) RNActive® Technology: Generation and Testing of Stable and Immunogenic mRNA Vaccines. In: Kramps T., Elbers K. (eds) RNA Vaccines. Methods in Molecular Biology, vol 1499. Humana Press, New York, NY. https://doi.org/10.1007/978-1-4939-6481-9_5
- Peter Kremsner, Philipp Mann. et. al. (2020) Phase 1 Assessment of the Safety and Immunogenicity of an mRNA- Lipid Nanoparticle Vaccine Candidate Against SARS-CoV-2 in Human Volunteers. medRxiv. DOI: https://doi.org/10.1101/2020.11.09.20228551
- 蔣維倫 (2021) 「抗體中和效價」是什麼?看懂高端疫苗二期試驗的眉角。泛科學