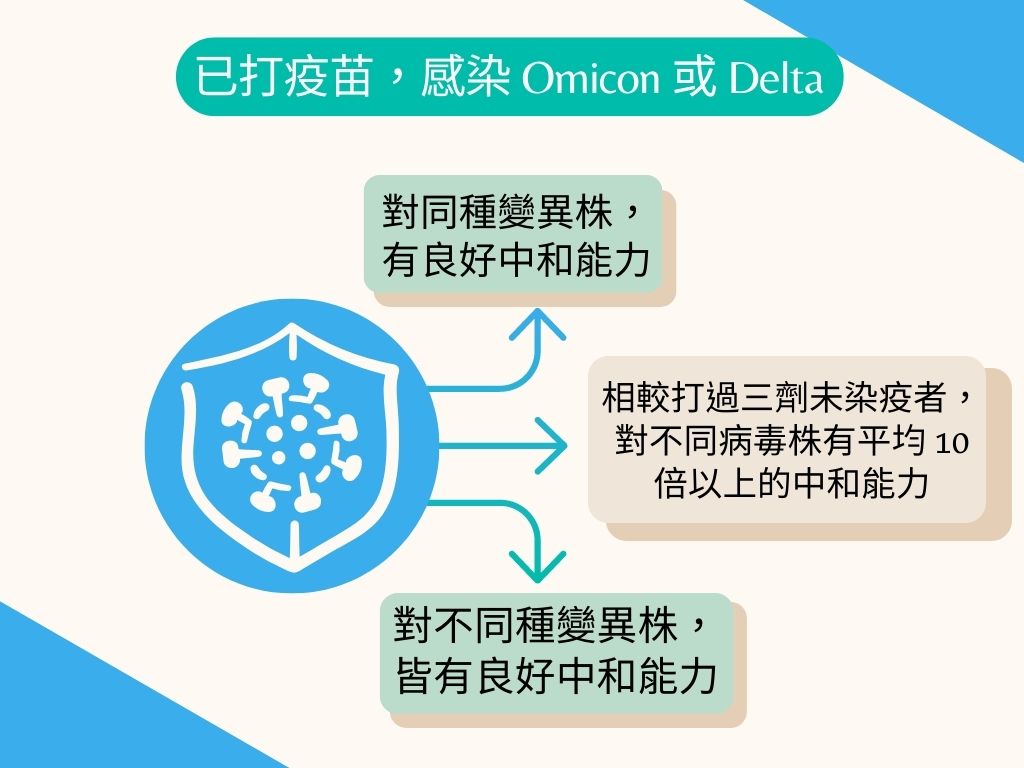
哪個抗體更有效?抗體中和病毒實驗
在科學上,不能直接把人丟進充滿病毒的環境感染看看,那要怎麼知道打了疫苗有產生免疫力?
多數疫苗在二期臨床試驗階段,會用各種方法評估「抗體」辨認病毒的能力好壞 [註1]。而食藥署公布的EUA標準中,提到的「中和抗體效價」就是其中一種評估方法。
「中和抗體效價」的評估重點,在於比較中和抗體(neutralizing antibody)的能力,此抗體能辨認出特定病毒、與之結合而阻止病毒侵入細胞的抗體。就冠狀病毒而言,棘蛋白(spike protein)是結合細胞、開啟感染的鑰匙,有效之中和性抗體應能結合棘蛋白的特殊部位「細胞受體結合區域」(receptor binding domain, RBD),進而阻止病毒侵入細胞 [1]。
「中和抗體效價」實驗操作概述
因為「中和抗體效價」實驗目前尚無一定的標準,以下以AZ牛津疫苗的實驗,作為說明。實驗步驟如下:
- 將受試者血清在 56°C 環境下熱處理 30 分鐘,以去除血清內補體(complement)等,避免抗體活化補體導致非實驗目地的細胞死亡。(感謝網友 張文瑋 指正)
- 階梯式稀釋血清,也就是在此階段會獲得多個不同濃度的血清。
- 在不同稀釋倍數的血清裡,混入固定濃度的冠狀病毒(此處為起源於中國武漢的原始株)。並將混合液加入 Vero E6 細胞中;對照組為染疫康復者的血清,依相同方式處理、稀釋。
- 持續養細胞,數天後,觀察細胞。以細胞死亡狀態評估抗體中和病毒的能力。[2]
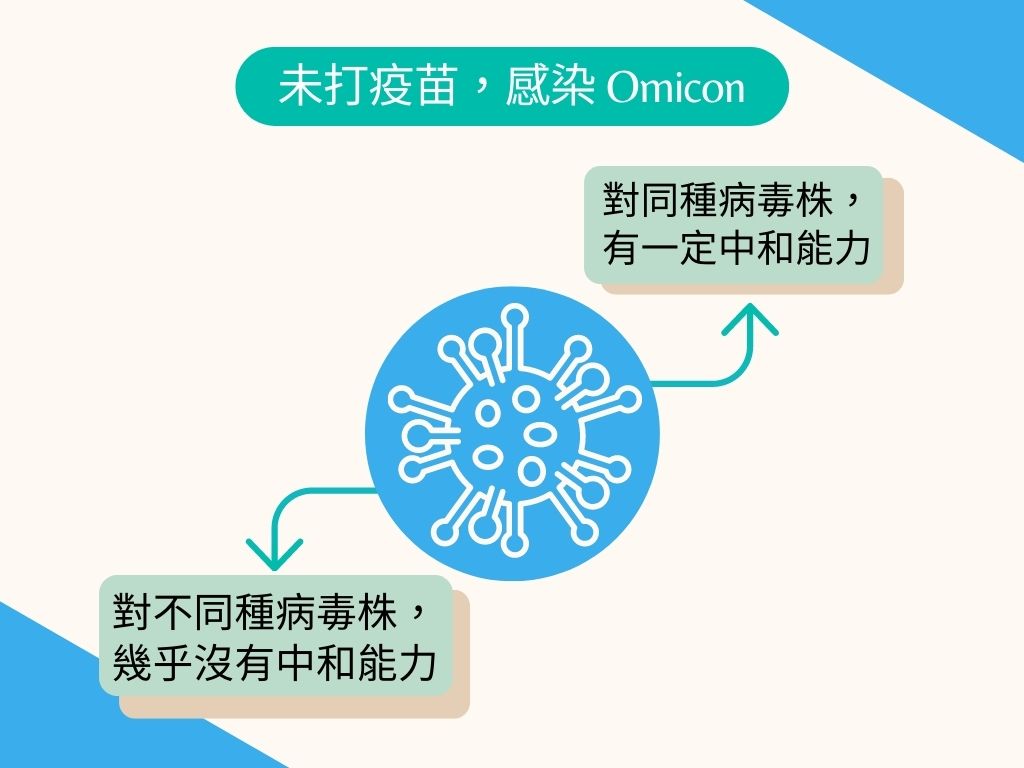
若疫苗能有效誘發免疫力、在人體內產生高量的中和性抗體。那麼接種者的血清,即使被稀釋到極稀的濃度下,內含的抗體依舊能辨認、中和病毒,進而減少細胞死亡,因此最後的實驗結果,有效的稀釋倍率越高,則代表抗體中和力越強。
「中和抗體效價」實驗解讀概述
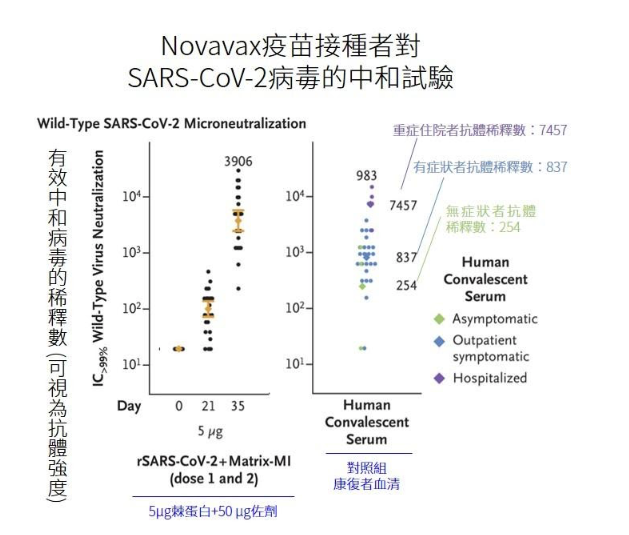
我們以諾瓦瓦克斯(Novavax)疫苗在一/二期結果,做為說明,介紹數據判讀 [3]。
如圖1,可觀察到以 IC>99%,即中和了 99% 病毒為標準,疫苗組的平均中和效價為 3,906;即疫苗組的血清最稀的狀態是稀釋 3,906 倍,可以中和 99% 的病毒。而對照組,平均的中和效價分別是無症狀者:254;有症狀門診患者:837;住院症者:7,457。
換言之,透過接種諾瓦瓦克斯疫苗,人體無須染病即可獲得抗體,而此處中和抗體強度介於有症狀者和重症者之間。
不同研究中和抗體數據可以互相比較嗎?有什麼問題?
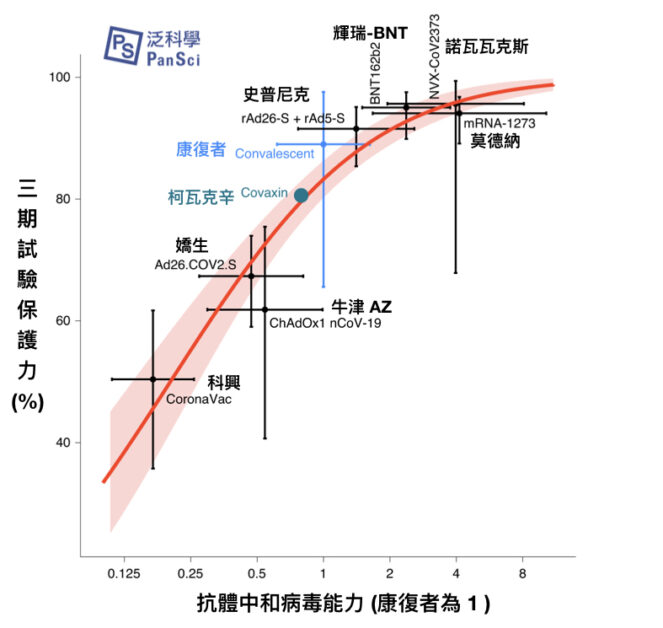
《自然醫學》(Nature Medicine)於五月刊出的研究中,利用各家疫苗的中和抗體數據,建構出預測保護力的模型。
儘管該模型開啟了用中和抗體數據、預測疫苗真實保護力的可能性。然而,在文章的最末,該團隊也再次提醒,該研究裡參考的中和抗體實驗,其步驟細節都不同,因此「標準化」中和抗體實驗是重要的 [4]。
因為雖然都叫「抗體中和病毒試驗」,但各實驗室操作細節皆不同,有可能會讓不同的數據之間無法比較。以下簡列三項:
1.病毒株的選擇
不同的變異株,對細胞的結合、感染力不同。
儘管多數疫苗的中和試驗,其病毒皆採用最原始的版本。但疫情之下病毒演化至今,已有許多棘蛋白已突變的變異株,因此各個變異株對抗體的反應也不同。
所以未來,若要比較不同疫苗的中和試驗數據,必須要定義「病毒株」的標準 [註2]。
2.「病毒被中和」的定義與評估法
理論上,實驗要觀測「抗體中和病毒上的特定蛋白質、阻止病毒侵入細胞」。但病毒、抗體非常小,不可能直接用肉眼看見病毒被抗體黏住,因此如前面的細胞培養等都是間接評估法。而各個實驗室的評估方法,也會有差異;多數實驗室都是培養細胞 3~4 日後,計算細胞死亡後產生的斑點,算出病毒殺死細胞的效果。
而輝瑞-BNT疫苗的評估,則合成了帶螢光基因的冠狀病毒,直接量測細胞發光的亮度,即可回算出病毒侵入細胞的程度(有錢就是任性啊)[4]。以理論而言,輝瑞-BNT疫苗更接近「抗體中和病毒」試驗的原始概念。可見目前各實驗室對觀測方法和終點,並未一致。
所以未來,若要比較不同疫苗的中和試驗數據,必須要定義「中和病毒」的標準。
3.對照組康復者血清的標準化
多數抗體中和病毒試驗,都以康復者血清為對照組。從圖1可以發現,不同嚴重程度的患者,體內抗體強度也大不相同。然而,各實驗室招募的康復者,其疾病的嚴重程度,很難一致。以Novavax為例,他們同時抽取了無症狀感染者、輕症,及重症者的血清為對照組 [3];而輝瑞疫苗的康復者血清,罹病程度是中等程度 [5]。各家疫苗在此處採取的對照組,並未一致。
所以未來,若要比較不同疫苗的中和試驗數據,就必須要標準化「康復者血清」。
由於各國疫情與各種政治情勢,許多後起的 COVID-19 疫苗三期臨床試驗,已越來越難展開。採用免疫橋接研究如「抗體中和病毒實驗」,以評估 COVID-19 疫苗保護力的做法,一定會越來越多,但該如何標準化獲得科學上可靠的成果,尚需科學家繼續努力。
保持冷靜,繼續前進。Keep Calm and Carry On.
- 註1:評估疫苗產生免疫力的實驗相當多樣。以抗體而言,可分析和抗原結合的能力、阻止病毒(可能經人為改造後)侵入細胞的能力。以T細胞而言,可分析接種疫苗後,血液的T細胞,用抗原刺激後活化的增加比例等。
- 註2:國產高端疫苗的二期試驗解盲後,台大醫師批評試驗未使用α變異株(B.1.1.7,英國)。但我認為,國內的審查標準必須統一,且盡可能和歐美疫苗一致、先以原始株為標準。若食藥署覺得有必要,可要求藥廠新增對變異株之研究,做為審查附件。
無論如何,原始病毒株之中和數據有其必要性,因為目前世界衛生組織緊急許可的疫苗,都至少擁有原始株的中和數據。
補充說明:國產疫苗的二期試驗成果專有名詞介紹與基本解析
台灣眾所矚目的國產高端疫苗在 6月10日 解盲二期試驗的結果,高端發佈的新聞稿除了說明安全性,還提及了「中和抗體效價」數據。本文的最後,帶大家來初步解析裡頭的名詞和數據。
- 專有名詞一:安全性
新聞稿敘述:「安全性與耐受性良好,所有受試者未出現疫苗相關嚴重不良反應」,顯示高端疫苗的安全性有基本保障。
而頭痛、疲倦、發燒等不良反應,似乎也較AZ牛津、莫德納疫苗輕微、更接近另一款蛋白質疫苗,諾瓦瓦克斯日前發布的結果,展現其優勢 [註]。
表:AZ牛津、莫德納、高端疫苗和諾瓦瓦克斯疫苗之不良反應比較
| 不良反應比例 | AZ牛津 | 莫德納 | 高端疫苗 | Novavax |
| 注射處痛 | 54.2 % | 92.0 % | 71.2 % | 51.2 % |
| 疲倦 | 53.1 % | 70.0 % | 36.0 % | 40.3 % |
| 頭痛 | 52.6 % | 64.7 % | 22.2 % | 40 % |
| 肌肉痛 | 44 % | 61.5 % | 27.6 % | 40.3 % |
| 發燒 | 7.9 % | 15.5 % | 0.7 % | 4.8 % |
- 專有名詞二:有效性
新聞稿敘述,高端疫苗血清陽轉率(seroconversion rate)為99.8 %,代表幾乎施打的所有人,都能產生可中和原始株病毒的抗體。
在高興之餘,我們也必須知道,世界衛生組織(WHO, World Health Organization)緊急許可的6支疫苗,2期試驗的血清陽轉率也都很高,如:Moderna 100%、嬌生97%、科興 94%。換言之,高度血清陽轉率證明二期試驗成功,但並不代表能預測疫苗的三期試驗保護力。
- 專有名詞三:中和抗體
中和抗體(neutralizing antibody)的能力,此抗體能辨認出特定病毒、與之結合而阻止病毒侵入細胞的抗體。就冠狀病毒而言,棘蛋白(spike protein)是結合細胞、開啟感染的鑰匙。
高端疫苗的中和抗體幾何平均效價(GMT titer)為 662,GMT倍率比值為 163倍。是指受試者血清,最大稀釋數、662 倍時,還能中和、阻止原始株病毒感染細胞;而此抗體因疫苗,在人體內增加的幅度為 163 倍。但新聞稿並未釋出實驗方法,也未提及是否有對照組(染疫康復者血清),因此該數字無法做為「好」或「不好」或「比XX牌疫苗好/差」的評論。
- 專有名詞四:免疫橋接研究
要評估疫苗的保護力,除了進行三期試驗,科學家也有討論要對疫苗引起的免疫反應進行驗證,也就是免疫橋接研究(immuno bridging study)。而「抗體中和病毒研究」會是其中一個可能的選項。
食藥署發布的國產疫苗緊急使用授權(emergency use authorization,以下簡稱 EUA)評估標準裡,也有提及免疫橋接研究。因為隨機安慰劑的三期臨床試驗,已越來越難展開,所以COVID-19疫苗的免疫橋接研究,一定會越來越多,如:法國Valneva藥廠也在四月展開免疫橋接的三期臨床試驗,對照組也是AZ牛津疫苗。[6]
我們祝福國產疫苗能通過台灣的EUA,同時也向台灣食藥署許願,能夠更加透明、開放,釋出更多和EUA相關的資料和實驗數據、相信人民吧。
高端疫苗的二期試驗數據而言,是令人充滿喜悅的。因為COVID-19已無法根除,因此未來每人、每年可能都須接種疫苗。而在疫苗稀缺的現實下,台灣具備自製COVID-19疫苗的工業,是維護國人健康的重要政策。
保持冷靜,繼續前進。Keep Calm and Carry On.
註:高端疫苗之新聞稿,未顯示不良反應嚴重程度的比例,故尚無法直接給予「接種高端疫苗,一定比XX牌疫苗安全」的推論。
參考文獻
- 中央研究院Facebook粉絲專頁2021/06/12 22:20貼文
- Pedro M Folegatti, Katie J Ewer. et. al. (2020) Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. The Lancet. https://doi.org/10.1016/S0140-6736(20)31604-4 見Supplementary appendix之第32頁,Marburg SARS-CoV-2 Virus neutralization段落
- Cheryl Keech, Gary Albert. et. al. (2020) Phase 1–2 Trial of a SARS-CoV-2 Recombinant Spike Protein Nanoparticle Vaccine. New England Journal of Medicine. DOI: 10.1056/NEJMoa2026920
- David S. Khoury et al. (2021) Neutralizing antibody levels are highly predictive of immune protection from symptomatic SARS-CoV-2 infection. Nature Medicine. DOI: https://doi.org/10.1038/s41591-021-01377-8
- Edward E. Walsh, Robert W. Frenck. et. al. (2020) Safety and Immunogenicity of Two RNA-Based Covid-19 Vaccine Candidates. New England Journal of Medicine. DOI: 10.1056/NEJMoa2027906
- 蔣維倫 (2021) 落後的COVID-19疫苗難進行三期臨床試驗,該怎麼辦?科技報導