科學終會勝利。Science will win.
冠狀病毒帶來的瘟疫是威脅,也是契機。疫苗科學的第五個里程碑,是一場正在進行式的世紀大瘟疫。疫情的突然襲來,讓某位女科學家的研究,一夜之間成了拯救人類的英雄。
1995 年,卡林柯 (Katalin Karikó) 教授跌落人生至黯時刻。降職、確診癌症,丈夫更因簽證滯留海外、相隔千里。25 年後,爆發了新冠肺炎瘟疫,她鑽研了數十年的 mRNA 疫苗橫空出世,實驗室直接跨入人間、拯救世界,成了扭轉疫情的英雄。
疫苗史最近的一次轉捩點,就是新冠病毒疾病/COVID-19 的核酸類型 (mRNA, DNA) 疫苗。在瘟疫爆發不到一年的時間裡,核酸疫苗快速研發、試驗、上市,前所未有的光速,堪稱科學上的奇蹟。其中又由以 mRNA 疫苗的身世最為曲折離奇、充滿轉折。
mRNA 療法的初現與墜落
上世紀的六、七十年代,「DNA→mRNA→蛋白質」的邏輯逐漸清晰後,人類開始嘗試將 DNA 或 mRNA 塞進細胞,讓人體做出目標蛋白質,冀望藉此治療疾病,如:缺乏正常蛋白質等罕見疾病(例:B 型血友病)。
1990 年,科學家將全裸、無保護的 mRNA 注入小鼠肌肉,發現此外來 mRNA 被細胞轉譯 (translation) 為蛋白質 [1],這個成果激發了無限的想像。1993 年,人類首次將流感病毒蛋白 mRNA 注入動物體內,誘發出能辨認該蛋白的 T 細胞,打響了 mRNA 疫苗的第一槍 [2, 3]。
但科學家發現,mRNA 療法理論上可行,但在真實世界卻遭遇巨大障礙-人體非常討厭外來物。不是只有科學家想劫持人體細胞,更有許多邪惡的生物想綁架細胞,如:流感病毒等,也會將自己的病毒 RNA 塞進細胞,遙控細胞做自己不喜歡做的事。
因此人體有許多防禦系統,會摧毀外來的 RNA。除了組織間有酵素會分解 mRNA,而細胞的類鐸受體 (Toll-like receptors/TLRs) 系統,能偵測可疑的 RNA、停止它們轉譯成蛋白質,更糟的是會誘發劇烈發炎反應 [4, 5]。牢不可破的防禦系統,讓所有的科學家都放棄 mRNA 療法。除了一位來自匈牙利的女科學家。

卡林柯帶領團隊突破 mRNA 技術瓶頸
1990 年,來到美國五年的卡塔林‧卡林柯 (Katalin Karikó),向任職的賓州大學提交 mRNA 療法的研究計畫。儘管深信 mRNA 的潛力,但它過於脆弱、引致發炎的特性,讓她的計畫一再地被管理層否決。在缺乏突破的情況下,1995 年,她被大學降職、確診癌症,丈夫又因簽證滯留歐洲,接連不斷的挫折打擊著她和 mRNA 療法的未來。
即使是沉重的人生低潮,卡林柯未因此放棄 mRNA(幸好如此)。數年後,她遇到志同道合的科學家-德魯·魏斯曼 (Drew Weissman),兩人持續地鑽研一個難題:外來的核酸 (DNA, RNA) 會引起免疫反應,但奇怪的是,細胞自己也有 RNA,為什麼不會引起發炎反應呢?
2005 年,研究團隊分離細胞內的 tRNA、mRNA、rRNA 等,分別測試它們誘發免疫反應的能力,結果發現 tRNA,幾乎不會活化免疫細胞 [4]。而過往的研究已發現,DNA 裡的核苷酸,是否被修飾,是決定引起發炎反應的關鍵,如:DNA 的 CpG 序列裡,較少的甲基化修飾,會觸發細胞的發炎反應。
團隊進一步分析發現,tRNA 裡的核苷酸,高達 25% 的核苷酸被修飾。也因此說明了一種可能,細胞透過檢視 RNA 裡修飾的型式、比例,藉此判斷是否為自己的 RNA [4]。換言之,外來的 mRNA 只要有足量和正確的核苷酸修飾,就能欺騙細胞,對細胞為所欲為!三年後,團隊將帶有核苷酸修飾的人工螢光蛋白 mRNA,注入小鼠靜脈。結果發現,小鼠體內有高量螢光蛋白、穩定存在的人工 mRNA,更重要的是,有效地降低了動物的發炎反應 [6]。
動物實驗支持了卡林柯等人的假設,透過修飾核苷酸,能讓人工 mRNA 穩定、安全地存在於動物體內,並能劫持細胞、讓它生產出人類想要的蛋白質。從此,訓練白血球辨認腫瘤蛋白質、病毒,進而治癒癌症、對抗瘟疫的夢想,有了更安全的道路。
。他於2019年3月接受mRNA腫瘤療法,數週內,腫瘤以肉眼有感的速度萎縮,展現了極大的醫療潛力。.jpg)
COVID-19 出現前,超前部屬棘蛋白抗原
經過 2002 年 SARS、2012 年 MERS 肆虐後,人類有感在未來,新興傳染病必將越漸頻繁。因此科學家針對冠狀病毒之生活史、蛋白質等細節進行了研究,並發現若想以疫苗對抗冠狀病毒,棘蛋白將是最好的抗原。因為棘蛋白分佈在病毒表面,是抗體最佳的辨認目標;同時棘蛋白辨認細胞表面受器、是侵入細胞的關鍵鑰匙,若能用疫苗誘發高效抗體,使其中和病毒、阻止棘蛋白和受器結合,將能達到避免感染、預防惡化的疫苗目的。
沒想到不過數年之後,科學家的超前佈署居然派上了用場。2019 年底,新型冠狀病毒 (SARS-CoV-2) 從中國爆發、開始橫掃全世界,全人類亟需快速、有效的疫苗來終止瘟疫。
2020 年 1 月初,中國首次分享新型冠狀病毒 (SARS-CoV-2) 的全基因密碼,Moderna、Biontech 等藥廠開始設計和量產。透過以前累積的研究成果,藥廠團隊選定棘蛋白的為疫苗抗原,並依當年研究的建議優化棘蛋白,讓 mRNA 產出的棘蛋白,較天然的棘蛋白更穩定,能更有效地誘發免疫力。
mRNA 劫持細胞產生抗原,活化體內免疫系統
藥廠藉由卡林柯等人的技術,用修飾後的核苷酸製備成 mRNA 等技術,提升 mRNA 的穩定性,並將其包裹在奈米脂質顆粒裡。當疫苗被注射進人體後,樹突細胞 (dendritic cell) 等抗原呈現細胞 (antigen-presenting cell) 會吞噬奈米脂質顆粒。
隨著奈米脂質顆粒崩解、mRNA 釋出。mRNA 便劫持細胞,讓細胞開始產生病毒的棘蛋白。充滿細胞表面和體液的病毒蛋白,使 T 細胞活化,進而開啟整個免疫系統、刺激 B 細胞製造能辨認棘蛋白的抗體,並培養出有長期保護力的記憶型 B、T 細胞(memory B, T cell)。
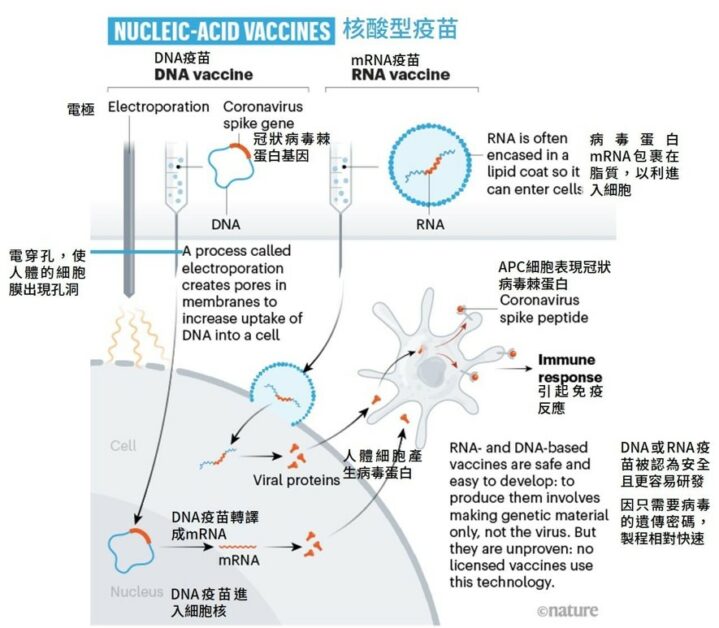
為什麼 mRNA 疫苗快速又有效?
- 和整顆病毒類型疫苗比較:mRNA 疫苗僅截取單一蛋白質的密碼,因為不含其他病毒訊息,對接種者的安全性極高。
- 和蛋白質類型疫苗比較:mRNA 疫苗無須在藥廠生產病毒蛋白質,省去了蛋白質的純化、定量製程,同時 mRNA 疫苗更接近自然感染(細胞產生病毒蛋白)的形態。
- 和腺病毒載體疫苗比較:mRNA 疫苗無須大量生產腺病毒載體,省去了病毒純化、定量等製程。且腺病毒疫苗之牛津、嬌生疫苗,推測會引發罕見血栓併血小板低下之副作用。而 mRNA 疫苗目前未觀測到此副作用,相對安全。
而 mRNA疫苗更強大的優勢是速度——只需完整的遺傳密碼,就能製造出疫苗。在新型冠狀病毒 (SARS-CoV-2) 密碼釋出後,莫德納 (Moderna) 僅花了 25 天就製備出疫苗;而面對變異株的威脅,輝瑞表示僅需六週,藥廠就能打造出針對變異病毒的新疫苗。mRNA 疫苗的光速製程,在瞬息萬變的新興瘟疫裡站穩巨大的優勢。
卡林柯撐過了人生的低潮,堅持著她對科學的信仰。數十年後,人類仰賴著她當年的突破,不到一年的時間內就製備出超高保護力,且幾乎全年齡、全族群都適用的 mRNA 疫苗。
在 mRNA 疫苗戰勝瘟疫後,相信更多科學家會站在卡林柯教授的肩膀上,開發出對抗癌症、自體免疫疾病等惡疾的 mRNA 療法。人類還不知道 mRNA 疫苗的極限在那裡,但我們何其幸運,站在疫苗史上關鍵的時間點上,見證科學卓越的里程碑。
延伸閱讀
系列文章
參考資料
- JA Wolff, RW Malone, P Williams, W Chong, G Acsadi, A Jani, PL Felgner (1990) Direct gene transfer into mouse muscle in vivo. Science. DOI: 10.1126/science.1690918
- How COVID unlocked the power of RNA vaccines. Nature. 2021/01/12.
- Frédéric Martinon Sivadasan Krishnan Gerlinde Lenzen Rémy Magné Elisabeth Gomard Jean‐Gérard Guillet Jean‐Paul Lévy Pierre Meulien (1993) Induction of virus‐specific cytotoxic T lymphocytes in vivo by liposome‐entrapped mRNA. European Journal of Immunology.
- Katalin Karikó, Michael Buckstein, Houping Ni, Drew Weissman (2005) Suppression of RNA Recognition by Toll-like Receptors: The Impact of Nucleoside Modification and the Evolutionary Origin of RNA. Immunity.
- Ugur Sahin, Katalin Karikó & Özlem Türeci (2014) mRNA-based therapeutics — developing a new class of drugs. Nature Reviews Drug Discovery.
- Katalin Karikó, Hiromi Muramatsu, Frank A Welsh, János Ludwig, Hiroki Kato, Shizuo Akira, Drew Weissman (2008) Incorporation of Pseudouridine Into mRNA Yields Superior Nonimmunogenic Vector With Increased Translational Capacity and Biological Stability. Molecular Therapy.