一把有設計功能的瑞士刀
2014 年春天,我兒子安德魯正在念六年級,他的科學老師請我到他們班上向學生解釋 CRISPR。我對這份邀約深感榮幸,但是也相當緊張:
我要怎樣將基因編輯說給一群對 DNA 僅有基本認識的孩子聽呢?
當我向全班同學解釋,就 CRISPR 的核心功能來看,可以把它想成是一把兼具設計功能的分子剪刀,具有一段二十個字母的特定 DNA 序列,以及能夠切割雙螺旋兩股的能力。然而,科學家使用這種技術來進行基因編輯的結果,可是非常多樣的。基於這個原因,也許將 CRISPR 描述成一把瑞士刀會比剪刀更為貼切。

CRISPR 最簡單也最廣泛的一項應用,是切割一段特定基因,然後讓細胞以重新把 DNA 鏈連接的方式來修復損傷。這過程很容易出錯,會留下明顯的痕跡,在 CRISPR 切割位點的附近會發生一小段的 DNA 插入或缺失 (indel)。儘管科學家無法確切控制這種 CRISPR 應用中的 DNA 修復方式,但是他們明白這類基因編輯相當有用。
利用CRISPR進行同源重組
科學家需要一種能夠鎖定目標、編輯和修正單個 DNA 字母錯誤的方法。幸運的是,細胞有一種修復機制:同源重組 (homology-directed repair),這種修復方式不會隨意連接任兩條毫不相關的 DNA 片段,而是專門連接序列相似的片段,比僅僅將破碎的 DNA 重新黏合在一起更為精確,掌控度也較高。
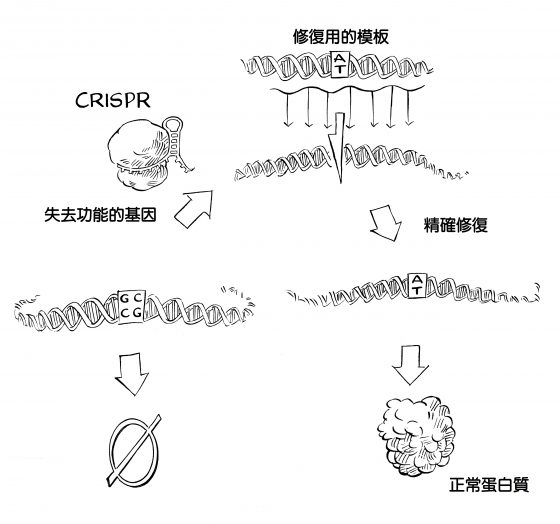
同源重組好比是攝影師以三張有部分重疊的照片,拼成一張全景照片的過程。為了要正確對齊,必須把中間照片的兩側區域,和兩邊照片的左側與右側區域正確疊好。若是全景照片的中間部分遭到切除或損壞,攝影師可以加洗一張中間照片,再依照相同的對應原則來重建全景。若是現實生活中的景觀發生變化,比方說,蓋了一座新的塔樓,或是有棵大樹倒了,攝影師也可以用相同的原則插入新照片,不斷更新這張全景圖。

事實證明,細胞中的酵素就是在進行類似的剪貼操作,只是這裡的全景圖是 DNA。之前談過的那種容易出錯的修復方式是發生在染色體斷開來的情況,這時細胞會隨便把末端連接起來,就像是攝影師在拼湊少了一小塊的全景圖那樣。但是當細胞面對的是一條斷掉的染色體,以及一段與染色體斷開後兩處末端相對應的 DNA,這時細胞會選擇比較好的修復方式,這段 DNA 相當於是修復用的模版,就好比是攝影師加洗的那張照片,細胞會讓兩末端序列完美重疊,將這段 DNA 黏貼到染色體的斷裂處。
這意味著研究人員可以使用 CRISPR 鎖定基因上發生有害突變的位置或附近區段,然後用一段新的健康 DNA 序列來取代,一勞永逸解決問題。只要研究人員利用 CRISPR,加上與斷裂基因區相對應的修復模版,細胞會很樂意抓住替換備品,用來修補損害。
刪除或翻轉一段DNA
研究人員除了用容易出錯的(非同源)或精確的(同源)修復方式來微調基因,也使用 CRISPR 來截掉一大段 DNA(缺失),或把一段 DNA 倒轉過來(倒位),讓他們能夠改變基因體中的一大塊區域。這種方法利用的是細胞的另一項特性,即細胞總是竭盡所能來維持染色體的完整性。將 Cas9 與兩種不同的嚮導 RNA 混合,研究人員可以設計 CRISPR 來切割一個染色體上兩個相鄰的基因;而細胞會用三種方式的其中之一,重新組裝染色體,繼續存活下去。
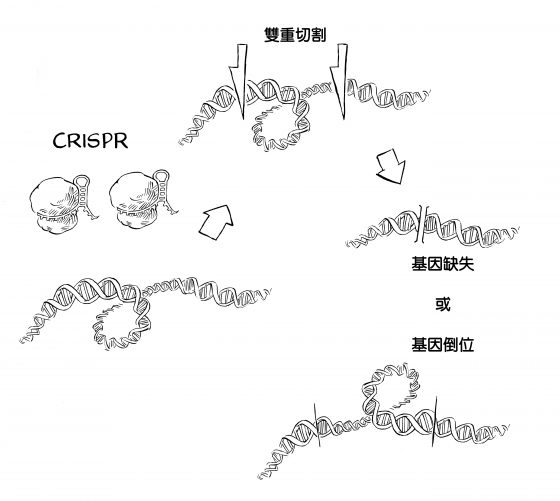
細胞這時要處理的斷裂 DNA 末端變成兩倍,第一個選項是全速進行末端連接修復,處理受損的末端,同時把所有斷裂處都黏合回去。然而,由於細胞中的分子會不斷任意運動,因此採行這種修復模式的機率非常低。要是兩個切點之間的 DNA 片段漂走了,細胞便會採用第二種選項,乾脆不理會遭切除的片段,直接把最兩頭的末端黏合起來。這種修復模式就跟昔日電影剪輯師從電影膠卷中刪除畫面的方式類似,他們直接在膠卷上剪兩刀(畫面的開頭和結束),扔掉不要的片段,再將新的兩端黏合起來。
第三種修復選項牽涉到把中間的 DNA 片段倒轉過來。在這種情況下,切割出來的 DNA 片段仍擠在附近,大致維持在原處,只是翻轉過來,原本的頭尾位置對調。促進末端連接修復的同一種酵素,只顧著把失落的片段重新接回去,不管那段 DNA 的方向到底對不對。
變成基因表現控制器
CRISPR 還有另一種應用方式,與基因編輯無關。這時,科學家利用的不是 CRISPR 切割 DNA 的能力,而是刻意破壞這項工具的性能。他們故意讓這把分子剪刀無法作用,把它變成遠端管理基因體的工具,CRISPR 不再去編輯 DNA、造成永久性的變動,而是改變 DNA 的解讀、轉譯和表現方式來達成目的。正如傀儡師以看不見的線來控制傀儡的動作和姿態,這種非切割型的 CRISPR 讓科學家能夠操縱細胞的行為及其產出。

對於這種操縱功能的基礎認識,實際上,早在我的實驗室進行 CRISPR-Cas9 的研究時便開始了。伊內克首次確認 Cas9 的生化功能時,明確展現出這個酵素中的哪些胺基酸能夠發揮化學作用,切割 DNA 雙螺旋的兩股。他以遺傳工程改變這些胺基酸後,創造出一種完全喪失切割 DNA 能力的 Cas9,但仍然可以與嚮導 RNA 交互作用,與相對應的 DNA 緊密結合。儘管催化的核心遭到破壞,去活化的 Cas9 仍然保留部分功能,可以在基因體中搜尋特定 DNA 序列並定位,只是不再能切割 DNA。
離我們實驗室不遠,從柏克萊畢業的齊磊 (Stanley Qi)博士,正在加州大學舊金山分校籌備自己的實驗室。他與同在舊金山分校的魏斯曼 (Jonathan Weissman) 和林行健 (Wendell Lim) 兩位教授合作,證明去活化的 CRISPR 可用於操縱基因體。這種去活化的 CRISPR,再也不能編輯 DNA,無法引入永久的遺傳變化,卻能讓科學家做出暫時的改變,這不會改變細胞的遺傳訊息,只是影響遺傳訊息的表現方式。最特別的是,他將 CRISPR 變成一種基因表現控制器,可以打開、關閉基因,或是增強、減弱基因的表現,就像能夠調節照明強度的調光器一樣。
本文摘自《基因編輯大革命:CRISPR如何改寫基因密碼、掌控演化、影響生命的未來》,遠見天下文化出版股份有限公司,2018 年 5 月出版。