本文轉載自中央研究院研之有物,泛科學為宣傳推廣執行單位。
台灣知名科學家:翁啟惠院長 如果問民眾「臺灣有哪些知名的科學家?」翁啟惠肯定是經常出現的答案。翁啟惠是國際知名醣化學家,曾擔任兩屆中央研究院院長,任期內積極將基礎科學與生醫產業串連起來。另一方面,翁啟惠也是投身研究 50 年的資深學者與好老師,共培養超過 500 位優秀弟子;他同時也是中研院、美國國家科學院的院士,更獲得沃爾夫化學獎、威爾許化學獎、四面體化學獎等榮譽。中研院「研之有物」專訪院內基因體研究中心合聘特聘研究員翁啟惠院士,向讀者介紹他一路走來的心路歷程。
圖│研之有物(資料來源|翁啟惠) 從臺大、中研院到 MIT的化學之旅 翁啟惠學術能量依舊飽滿,他是斯克里普斯研究院(Scripps Research )與中研院合聘的研究人員,兩邊各自都有實驗室和學生,受訪當天他本人在美國加州,透過視訊與「研之有物」團隊連線。
至今已 74 歲的醣化學大師翁啟惠,他是嘉義出生的子弟,初中考上臺南一中,高中三年級本已保送清華大學化學系,不過因為想挑戰臺大醫學系而赴考,可惜生物不好,加上自己喜歡化學,便進了第二志願臺大農業化學系。大學畢業,退伍後他隨即投身於科學研究,算算日子,已經是漫長的 50 年時光。
翁啟惠原本就喜歡研究,他退伍後跟著恩師臺大化學系王光燦 教授擔任助教一年後,再跟王教授來到中研院擔任助理,當時(1972 年)正值中研院生物化學研究所草創時期。後來翁啟惠升任「助理研究員」(類似大學的講師,目前已無此職位),前後服務長達 8 年,期間於 1977 年在職獲得碩士學位,碩論主要為臺灣蛇毒蛋白的合成,是翁啟惠多年來的研究成果。
王光燦(左)帶領翁啟惠(右)進入化學的研究殿堂,圖為 1999 年王光燦的退休餐會上,翁啟惠贈與恩師紀念品。 儘管翁啟惠出國前已發表超過 30 篇論文,小有所成,他依然希望更上層樓,因此 1979 年前往美國的麻省理工學院深造,接受恩師化學系教授喬治·懷特賽茲(George M. Whitesides )的指導。翁啟惠回憶,自己後來教育學生的理念與作法,多源自懷特賽茲的啟發。具備相當基礎之下,翁啟惠花費 3 年取得有機化學博士學位,又經歷 1 年哈佛大學的博士後研究,1983 年他就成為德州農工大學(Texas A&M University)的助理教授。
冷門且困難的「醣化學」 翁啟惠擅長的領域是「酵素化學」與「醣化學」,醣化學是什麼呢?翁啟惠解釋,維繫生命的蛋白質、核酸、脂質、醣類這些物質,以醣類最為複雜。除了材料化學的應用之外,翁啟惠選擇探索醣分子在生物醫學方面的應用。
醣類的結構變化多端,而且不容易人工合成。而翁啟惠的過人之處,正是出色的醣類合成能力!後來讓他奠定宗師地位的一鍋式酵素合成法 、程式化一鍋合成法 、醣晶片 ,到最近的廣效去醣化疫苗 等研究主題,都歸功於他堅強的化學合成基礎。
我們已經知道翁啟惠是醣化學的先驅,不過其實到博士畢業前,他大部分仍著重於蛋白質的合成,直到獨當一面後,才正式投身醣類。因為在當時的學界,核酸、蛋白質才是顯學,醣化學是非常冷門的領域,即便今日也不算太熱門,更是難以想像應用於研究疾病。
因此,翁啟惠早期在美國當助理教授時,曾經無法申請到研究經費,甚至有計畫評審認為他誤入歧途,所幸他的前瞻理念於 1986 年受到美國總統年青化學家獎(Presidential Young Investigator in Chemistry)的賞識,支持他站穩腳步,1987 年升任教授,才有後來的持續突破。
使用「酵素」來合成醣類 過去醣類研究不但冷門,而且難以合成,翁啟惠為什麼有勇氣選擇如此困難的題材?他的信心來自「酵素」 ,也就是生物用來催化反應的特殊蛋白質。傳統化學手段難以合成的複雜產物,有機會利用酵素來克服。
翁啟惠提到,1970 年代分子生物學興起,新問世的基因改造潛力無窮,人造胰島素開啟生技產業的濫觴;但是 1980 年代時,化學家多半仍很少接觸基因重組技術。他算是首波使用基因重組酵素,實現醣分子的化學合成。
翁啟惠強調,很多新聞報導說他是生物醫學或生物科技專家,但其實他本質上一直是化學家,探索分子層次的操作,研究醣分子與醣蛋白的有機合成,只是醣化學研究的應用涉及生物醫學領域,介於化學和生物的交界。
做出過人成績後,翁啟惠成為各大研究機構爭邀合作的化學人才,本來預備前往加州的史丹佛大學。不過同樣在加州的斯克里普斯研究院(Scripps Research )半途冒出,院長勒納(Richer Lerner )親自邀請他過去瞧瞧。當時擅長生醫的 Scripps 想拓展至化學領域,正在招募人才,而涉足生物的化學專家翁啟惠正是合適人選。
Scripps 研究院是世界最好的研究機構之一,只收博士生,不僅有多位諾貝爾獎得主,更培育出不計其數的人才。翁啟惠回憶,他原本也對 Scripps 研究院不熟,Scripps 當時還沒有化學部門,但沒想到相談甚歡,1989 年他受邀擔任新成立的化學系講座教授,一做就做到 2006 年。現在,Scripps 研究院在化學生物領域是全美第一。
圖│翁啟惠 Scripps 研究院不僅環境怡人,學術資源也豐沛,讓翁啟惠能專注研究,而不必為經費擔憂。如今,他再度成為 Scripps 研究院的講座教授(Chair Professor),美國講座教授會有一筆來自民間的捐助基金,有充裕的學術資源可供自由運用。翁啟惠感慨地說,臺灣的學術捐款多為建造大樓等硬體,可是支持人才更重要, 這是未來臺灣值得學習的方向。
醣化學原本是乏人問津的領域,然而翁啟惠開創了醣分子的有機合成方法,讓醣化學逐漸受到重視,他也獲得一系列耀眼成就。翁啟惠 2002 年當選美國國家科學院的院士,接著又榮獲多項化學領域的一級大獎:2014 年得到沃爾夫獎(The Wolf Prize),2021 年是威爾許獎(Welch Award),2022 年又獲頒四面體獎(Tetrahedron Prize)。
翁啟惠近年在化學領域不斷獲獎,也讓許多人好奇,再來會是諾貝爾化學獎嗎?
對於這個問題,翁啟惠認為可遇不可求,得獎也講究機運。不過每次獲獎,他都覺得是很好的鼓勵,激勵他繼續往前走。更重要的是,翁啟惠不是單打獨鬥,每次獎項表揚的成就,背後都是整個團隊的努力,因此這些榮譽正是對他整個團隊的肯定。
教師之夢:遍布全世界的學生 說到培養人才,這也是翁啟惠的強項,可惜過去媒體報導翁啟惠時卻很少觸及教育。談論如何作育英才的心得,翁啟惠眼睛炯炯有神,隔著太平洋都能感受到湧出螢幕的教育熱情。
翁啟惠表示他小學時就想當老師,也是一輩子的志願。看到學生有成就,就會覺得很欣慰。他至今指導過的學生與博士後超過 500 位,遍及世界各地,包含美國、日本、韓國、英國、法國、德國、比利時等國家。儘管他自嘲也不是全世界都有,像是北韓就沒有學生。
翁啟惠對教學的想法,奠基於博士班老師懷特賽茲和自己長年的實踐經驗。談到臺灣學生,他特別指出必須加強兩點訓練:獨立思考與表達能力 。
表達為什麼重要?試想,一個人花費多年辛苦取得學位,去應徵工作,卻只有幾分鐘能夠展現。善於表達,才能讓人覺得你的工作重要,呈現意圖以實現目標。而翁老師的第一課,總是在他與學生第一次碰面立刻開始:「為什麼找我當指導教授?」。給他滿意的回答,才能成為他的學生,成績並非最優先的考量。
翁啟惠(左1)對教學的想法,奠基於博士班老師懷特賽茲(右1)和自己長年的實踐經驗。談到臺灣學生,他特別指出必須加強兩點訓練:獨立思考與表達能力。 培養學生獨立思考與研究的能力 翁啟惠的指導理念是「指示不要太詳細」,讓學生自己想問題、找資料、設計實驗。他只負責給大方向、從旁協助。因為講的太過具體,反而會限制學生獨立發展的空間。
翁啟惠更精闢地剖析: 由學生獨立完成的成果,才會認為是自己的成績。否則即使成果再好,學生也可能覺得那是老師的東西,不是自己的成就。當學生獲得成功經驗,對自己有信心,此後便能更加獨立,建立正向循環。
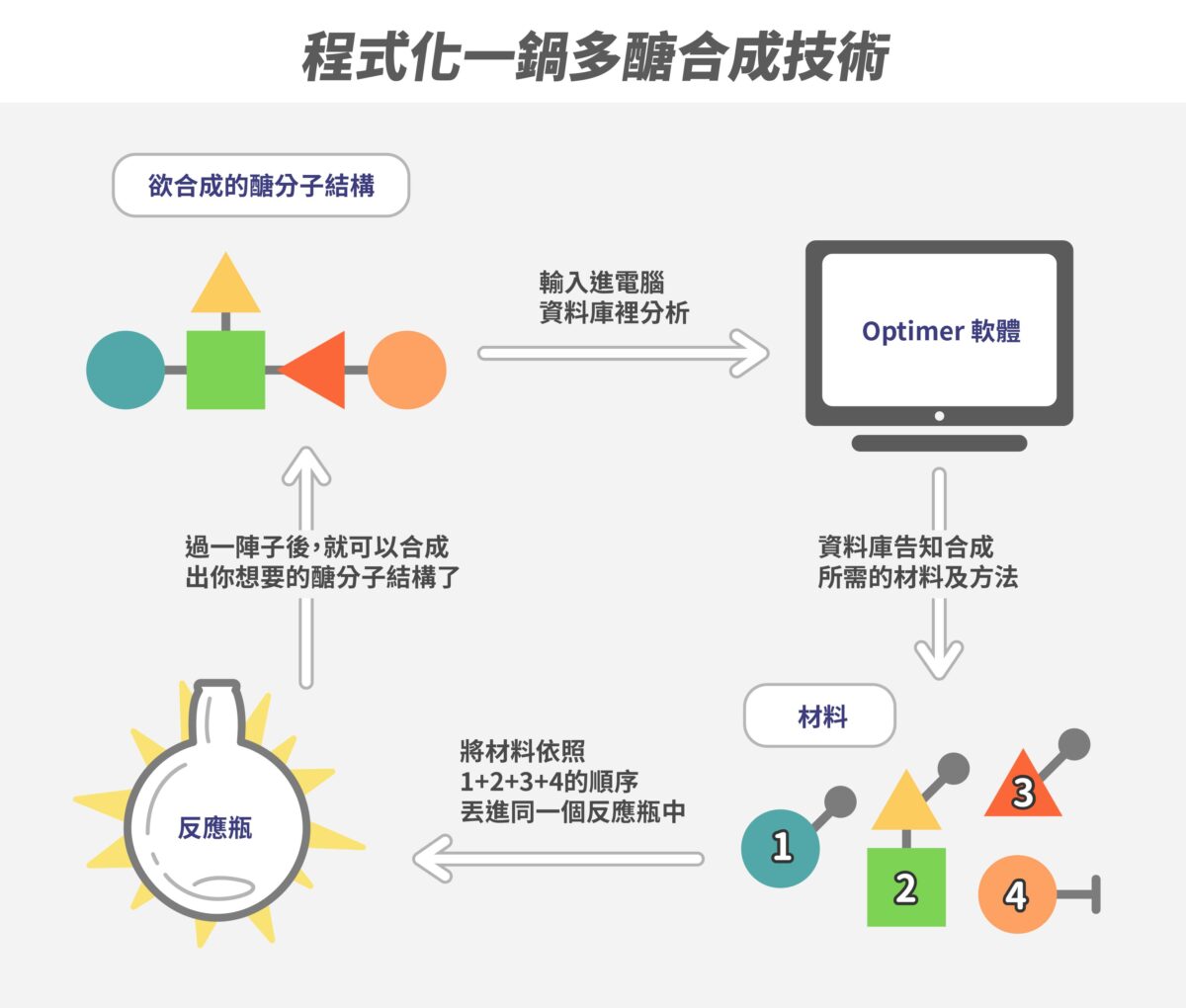
另一方面,由於學生有大片空白可以填補,所以想法和能力不會受到過去積習所影響。翁啟惠提到,他有很多超乎預期的重要研究,是來自學生自己的嘗試。例如,研發出自動化一鍋式合成醣分子的歐曼(Ian Ollmann),原本在博士班四年級仍苦無突破,翁啟惠建議他發揮寫程式的專長,果然順利完成發表,後來甚至還轉戰高科技龍頭蘋果公司,至今已工作超過 20 年。
不過,讓學生自己摸索,失敗怎麼辦?翁啟惠認為失敗為成功之基礎,學生經歷失敗,才能培養耐心,累積應付挫折的經驗,打下未來成功的基礎。做研究的關鍵在於興趣,只要保持興趣,失敗也能學到新東西,而成功則能增強信心,有利於繼續成功。翁啟惠也鼓勵學生,與其等待老師指導,不如勇於嘗試、放手去做。
程式化一鍋多醣合成技術示意圖。
研究院院長時期:積極推動產學交流與合作 翁啟惠任職 Scripps 研究院的期間,茁壯為世界第一流學者,各國爭相合作。如此耀眼的旅外人才,自然也受到當時中研院院長李遠哲賞識,促成翁啟惠於 2003 年回到臺灣,並在 2006 年到 2016 年擔任了兩屆院長。
翁啟惠除了提升中研院的學術水準,他最重要的任務莫過於推動生物科技產業。因為翁啟惠認為產學互利共生很重要,有好的產業才能吸收廣泛的人才,例如臺灣的半導體產業,可以讓理工科系學生不愁出路,產生正向循環。
但另一方面,生物科技已成為各個科技大國的明星產業,臺灣每年有大批醫藥、生技的人才,卻沒有相應規模的產業,無法人盡其才。
為了推動生技產業,法規制度與產學合作園區都不可或缺。翁啟惠參考美國 1980 年的拜杜法案(Bayh-Dole Act),與專家合作完成臺灣版本的法規,將產學合作、技術轉移制度化。
法規的主要精神,就是由政府補助學術研究,做出初步成果後,再技術轉移給業者尋求商業化,後續再回饋給學術形成正向循環。園區方面,國家生技研究園區、中研院南部院區,都隨著翁啟惠的規劃步上軌道,讓基礎研究和產業創新能夠連結。
當然,產學間的轉換並不總是那麼順利。不過翁啟惠認為,如果學者發表的論文成果,同時也能促進產業,讓社會一同受益更好。這倒不是說所有學者都要投入產學合作,而是要慢慢建立起產學合作的文化,將研發成果回饋給社會。
往好處看,臺灣的生技產業與產值都持續進步中,而這條路依然任重而道遠。
產學合作的新潛力 翁啟惠是純學術研究出身,為什麼後來卻相當熟悉產學合作呢?時光要回溯到 1985 年。那時翁啟惠獲頒席艾勒學者生物醫學獎(Searle Scholar Award in Biomedical Sciences)——這是他少數獲得的生醫獎項之一,加上總統年青化學家獎,使他在美國學術界站穩腳步,也讓他有擔任企業顧問的機會。
從杜邦公司開始,初出茅廬的翁啟惠自認什麼都不懂,跟著前輩們邊看邊學,解決一家又一家企業的疑難雜症,而業界的顧問經驗同時也支持著自己想做的研究。翁啟惠逐漸累積產業經驗後,發現產學目標很不一樣,學者要優先發表論文,企業則是產品導向,講究解決問題。
訪談之中,翁啟惠回顧幾件很有意思的顧問經驗。例如,有公司希望解決可樂中代糖「阿斯巴甜」(Aspartame)在高溫下產生甲醇毒素的問題。也有公司想要改良汽車外層鍍膜,避免鳥糞腐蝕。
另外還有一個香菸公司的邀請讓翁啟惠印象深刻,那時很多重度菸癮者抽到頭痛,產品只能先緊急下架,菸商損失慘重;後來查明是製菸的紙漿中存在微量有害物質,若短時間抽很多根菸,大量攝取下會有立即危害。
這些顧問工作,很多都和翁啟惠醣化學的本業無關,卻帶給他開闊的視野與企業經驗。我們也可以注意到,美國政府與產業界相當有心培育有潛力的人才,即便尚無業界經驗,也願意讓新人去嘗試擔任顧問。
翁啟惠提到,美國東岸的新英格蘭周邊,是產業歷史最悠久的地區,也分佈許多老牌大企業;西岸的加州則不同,主要是新創小公司。不同地方各有特色,衍生出多變的產學文化。
相比之下,臺灣也具備潛力,就看經營出什麼文化。翁啟惠認為,我們已經建立民主自由的社會,若要更上層樓,臺灣萬萬不可孤立,要主動與國際交流,並發展自己的特色。
有交流,創意的火花才有可能碰撞,或許那個坐在你隔壁的人,就是未來的合作夥伴!翁啟惠提到,總部位於加州聖地牙哥,以基因定序闖出名號,至今仍蓬勃發展的因美納(Illumina )公司,其共同創辦人沃特(David Walt ),正是他在麻省理工學院實驗室的同儕!有次邀請沃特到 Scripps 演講,剛好聽眾中有兩位感興趣的投資者,演講結束之後,沃特便與兩位投資者私下討論,就創辦了 Illumina 公司。
醣無所不在!未解的謎題還等著研究 儘管投身學術研究 50 年,醣化學將近 40 年,翁啟惠絲毫沒有停下腳步的意思。當訪問到「醣化學還有什麼潛力?」,一如談教育時的熱情,翁啟惠又展現出科學家對研究的熱愛。
在翁啟惠眼中,醣類有太多謎團等待解答。生物基因以 DNA 承載遺傳訊息,製作蛋白質行使功能,但是時常還要加上醣的參與,偏偏醣類不像核酸、蛋白質容易摸索。醣分子無法複製,只能用化學合成,細胞表面佈滿的醣分子結構不對,功能就不同。
以抗體為例,抗體是一種醣蛋白,我們知道抗體靠著專一性辨識去附著目標,消滅病毒。相對卻少有人意識到,抗體的一端附著目標後,另一端還要連接免疫細胞轉入後續反應才能消滅病毒,這步正是依靠醣分子,因此醣類會影響抗體的免疫功能 。
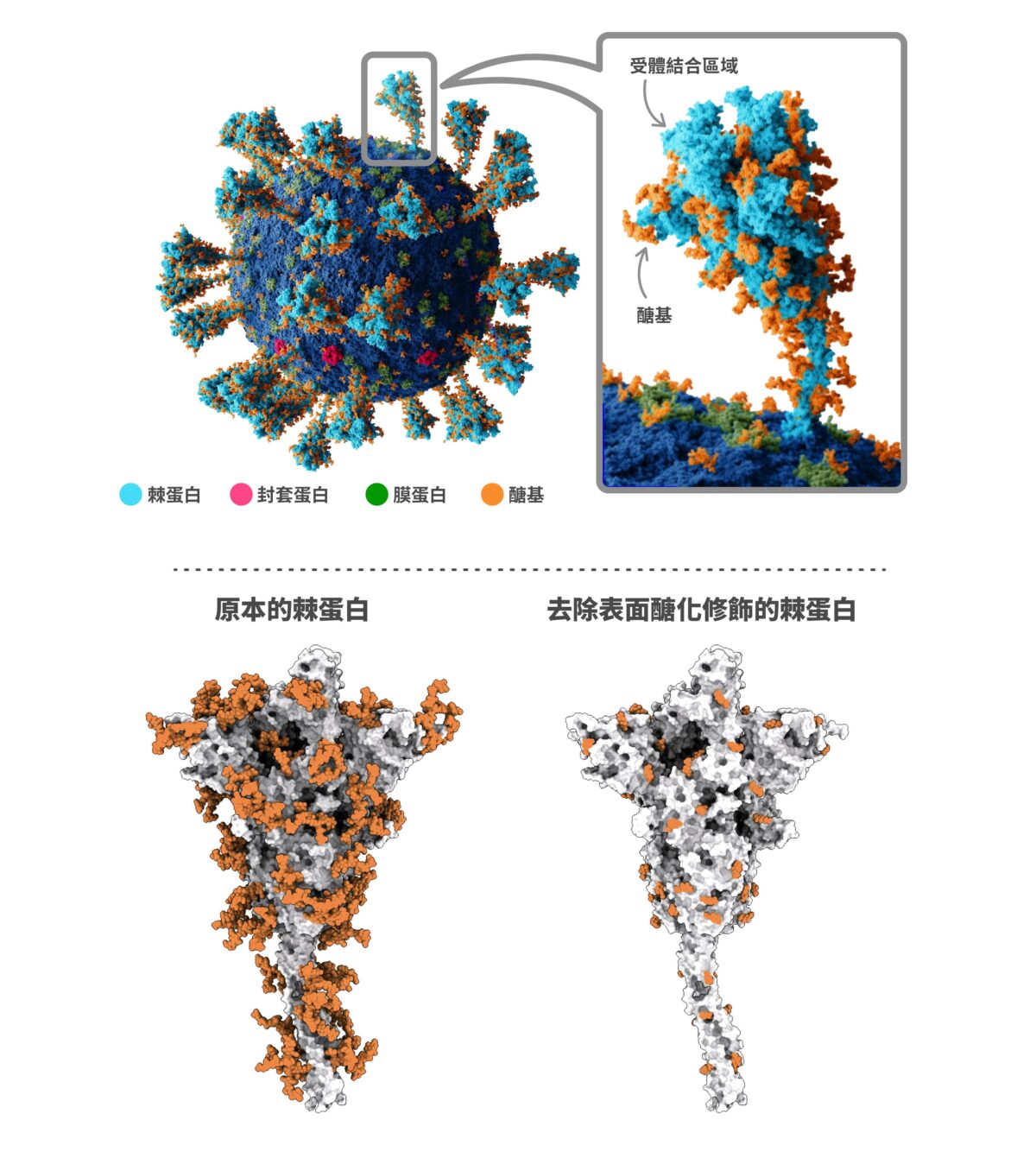
相對的,病毒需要依賴宿主細胞以便大量複製。不同細胞會賦予蛋白質產物不同的醣化修飾。研究發現即使遺傳物質相同的病毒,假如病毒外頭的醣化修飾不同,也會影響感染能力及免疫反應 。由上呼吸道細胞產生的新冠病毒,感染力就比其他細胞更強。
對於開發疫苗,翁啟惠近年投入不少心血。疫苗刺激產生的抗體講究專一性,研發者要想辦法針對病毒結構來調整抗體及 T 細胞反應。翁啟惠與研究團隊的思路卻是另闢蹊徑,並非將病毒露出來的表面設為目標,而是要去掉病毒外層的「醣」衣,也就是「去醣化疫苗」。
因為病毒暴露在外的部分會持續改變,躲避特定抗體,但是被醣基包裹的位置不太會變,或許是人體免疫記憶更好的訓練對象。以此概念製成的蛋白質 或 mRNA 疫苗,若是成功,便有機會成為所謂的「廣效疫苗」,接種一款疫苗就能應付病毒的多型變化,特別是難纏多變的流感病毒、冠狀病毒(例如 SARS-CoV-2)。
新冠病毒(SARS-CoV-2)的棘蛋白上面有醣化修飾(標示為橘色),醣基包裹的位置不太容易突變,因此去除表面的醣化修飾之後,可以進一步製成廣效疫苗。 除此之外,翁啟惠團隊也持續開發廣效癌症疫苗。用抗體對付癌症的想法十分誘人,其難處在於,疫苗刺激產生抗體,辨識外來入侵的異物加以攻擊;但是癌細胞是人體細胞變異産生,上頭存在的成分正常細胞常常也有,設定癌細胞打擊,反而會造成自體免疫的悲劇。
好消息是,癌細胞外頭有些醣化修飾,不同於正常細胞。翁啟惠的隊伍尋獲 Globo H 等幾個醣類分子,適合作為疫苗針對的目標。相關技術已經轉移給業者,正在進行第三期人體臨床試驗。這些圍繞醣分子作文章的創新疫苗令人期待,最終是否能投入實戰,仍有待分曉。
關於醣化學,翁啟惠將持續探究細胞表面醣分子所扮演的角色,以及醣分子和疾病的關係。
給年輕學生的話 :「興趣是研究的動力 」翁啟惠語重心長地提到,醣化學領域如今的樣貌取決於他們這些開拓者,未來則要看能否引發年輕人的興趣,因為未來是年輕人的。
現今教育強調跨領域,翁啟惠自己無疑也是跨領域的知名化學家,但是他提醒年輕人,跨領域絕對不等於什麼都要學、都要會。基礎還是要打好,跨領域的關鍵是有能力與其他領域的人互動合作。
翁啟惠近期便以國家生技醫療產業策進會會長的角色,積極促進醫界與電子業的對話。因為醫界知道市場需求,但不懂得製造;電子業擅長製造,但是對醫療需求沒有深刻理解。他希望營造合作交流的環境,創造新的可能性。
最後,翁啟惠提醒學生,做研究一定要長期投入,深入鑽研,若是短短幾年就轉換領域,只會愈來愈迷茫。興趣對研究生涯最重要,有興趣才有動力,而興趣的培養則來自日常的自我探索。
翁啟惠建議學生在跨領域之前,基礎還是要打好,而跨領域的關鍵是有能力與其他領域的人互動合作。