- 文/新興科技媒體中心博士後研究員 陳璽尹
- 本文轉載自新興科技媒體中心《英國研究如何成為報紙頭條(五)信念?或科學證據?》
編按:充斥在新聞媒體或社群上的偽科學謠言,或似是而非的「新發現」,通常都以誇張聳動的標題吸引讀者的目光,並讓多數人深信不疑。誰能擔任這個破除迷思的角色,成為科學家與媒體傳播間的橋樑,為閱聽者導正視聽呢?這一系列文章,將介紹英國科學媒體中心(SMC)如何運作,打擊新聞上的偽科學、假訊息。
2012 年,法國的分子生物學家吉爾烈 ── 艾希.席哈理倪(Gilles-Eric Séralini)在《食品和化學毒理學》(Food and Chemical Toxicology)期刊上發表研究,其中宣稱,食用「耐年年春除草劑基因改造玉米」(以下簡稱 NK603 基改玉米)的大鼠,與對照組的大鼠相比,長出較多腫瘤且多重器官衰竭。[1] 席哈理倪透過記者會所公布的長了腫瘤的實驗鼠照片,在當天就以最快的速度傳播出去。
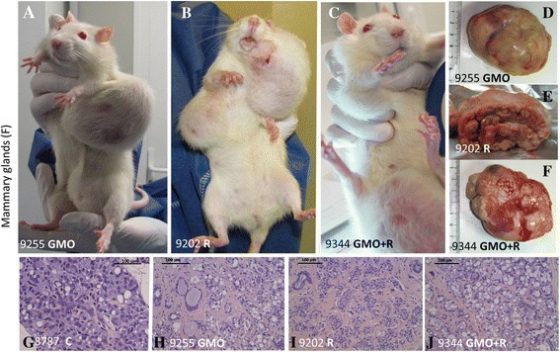
實驗期為2年,著重「長期」影響的研究引注目
這項研究當然不是無中生有,也理應喚醒眾多基因研究的科學家,更審慎面對基因改造作物可能帶來的風險。尤其席哈理倪這篇研究的特殊之處,在於他的研究著重在「長期」的影響。
根據經濟合作暨發展組織(OECD),以及其他國際組織如歐洲食品安全局(European Food Safety Authority,簡稱 EFSA)、聯合國農糧組織(Food and Agriculture Organization,簡稱 FAO)、世界衛生組織(World Health Organization,簡稱 WHO)等機構的標準,關於基改作物的健康安全評估,在商業化之前的最後階段審核,都是基於為期 90 天的研究結果。
實驗期間的長短差異,的確讓席哈理倪的研究獲得公眾矚目,因為席哈理倪 2012 年的實驗是以 2 年為期,來觀察大鼠食用 NK603 基改玉米所帶來的健康影響。而這篇文章所要呼籲的,即是當時對基改作物的安全性評估不夠確實,以致讓有癌症風險的 NK603 基改玉米上市、供人食用。
選用的實驗大鼠天生易長腫瘤,研究遭質疑
同一年,歐盟執行委員會(European Commission)就要求歐洲食品安全局重新檢視席哈理倪的研究;9 月,歐洲食品安全局做出的回應與其他批評者的觀點大多一致:實驗設計不良、樣本不足,沒有足夠證據能支持這篇研究所做之結論。[2]
最主要的爭點在於,其實驗所用的「史一道二氏大鼠」(Sprague-Dawley rat)僅適用於短期實驗,因這品系的大鼠相較於另一種常用的實驗大鼠維斯塔漢(Wistar Han),在 1 歲之後更容易產生腫瘤。[3] 另一個爭點是,實驗樣本和對照組樣本不足。
席哈理倪的實驗中,每一實驗組只有 10 隻大鼠,然而依照經濟合作暨發展組織所制定國際通用的研究標準,若是研究化學毒性,那麼每一實驗組需要 20 隻大鼠(雌雄各半);若是研究致癌性,每一實驗組需 100 隻大鼠(雌雄各半)。且每一實驗組,都應有一對照組作為比較標準。
然而,在席哈理倪的實驗設計中, 9 組實驗組僅有一組對照組。這兩項爭點,是主要的研究缺陷。因為實驗設計不嚴謹,無法排除大鼠隨機產生腫瘤的可能性,更無法獲知史一道二氏大鼠的腫瘤,是否因食用 NK603 基改玉米所致。[4]
圖/wikimedia
質疑批評者受基改公司收買,研究者未正面回應爭議點
然而,針對歐洲食品安全局提出的疑問,席哈理倪不僅沒有提供更多證據,反倒另外發表了一篇針對各種批評的回應文章。[5] 內容主要認為 NK603 基改玉米缺乏長期致癌性研究,並且也質疑歐洲食品安全局的雙重標準,像是他所使用的大鼠品系和孟山都(Monsanto)提交研究所使用的品系相同(實驗期間 90 日),前者通過審核、他的研究卻受批評,以及這份研究並非「致癌性」研究,所以並不適用經濟合作暨發展組織對於樣本數所設立的實驗標準。
甚至,他在文章中質疑這些批評他的人,是因為在爭取基改作物的專利又或是受孟山都收買,從而質疑他的研究成果。
其實這篇文章的回覆,如果仔細檢視說法,並對應兩方批評與各自的證據,不難發現雙方都有部分論點站得住腳。
舉例來說,的確,在當時的規範,基改作物從實驗室到田間,從田間到餐桌,雖然做了環境評估與健康評估,的確忽略了較長期的健康影響研究,這點是席哈理倪的呼籲有理。而他的研究,就專業的科學評斷標準來看,既是處處缺失,也禁不起科學檢驗,而擁有如此缺陷的科學研究,並不值得引起國際社會的恐慌。
以當時各界留下的資料與紀錄,席哈理倪恐是早早有意引起這場爭戰。
科學研究最難的就是:反覆辯證、自我更新
科學界的研究要獲得公眾賞識並不容易,因為單一科學研究的解釋力有限,要從各國各地的實驗室在不斷實驗失敗、成功、發表,再經由下一組人驗證、失敗、再發表,一路走到公眾有感,那是一段非常遙遠的路程。少至 10 年,更多是數以萬計的科學人在實驗室中漫長的研究歲月。
這類反覆辯證、建立、推翻,又再重頭來過的科學進程,雖然緩慢,但在現代科學的同儕審查和科學檢證之下,有其必要。能在規範之下自我更新,是科學研究最為難能之處。
有多神秘?記者拿研究文章竟要簽「保密協定」
席哈理倪在 2012 年發表這份研究之前,[6] 與其他任何一次的科學研究發表一樣,寄出了採訪邀請,但邀請中卻無研究細節與內容,記者無從在記者會之前,預先拿到資料以做準備。如果記者要求預先拿到研究文章,必須簽署保密協定:不得依此聯繫任何其他的科學研究者。
席哈理倪延宕了研究文章的發表時間,直到確定他的團隊所製作的影片《我們都是實驗鼠嗎?》(Are we all guinea pigs?)能及時發表。
各家媒體在不一定讀過研究內容,就算讀過也無從查證的狀況之下,接受這支影片的洗禮。而遠遠在這之前,席哈理倪就撰寫了數本書,陳述基改作物之惡。[7] 當時他的研究以及後續處理,都不正面回應實驗設計的缺失,包括樣本數遠遠不足以支撐研究結論,和使用不適宜研究設計的大鼠、讓結果無論如何傾向有利自己的論述。
相反地,他的回應中,把矛頭指向基因改造作物的跨國企業孟山都,讓自己的研究「不當」沾染道德色彩,更將所屬的研究團隊以被迫害之姿與大眾連結。

圖/wikimedia
恐懼蔓延!爭議研究影響各國基改作物進口政策
席哈理倪用聳動的方式呈現研究,意有所指某個事件內含著不公義,再包裹著科學糖衣來宣傳自我意識形態,可悲的是,這些招數都非常有效 。
若要說,透過現代媒體技術並操弄民眾心理,最成功行銷研究的例子非席哈里倪莫屬 。有人認為,在這起「新聞事件」之後,啟發了法國運動者在同一年破壞了基改黃豆的寄售店,俄國和哈薩克禁止席哈理倪研究中的基改玉米進口,肯亞全面禁止基改作物進口,秘魯則是禁止了接下來 10 年的基改作物進口。[8] 而至今,基改作物有致癌疑慮的恐懼,仍深深烙印在世界各地的民眾心裡。
歐盟科學界對席哈理倪研究的回應,是在 2014 年同時啟動三個計畫,依照最嚴謹的實驗規格,重做席哈理倪的實驗,用相同的基改玉米、一樣的兩年時程,足夠的樣本數,耗費 4 年時間,想要找出一個真正可予公憑而非心證的科學答案。這三個計畫分別稱為「基改作物風險評估和證據溝通」(GRACE)、「基改作物 90+」(GMO90plus)和「基改作物兩年期安全測試」(G-TwYST)。[9] 且所有的原始資料都全面公開,讓有意重複驗證的研究者能自由取用。
歐盟科學界重做同樣實驗,結論大不相同
「基改作物 90+」的成果於 2018 年 12 月發表,使用實驗長度是原本的 90 天標準。結果發現,席哈理倪的研究結果,在此研究中未被證實。[10] 今(2019)年,「基改作物兩年期安全測試」成果發表,席哈理倪的研究結果再一次未被證實。[11]
席哈理倪在自己架設的網站上,駁斥這兩份駁斥他研究成果的研究,同時發布新聞稿。[12] 他攻擊的其中一個重點是 ,大鼠品系不同。他認為,他的研究所使用的史一道二氏大鼠對致癌物質較為「敏感」(sensitive),而歐盟科學家使用的維斯塔漢大鼠對致癌物質「較不敏感」。巧言令色地迴避了自己遭受的質疑,而將嚴謹的實驗設計扣上了不實指控。
試想,如果實驗選用原本就易得腫瘤的大鼠,該如何得知 NK603 基改玉米是否會對人體健康產生影響?這樣的詭辯,仍獲得一定程度的媒體曝光量。
面對爭議話題,科學家如何與著急的民眾對話?
「科學界的爭辯」在各種簡化之後,被呈現在媒體上,吸引了大眾目光。一份禁不起科學檢驗的研究報告,如同謠傳麻疹腮腺炎德國麻疹混合( MMR ) 疫苗會導致自閉症的偽科學資訊,傳遞至世界各個角落,再利用民眾的直覺想像與恐慌,透過社群網路散播出去。
事實上,無論是支持基改作物,又或反對基改作物的雙方論述,不僅需要公眾辯論,更需要雙方支持者願意理解與溝通。善用大眾語言一向不是多數科學家的專長,理解公眾的擔憂與科學研究之間存在著鴻溝,而如此鴻溝必須被回應,更是多數科學家仍然需要再進修的課題。
英國科學媒體中心(Science Media Centre,簡稱SMC)紮紮實實打了基改作物這場仗,至於成效如何,請待下一篇文章再來爬梳英國的科學家,是如何在 SMC 的協助之下,進入大眾溝通的媒體場域。而基改作物的支持者與反對者,屏除席哈理倪無法被重複驗證的科學研究與話術之外,又是根據何種理由繼續論辯。
註釋
- 該篇研究引起社會重視後,在 2012 年因歐盟食品安全局重新評估該研究,並認為其實驗設計與數據,難以達成該研究宣稱的結論,而於 2013 年遭到期刊撤回,2014 年又由《歐洲環境科學期刊》(Environmental Sciences Europe)重新刊登。
- EFSA (2012). “Statement of EFSA. Final review of the Séralini et al. (2012a) publication on a 2-year rodent feeding study with glyphosate formulations and GM maize NK603 as published online on 19 September 2012 in Food and Chemical Toxicology.”EFSA Journal 10(11): 2986.
- Weber K. (2017). “Differences in types and incidence of neoplasms in Wistar Han and Sprague–Dawley rats.” Toxicol Pathol 5:64–75.
- 同前引註 2。
- Seralini, G. E.,Mesnage, R.,Defarge, N., Gress, S., Hennequin, D., Clair E, Malatesta, M., and Vendômois, J.S. ( 2013) “Answers to critics: why there is a long term toxicity due to NK603 Roundup-tolerant genetically modified maize and to a Roundup herbicide.” Food and Chemical Toxicology 53: 461–468.
- Gerasimova, K. 2018. Advocacy science: Explaining the term with case studies from biotechnology. Sci Eng Ethics 24:455–477. Accessed: 2018-10-14.
- 同前引註。
- 同前引註。
- G-TwYST (2014). “About G-TwYST.” 2019/07/26 檢閱。
- Coumoul, X. et al. (2018). “The GMO90+ project: absence of evidence for biologically meaningful effects of genetically modified maize-based diets on Wister rats after 6-months feeding comparative trial.” The Journal of Toxicological Sciences 168(2): 315–338.
- Steinberg, P. et al. (2019). “Lack of adverse effects in subchronic and chronic toxicity/carcinogenicity studies on the glyphosate-resistant genetically modified maize NK603 in Wistar Han RCC rats” Archives of Toxicology 93(4): 1095-1139.
- GMOSeralini (2018) “EU Funded Rat Feeding Studies Do Not Refute the Séralini Study.” 2019/07/26 檢閱。
- 本文轉載自新興科技媒體中心《英國研究如何成為報紙頭條?(五) 信念?或科學證據?》。