戴維斯.穆爾十七歲的獨生女遭人強暴並被殘忍地殺害,警方卻始終破不了案。自從他女兒的命案發生後,他和妻子從此活在痛苦的深淵。但他不甘心,他立誓要找出殘殺女兒的凶手。一年半後,他逮到一個機會,就是當從警方手上拿回女兒的遺物時,他能夠弄到凶手的 DNA。事實上,戴維斯.穆爾本人就是位為不孕夫婦複製小孩為生的醫師。於是,他利用了凶手的 DNA,複製了一個男孩給透過複製技術生下小孩的一對夫婦。年復一年,他跟蹤這個家庭,想要從小孩長大的模樣中,看到凶手該死的模樣,並且將凶手人肉搜索出來……
醫學驚悚小說《複製邪惡》(Cast of Shadows)講述了這個寫實的故事。這真的是一本讓人難以放下手的小說,有引人入勝的懸疑劇情,不斷吊讀者胃口。《複製邪惡》說的不止是一個復仇的故事,還是一個科技被濫用的倫理故事。也讓人不禁要思索和瞭解,我們有多少行為,是受到基因的影響?邪惡,會遺傳嗎?我們出生時是一張白紙嗎?還是近朱者赤、近墨者黑?我們最終會成為自己想要成為的人?
從《複製邪惡》要讓我們窺看到另一種邪惡,就是一個來自「上帝之手」組織的殺手,深信複製技術是種罪惡,決定獵殺那些從事複製研究的相關人員,戴維斯.穆爾就是他的目標之一,但戴維斯.穆爾死裡逃生。一個堅信人不該扮演上帝操弄人命的邪教徒,自己卻扮演起了上帝來奪取人命,這種邪教在政壇上,我們也見多了。
《複製邪惡》並沒有談到複製科技的細節,雖然在理論上,在可見的未來,是可行的。可是,《複製邪惡》卻用一場又一場的佈局,讓讀者思考科技,在我們的社會中該扮演的角色。因為,《複製邪惡》不直接談科技本身,但也突顯了科技對我們來說,真正該有的意義。除了複製,《複製邪惡》還談到電腦裡的虛擬世界,那虛擬世界裡,人們可以盡情完足慾望,那還有現實世界中的倫理道德嗎?
《複製邪惡》舖的梗實在太精彩了,讀完真的不禁要喝彩,大呼過癮!雖然涉及了宗教、哲學、科學三股力量,可是《複製邪惡》卻不生硬,反而是用一個很寫實的故事,讓實際讓我們思考,說不定《複製邪惡》也適合當生物倫理學課的指定課外讀物。
為了不爆雷,《複製邪惡》 的討論就此打住,接下來姑且讓小弟在此作點科普吧!
就從複製動物談起
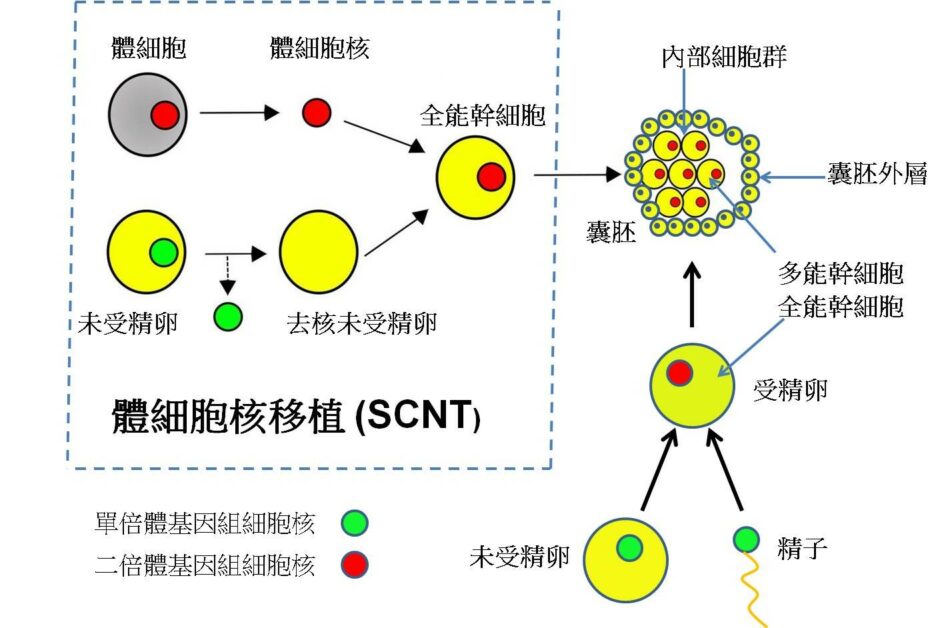
第一隻複製哺乳動物,公認是桃莉羊(Dolly,1996-2003)。那是用細胞核移植技術將哺乳動物的成年體細胞培育出新個體。牠由蘇格蘭愛丁堡大學羅斯林研究所(Roslin Institute)的伊恩.威爾穆特(Ian Wilmut)和基思.坎貝爾(Keith Campbell)領導的小組培育的。
桃莉是由移植母羊的乳腺細胞到被摘除細胞核的卵子細胞中發育而成的,證實了哺乳動物的特異性分化細胞也能發育成一個完整的生物體。按照伊恩.威爾穆特的說法,因為桃莉羊是由乳腺細胞發育而來的,所以用胸部異常豐滿(40DDD)的美國鄉村音樂天后桃莉.巴頓(Dolly Parton)的名字來命名。桃莉羊的問世,引發了大眾對於複製人的想像,在受到讚譽的同時也引來了爭議。
桃莉羊一生都待在羅斯林研究所。她與一隻威爾斯山羊交配,先後產下六個羊羔。2003 年 2 月 14 日,桃莉羊因肺病和關節炎而死亡,只活了不到七年,而綿羊的正常壽命應該是 12 年左右。病理解剖顯示桃莉得了一種在綿羊中常見的由反轉錄病毒引起的肺癌。羅斯林研究所的科學家稱這並沒有證據顯示癌症和複製有關,因為長期在室內圈養的羊容易得這種癌症,而桃莉是一直被養在在室內的。
我在 2011 年到過羅斯林研究所參加研討會,那是世界最頂尖的動物科學研究機構,當然也到了愛丁堡的蘇格蘭國家博物館去朝聖,瞻仰製作成標本的桃莉羊!
複製動物中的醜聞
桃莉羊之前,科學家普遍認為哺乳動物的複製是不可能的,可是桃莉羊的成功後,激勵了許多科學家,重燃了熱情與希望,於是許多別的哺乳動物的複製也獲得了成功,如馬、牛、狗、猴。因為技術的缺陷,複製胚胎的死亡率極高,桃莉是 277 個胚胎中唯一存活下來的,複製狗實驗中三千多顆受精卵只有三顆成功長成胚胎,最終只有一隻狗存活。在許多國家,複製技術,尤其是與人類有關的複製被嚴格管制。
桃莉羊之後,最有名的複製哺乳動物科學家是韓國的黃禹錫(황우석,1952-),他曾經擔任首爾大學獸醫系首席教授,他成功在 1995 年成功複製牛,2004 年他首次成功地從人類的體細胞中製作了胚胎幹細胞,2005 年 5 月他宣稱成功把人類的體細胞移殖到人的卵子細胞,並成功把細胞培養成為胚胎。2005 年 8 月成功複製了狗。
黃禹錫在幹細胞的研究一度令他成為韓國人的民族英雄,甚至被視為朝鮮族摘下諾貝爾獎的希望。可是 2005 年 11 月 24 日,他由於在研究中爆出倫理醜聞,被指控使用了女研究員的卵細胞,並有細胞買賣的行為,辭去了在首爾大學的一切公職。2005 年 12 月,他被揭發偽造多項研究成果,韓國舉國嘩然。2010 年 12 月 16 日,首爾高等法院二審判黃禹錫有期徒刑 18 個月,緩刑兩年。在 2005 年初到 2005 年末,一個科學家從全世界萬眾矚目的巨星到殞落成過街老鼠,讓科學界充滿了戲劇化的高潮迭起。

黃禹錫從被捧為國寶到貶為國恥那年,已過了十年。我有韓國友人近來透露說,韓國會發生這樣的事,事後諸葛地看,似乎是種必然。因為韓國甚至比台灣更重視論文發表,他們可以把大量資源投注在最有希望的科學家身上,給予至高無上的榮耀,但也緊盯著他們的進度,讓科學家成天惶恐進度落後,於是在強大的壓力下造假。不合理的自卑成了自大,成天想抄捷徑超英趕美,造成的也是一種複製的邪惡吧!
邪惡跟基因有關嗎?
另一個科普問題是,邪惡的行為能夠遺傳嗎?
過去,曾有遺傳學家認為染色體異常,是導致暴力犯罪的原因之一,尤其是帶有 XYY 性染色體的人,被認為特別容易犯罪。科學家曾認定,帶有 XYY 性染色體的人,會有特別高的身高和暴力傾向。這個觀點曾被遺傳學教科書廣泛引用,可是事實上卻缺乏科學證據,基本上就是標準的以訛傳訛。後來反而有愈來愈多的證據顯示,XYY 性染色體的男人確實長得較高,可是卻沒有特別具暴力傾向。
當科學界漸漸認識到這個對染色體異常的認知偏見後,就把注意力轉移到基因突變上。 大量研究顯示暴力行為在人類,遺傳因素大約五成,而環境因素則可能為另外五成。並且,暴力行為也非單一基因或少數基因的變異就能夠完全解釋的,而是一個數量性狀遺傳,就像身高和體重一樣, 姑且不論環境的影響,其遺傳因素也是由好幾個,甚至大量的基因變異所決定的。基因之間也存在著複雜的交互作用,稱作「上位效應」( Epistasis),例如有研究發現一個基因對暴力行為的影響,也受到另一個基因的控制。
雖然在實驗鼠進行的研究發現了近廿個基因可能和侵略性行為有關,可是在人類的研究中,僅發現其中少數幾個基因變異可能和侵略性行為有關。在阿茲海默症病人中曾發現載脂蛋白 E(alipoprotein E)的 ε4 對偶基因和侵略性行為有關, 其他的研究也發現色氨酸羥化酶(trypto phan hydroxylase)、血清素 5HT-2A 和 5HT-2C 受器以及血清素轉運蛋白(serotonin transporter)等基因的多型性和暴力行為有關; 兒茶酚-O-甲基轉移酶(Catechol-O-methyltransferase,簡稱 COMT)的一個突變也被認為和精神分裂病人的暴力行為有關。
後來,多巴胺(Dopamine)、去甲腎上腺素(Norepinephrine)和 γ-丁氨基酪酸(γ-aminobutyricacid,簡稱 GABA)等神經傳導物質也被陸續發現和侵略性行為的遺傳相關。也有研究顯示, 飲食以及血糖濃度也和暴力行為有關,因此造成「血糖過低」(hypoglycemia)的基因,例如葡萄糖轉運蛋白, 以及一個會影響血糖濃度的血清素轉運蛋白連鎖區域(5-HTTLPR),也被認為可能和暴力行為有關。與暴力行為有明確關連的基因突變,發生在單胺氧化酶(Monoamine oxidase,簡稱 MAOA) 。在研究一個大型荷蘭家族的遺傳後, 科學家在九十年代發現,該家族有暴力、縱火、性侵等犯罪記錄的男性中, 皆找到一個突變, 導致 MAOA 活性的缺失, 這也顯示了生物胺(Bioamines)的代謝,和侵略性行為息息相關。後來的研究也發現 MAOA 的多型性和人類、老鼠、恆河猴的暴力行為有關。
科學家發現, 血清素受器和 MAOA 基因對侵略性行為的影響,是受到童年的經驗決定的。有研究顯示,MAOA 基因的一個多型性對暴力行為的關連,取決於帶有該多型性的個人,童年時是否遭到虐待。帶該多型性的受虐兒童會比一般兒童更容易發展出反社會行為。更進一步的研究也發現,這樣的基因型-環境互動和性別有關。
事實上,以上提到的遺傳因素,僅是冰山一角。已知許多基因型的表現和生活經驗息息相關,也有成千上萬帶有同樣基因型的人們過著正常的社交生活,遺傳學頂多也只能夠解釋部分因素。近年就有位神經科學家意外發現自己的腦造影影像和暴力罪犯很相似,但他是位成功的學者,只是為人處事比較有侵略性一些而已,這說明同樣的基因和大腦,並不見得讓一個人的人生從此注定。
更多的科學研究也可能對人類行為的遺傳有更深入的理解,不過這仍不會改變人性,還有人性面對科技進展的反應,《複製邪惡》可以讓你我好好思考。
本文原刊登於閱讀.最前線【GENE思書軒】,並同步刊登於The Sky of Gene。