人類繼續位居地球統治地位的最大威脅是病毒
“The single biggest threat to man’s continued dominance on the planet is the virus.”
—約書亞·雷德伯格(Joshua Lederberg),1958 年諾貝爾生理醫學獎得主
經過幾萬年的進化,人類成了地球上的萬物之靈,建立了「人定勝天」的的自信,認為愚公尚可移山,我們還有什麼做不到的?
但這次「2019 年冠狀病毒肺炎」 (COVID-19) 的瘟疫爆發,相信會讓很多人重新思考著這個問題,甚至覺得人類原來這麼渺小,竟然會被一個「不倫不類」的病毒 (virus) 搞到天翻地覆:有足但不能出去、有錢但買不到東西、有醫院但沒有床位、⋯⋯有生命但必須看病毒的臉色!
美、法政府都因之向病毒宣戰,知己知彼百戰百勝,可是我們的敵人在哪裡?
2019年冠狀病毒瘟疫的報章雜誌報導成幾何級數的增加,但它們大多是談如何預防、解藥以及疫苗的發展,很少涉及「病毒到底是什麼東西」。要知己知彼,僅僅談論那些表面的問題,當然只是「知其然不知其所以然」,是不夠的;了解病毒的本質才是根本之道,現在就讓我們一起來探討「病毒到底是什麼東西」吧!
病毒和細菌有什麼不一樣?
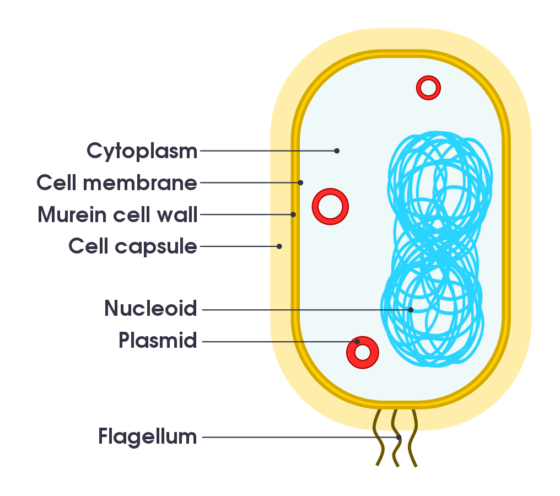
病毒與細菌 (bacteria) 都是導致人類疾病的微生物 (microbe) ,因此相信許多讀者都想知道它們到底有什麼分別?從微生物的觀點上來看,它們最大的分別在於前者不屬於細胞,而後者則是一種細胞。
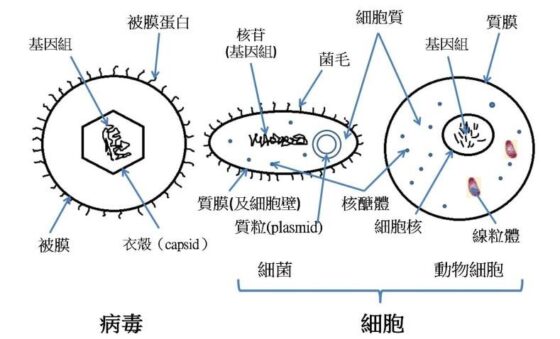
細胞是生命的基本單位,它主要由基因組 (genome) 、細胞膜 (cell membrane) 、細胞質 (cytoplasm) 、和核醣體 (ribosome) 組成。
細胞質為執行細胞生長、代謝、和復制功能的地方,為細胞中的微觀工廠;核醣體將遺傳密碼從核酸的分子語言翻譯為氨基酸的分子。細胞本身含有代謝酶,因此有營養系統;不需宿主活細胞,即可自行繁殖。
細菌因為沒有真正的細胞核 (nucleus) ,屬於原核生物 (prokaryote) ;儘管如此,它們卻有一個叫做「核苷」(nucleoid,「類核」之意)的區域,內含了懸浮的遺傳物質。像植物的細胞一樣,許多細菌也有支持整個細胞結構的細胞壁。細菌中有一條稱為「質粒」 (plasmid) 的小環狀 DNA 鏈,可以獨立地複製其遺傳結構:因很容易取得、注入、或在(不同)細菌間互換,已經成了生物科技的「寵物」。
- 延伸閱讀——人造胰島素開啟生技產業——胰島素與生技產業的誕生
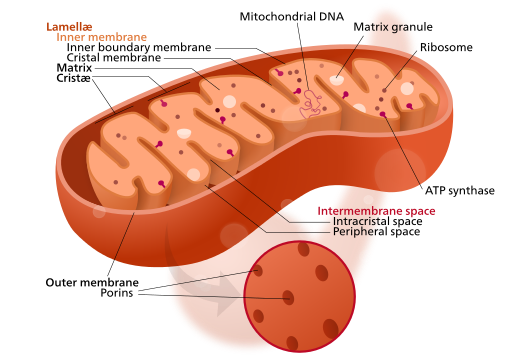
高等動植物的細胞因為具有真正的細胞核,故稱為真核細胞 (eukaryotic cell) 。它們沒有「質粒」,但卻有像消化系統一樣的「線粒體」 (mitochondria) 來吸收營養,分解營養,並為細胞創造能量豐富的分子。像「質粒」一樣,線粒體含有自己的(小環狀)基因組,也可以獨立自行複製,因此有理論謂它們是細菌進化遺留下來的。
因人類線粒體只由母體遺傳過來,因此在家譜及個體辨識上的研究佔有非常重要的地位註1。
Virus 一詞來自拉丁語,意思是「粘液」或「毒藥」;中文譯成「病毒」註2。病毒比細菌還小,大約在 20 到 750 奈米( 10-9 公尺)之間,所以它們可通過「錢伯蘭過濾器」 (Chamberland filter) ,因此早期被稱為「過濾性病毒」。
病毒的基本結構由以 RNA 或 DNA 遺傳分子為中心,加上外圍之蛋白質層衣殼 (capside) 組成的。 RNA 或 DNA 具傳染性,衣殼則為病毒提供個別個性。蛋白質層和遺傳信息的排列形式多種多樣,可成二十面體、包膜、或螺旋形。在某些病毒體中,衣殼常被一層脂肪被膜 (envelop) 包裹著註3。
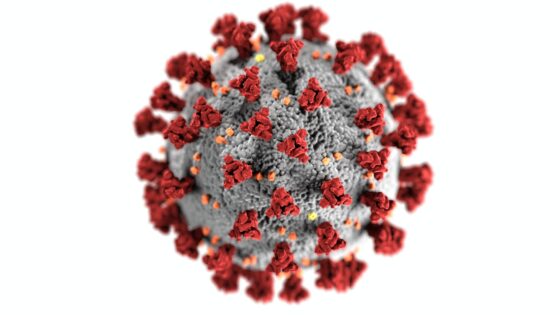
病毒因本身沒有任何代謝酶,故在沒有宿主活細胞的幫助下,無法自行繁殖。所以保持良好的衛生環境對病毒傳播的疾病是沒有什麼幫助的。在實驗室中,我們可以將病毒像一般沒有生命的化學物質一樣操作,如結晶、離心、及擴散等。就這一點來看,稱病毒為「微生物」是有問題的。
從發現病毒的歷史說起
1676 年,荷蘭商人兼科學家、微生物之父列文虎克 (Anton van Leeuwenhoek) 改進了顯微鏡,首先通過顯微鏡觀察到了單細胞的「原生動物」 (protozoa) ,並將其稱為「動物」 (animalcules) ,為微生物學奠定了基礎。
德國博物學家埃倫貝格 (Christian Ehrenberg) 於 1838 年因最早觀察到的細菌呈棒狀,將它們改稱為「細菌」(bacteria, 源自希臘語 baktḗria ,「小棍子」之意)。

1892 年,俄羅斯微生物學家伊萬諾斯基 (Dmitri Ivanoski) 試圖尋找引起煙草花葉變色的原因時,發現經過錢伯蘭過濾器過濾後,感染煙草花葉葉片的提取物仍具有感染力;因細菌不能通過這種過濾器,表示該提取物應比細菌還小。 但是,伊萬諾夫斯基可能不知道他事實上是發現了新的微生物,因此報告了他的實驗結果後,就繼續從事其他工作去。
六年後的 1898 年,荷蘭生物學家貝耶林克 (Martinus Beijerinck) 獨立進行了相同的實驗,宣布發現了一種新型感染生物 (infecting organism) ,並將其命名為「病毒」。
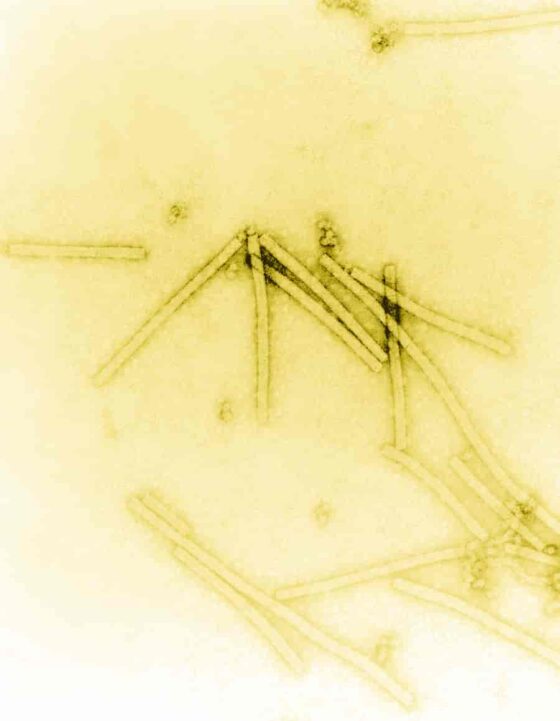
1935 年,美國生化學家斯坦利 (Wendell Stanley) 分離出一種顯示煙草花葉病毒活性的蛋白質和核酸分子的棒狀聚集體註4:它雖然像是一種正在生長的生物,但明顯的是由一些複雜的無生命化學物質組成,因此缺乏代謝功能⎯⎯—生命的生化活性所必需的功能。斯坦利和其他人進一步研究證實,病毒的構造比原核細胞還簡單。
造成疾病的原因眾說紛紜
1850 年代前,大部分醫生都不相信看不見的、那麼小的細菌(單細胞生物)會傳播疾病,甚至導致死亡。那個時候的醫生大多認為疾病(例如霍亂或黑死病)是由瘴氣(miasma,古希臘語「污染」)引起的。此一稱為「瘴氣理論」 (Miasma Theory) 認為流行病的起源是由有機物腐爛引起的瘴氣所造成的。
1854 年英國醫生斯諾 (John Snow) 確定倫敦的霍亂流行源是 Broad Street 泵污染的水。 他下令關閉泵後,流行病逐漸消退。 然而,許多醫生還是拒絕相信隱形生物會傳播疾病。

1857年,法國啤酒釀造商請巴斯德 (Louis Pasteur) 尋找葡萄酒和啤酒有時會變質之原因時,巴斯德研究發現:雖然酵母在釀造過程中可以將糖變成酒精,但細菌可以進一步將酒精變成醋。 他建議釀造過程中將產品加熱到足以殺死細菌,但不能殺死酵母的溫度來防止啤酒變質註5 。
科赫假說:引起疾病的病原體是誰?
1880年初,德國醫師兼微生物學家科赫 (Robert Koch) 確定了結核 註6 和霍亂等的病原體 (pathogen),為傳染病的概念提供了實驗室的證據。
科赫假說 (Koch’s postulates) 是將某一微生物與某一疾病聯繫在一起的一系列四項通用原則,奠定了現在的流行病學基礎。到1880年代末,瘴氣理論終漸被「疾病的細菌學理論」 (Germ Theory of Disease) 取代。
疾病的細菌理論是目前公認的疾病科學理論。 它認為疾病是因為「病菌」 (germ) 或「病原體」造成的。這一理論裡面所指的「病菌」或「病原體」事實上是包括任何不用顯微鏡就看不到的「微生物」:它們一旦侵入了人類或其他生物體,立即在宿主體內生長和繁殖而導致疾病。「微生物」的主要類型有病毒、細菌、真菌 (fungi) 、和原生動物。
病毒如何讓人生病?關於致病機制
病毒透過各種「欺騙」手段混入細胞(稱為宿主)後,它們就脫掉蛋白質外衣,裸露其基因,並誘導細胞自身的複制機制來複製其 DNA 或 RNA ,並根據病毒核酸中的指示生產更多的病毒蛋白質; 新創建的病毒片段會聚集,並產生更多病毒,感染其他細胞。
它們雖然具有上述那些成長、適應環境、繁殖、和進化的生物特質,但卻缺乏通常被認為是生命所必需的其它關鍵特徵(例如細胞結構、新陳代謝等),故病毒常被認為是處於活體與非活體之間的「生命邊緣生物」。
病毒既然沒有生命,因此嚴格來說「殺死」病毒是沒有意義的;我們只能說「破壞其化學結構」,使其失去感染的活性。話雖如此,談論病毒可以「存活」(具感染力)多長時間還是有意義的。
化學物質能夠「存活」多久,當然與其結構及環境有關;比如一塊鐵片,在乾燥的環境中可以保存相當久,但是濕度一高便生鏽變質。一般化學物質在高溫度時均比較不穩定,因此年初 2019 年冠狀病毒病爆發時,不少科學家認為疫情到夏天應該會緩和下來;但現在看來這一假設顯然是錯誤的註7。

雖然不到 1% 的細菌會引起人類疾病,但大多數病毒都會對特定某一器官如肝臟或呼吸系統引起疾病。某些病毒⎯⎯稱為「噬菌體」 (bacteriaphage) ⎯⎯—甚至可以感染細菌。因為都是身體免疫系統試圖清除感染所造成的反應,故細菌和病毒感染所引起的症狀都非常相似:咳嗽、打噴嚏、發燒、發炎、嘔吐、腹瀉、疲勞、和抽筋等等。
病毒竟然也懂「偷渡」?
病毒常可導致宿主死亡;但這在「進化論」中事實上是違反了「適者生存」之原則:宿主死了,自己不是也跟著滅亡嗎?
因此一個致死率很高的新病毒,應該都是從其它動物傳來的「外來物」;為了生存,它們終將在人類中慢慢進化演變成致死率較低的病毒。從病毒本身的角度來看,理想的感染應是幾乎無症狀的感染,使其宿主不知不覺地提供無限制的庇護和營養;「較聰明」的的病毒甚至可以幫助宿主生存!
這說明了為什麼人類的基因組裡攜帶了成百上千的這種偷渡者,它們模糊了與「正常基因組」之間的界限!
病毒感染的治療與預防
抗生素的發現被認為是醫學史上最重要的突破之一。「不幸」的是:抗生素是透過破壞代謝過程來殺死或抑制特定的細菌;因為病毒不具代謝功能,而是利用宿主細胞來為其執行活動,故抗生素對病毒束手無策!

加上病毒相對較小,構造簡單,並且可以在細胞內繁殖,因此病毒感染的治療甚具挑戰性。例如由流感病毒引起的傳染性呼吸道疾病(感冒),全世界每年有 10 億人感染, 300 到 500 萬嚴重病例,以及 30 萬至 50 萬例死亡,但目前還是只有緩解症狀的藥物,沒有治療的藥物。
幸運的是,經過幾萬年的進化,我們的身體已發展出兩套主要的治療方法。
其一是當病毒開始繁殖時,被感染的細胞表面就會發生改變,讓身體裡一些稱為T淋巴細胞的免疫系統細胞,識別並殺死含有病毒的細胞免其繁殖。
被病毒感染的細胞也會產生並釋放一稱為乾擾素 (interferon) 的小蛋白質,它們不但可干擾病毒在感染細胞內的複制能力,也可充當信號分子,警告附近的細胞有病毒存在,促使 T 細胞在該區域進行調查。

其二是我們體內有超過100億種因免疫系統針對異物 [稱為「抗原」 (antigen) ] 而產生的抗體 (antibody) ;它們是白血球細胞製造出來的一種蛋白質,可識別入侵的病原體並與其結合(粘附),為免疫系統武器中的主要武器!
「疫苗」 (vaccine) 就是在人體中注射缺乏活性的「異物」,預先引發身體的抗體反應,嚴陣以待具活性之敵人的入侵。 17 世紀時,中國佛教僧侶雖然不明其理,就已經知道喝蛇毒可以增強對蛇咬的免疫力,及用牛痘塗抹皮膚傷口以增強對天花的免疫力。
1796 年,英國醫師兼科學家詹納 (Edward Jenner) 因聽聞患了牛痘後的擠奶員不受天花的侵害,將牛痘病毒 (cowpox) 注射到一位 8 歲的園丁小男孩身上,發現果對天花具有免疫力註8。
儘管當時曾被(尤其是教會)批評為「(用患病動物物質接種人類是)令人反感和不敬虔的」,但現在詹納已被公認為是西方疫苗學的奠基人。 1798 年,詹納從拉丁語「 vacca」(牛)創造出了 vaccine 一詞,醫學畀也開發出第一種天花疫苗。
好的疫苗應可同時觸發免疫系統的兩臂(抗體和 T 細胞),強力反擊入侵的外客。
準備好對抗病毒了嗎?
上次全世界大瘟疫發生於 100 多年前,因此現在還活著的人可以說大都沒親身體會過病毒的厲害:據估計, 1918 – 1819 年由具有禽源基因的 H1N1 病毒引起的流感感染了三分之一的世界人口(約 5 億人),死亡人數至少為 5,000 萬,其中約 675,000 在美國發生。

了解病毒事實上只是一種構造簡單的無生命化學物質之後,降低感染之道當然淺而易懂:戴口罩、經常洗手(能戴上眼鏡更好)、及避免到人多地窄不通風的窒內聚會!前面提過,病毒比細菌還小,可通過錢伯蘭過濾器,因此即使是所謂的手術用面罩 N95 ,也不能阻止單獨的病毒通過註9!

還好病毒單獨存在的機率是非常小的!面罩旨在幫助阻止可能包含病毒和細菌的大顆粒唾液和呼吸道分泌物的飛濺(大約在兩公尺內),進入他人的口鼻或塵落於它物表面註10,以及幫助自己減少吸入他人(可能是無症狀患者)的飛濺分泌物。
人體平均約含 37 萬億個細胞,可是病毒卻連半個細胞都稱不上,你相信它們會是「人類繼續在地球上統治地位的一個最大威脅」嗎?
註解
- 個體的線粒體基因與核基因的遺傳機制不同。在人類中,當卵細胞受精後,卵核和精子核在遺傳 DNA 上做出同等貢獻。 相反,線粒體及其 DNA 通常僅來自卵細胞。 精子的線粒體進入卵子後,不會為胚胎提供遺傳信息,反而被標記以便在胚胎內破壞。卵細胞中的線粒體相對較少,但是這些線粒體能夠存活並分裂,形成生物體的細胞。 因此,線粒體在大多數情況下僅從母親那裡繼承過來。
- 有些病毒生物學家稱被感染的細胞為病毒,存在於宿主細胞外部的完整感染性病毒病則稱為「病毒體」(virion)⎯⎯我們在這裡不做此一區分。
- 在這種情況下,病毒體可因暴露於脂肪溶劑(如乙醚和氯仿)而失活。
- 斯坦利因「以純淨的形式製備酶和病毒蛋白」的貢獻而得 1946 年諾貝爾化學獎。
- 這一現在稱為「巴氏滅菌法」(pasteurize)在日常生活中還到處可見:例如鮮牛奶的消毒與保存。
- 由於對結核病的研究,科赫於 1905 年獲得了諾貝爾醫學獎。
- 另一可能的解釋是: 2019 年冠狀病毒透過污染物體表面傳播的機率不大(見註 10)。
- 隔年,詹納投了一篇短稿到英國皇家學會 (Royal Society) ,描述了實驗和觀察結果;但是,論文被拒登了!
- 2019 年冠狀病毒病的粒徑在 0.06 微米至 0.14 微米之間, N95 掩模可過濾至0.3 微米,因此 N95 口罩原則上應該是無法阻擋病毒顆粒通過。但因掩模通道都不是直線的,曲折的病毒顆粒運動大大增加了它們被面罩纖維纏住被捕獲的機會。
- 美國疾病管制中心 (CDC) 謂目前的證據顯示 2019 年冠狀病毒可以在物體表面上存活數小時至數天,因此雖然未有病毒透過污染物體表面傳播的案例(見註 7 ),但仍建議消毒物體表面。