癌症成為國人十大死因的今日,大家都有個印象,癌細胞最棘手的部分,就是像小強一樣難以全數殺光。即使病人表面康復,它們也有機會在若干年後死灰復燃,甚至出現更強的抗藥性,令人聞風喪膽。
近年來的研究發現,同樣是癌細胞,其實還是有分別。在癌細胞種群中,潛伏了「頭目」癌幹細胞(cancer stem cell, CSC)1 。跟普通的癌細胞不一樣,頑強的癌幹細胞擁有非常強大的 DNA 修復能力,不但可以逃過傳統治療,更能不斷補充癌細胞。
換句話說:沒有針對癌幹細胞的癌症治療,都是治標不治本的。
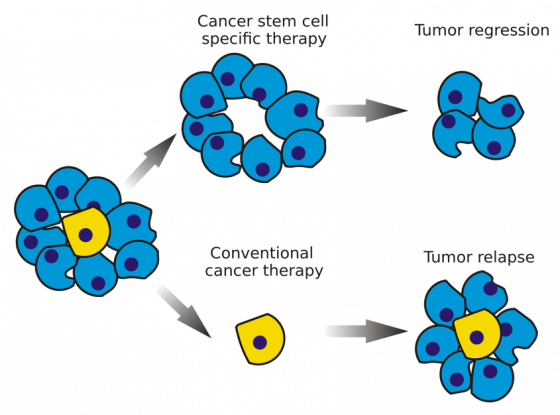
什麼?癌細胞也有「幹細胞」?
近年的研究都逐漸趨向支持癌幹細胞的存在,顛覆了大眾長久以來對癌症的認知。
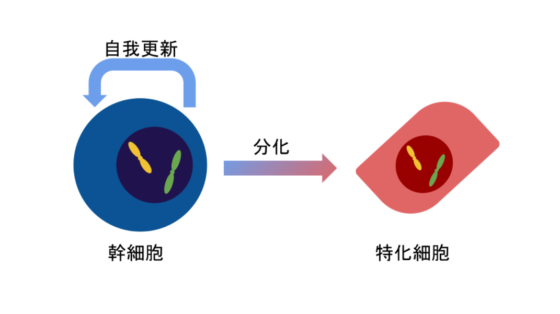
作為癌細胞的「首領」,癌幹細胞當然有過人之處啦!它們有更開放的染色質,給「急救員」足夠的空間進行 DNA 修復工程,保持遺傳物質完整,增加細胞存活率,更像一般幹細胞一樣擁有自我更新(self-renewal)註1 和分化(differentiation)註2 的能力,有效維持癌細胞種群。
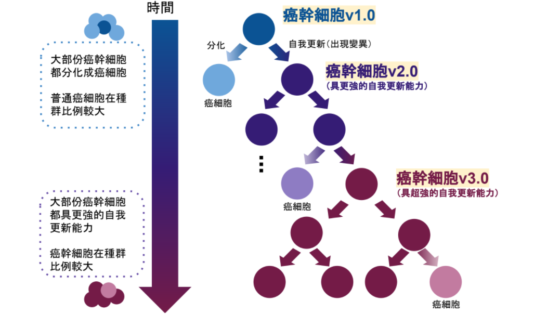
補習班學生具多方面的學習潛能,將來可發展成不同職業專才;同樣地,根據多倫多大學 Kreso 和 Dick 在 2014 年發表的癌幹細胞分化模型 2,癌幹細胞在癌症初期可塑性高,容易分化成更「專精」的癌細胞。癌幹細胞會分化為單純的癌細胞,但也有少數的會因基因突變而發展出更龐大的自我更新潛力,確保癌幹細胞不會滅絕,同時保持分化成癌細胞的能力。
而在某些情況下,隨著時間推移,這些具更強自我更新能力的癌幹細胞會佔種群的大多數,使癌症治療更費勁。
同場加映:DNA 修復與癌細胞
我們在生活上受打擊時要學會排解情緒,那你知道細胞在面對壓力時又會採取甚麼策略嗎?當遭遇壓力、遺傳物質 DNA 受損時,我們的細胞就會作出 DNA 損傷反應(DNA damage response, DDR),召集一組「急救員」蛋白把 DNA 修復,確保細胞可以好好的活下來。如果負責製成這些蛋白的基因突變,出錯的 DNA 就無法修復,甚至不斷累積變異,最後變成可怕的癌細胞。
化療和放射線治療為什麼都失效?癌幹細胞的DNA修復能力
研究顯示,擁有較多癌幹細胞的胰腺癌病人普遍有更壞的病情發展3,可見傳統療法對癌幹細胞的作用不大。
究竟為什麼無情的化療和放射線治療(俗稱電療)均難以消除它們呢?
除了更有效地把藥物排除外,癌幹細胞還可依賴以下兩個機制提升 DNA 修復能力,抵抗治療:
- 處於休眠(quiescent, G0)狀態
- 生產更多具活性的「急救員」蛋白
在 DNA 雙鏈斷裂時,細胞主要利用同源性重組(homologous recombination)或非同源性末端接合(non-homologous end joining, NHEJ)兩種修復方法。
同源性重組修復必須依賴 DNA 拷貝作為藍本,重新製造新的DNA取代壞掉的部份。因為是照著模板做的,這種修復方式能確保不破壞 DNA 序列的完整性,卻只能在已經複製了 DNA、準備分裂的細胞中使用。
另一方面,非同源性末端接合的修復方法不依賴模板,只需要直接把壞的地方取掉,再接合前端和後端就可以了。這種修復方法雖然簡單,卻會破壞序列的完整性。如果 DNA 受的破壞太大,超越了可修復的範圍,細胞就只能仙遊去了~
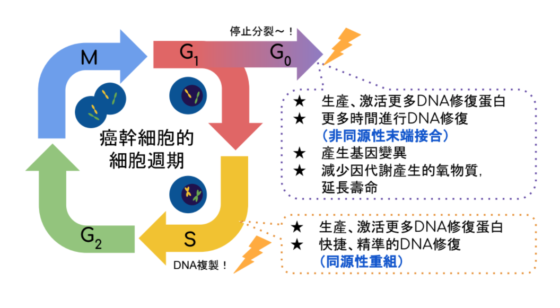
為了延長壽命,有些癌幹細胞長期處於休眠、不分裂的狀態,有更多時間進行 DNA 修復。由於化療大多針對快速分裂的活躍細胞,這些癌幹細胞便可逃過一劫。
而電療的高能量輻射會產生的氧物質,加上細胞本身累積的有毒代謝物,足以有效殺死普通癌細胞。然而,休眠中的癌幹細胞新陳代謝慢,本來積累的代謝物就較少,因此更能抵抗電療的攻擊 4。
即使癌幹細胞對外在壓力有很高的抗性,它們在休眠狀態下無法複製 DNA,只能運用容易出錯的非同源性末端接合修復損傷,有可能引發有利於細胞存活的變異,反而增加癌細胞種群的整體適應力。
那如果癌幹細胞處於準備分裂的狀態,是不是就能跟普通癌細胞一樣被化療藥物殺光光呢?其實也不一定。
比起普通癌細胞,癌幹細胞生產更多「急救員」蛋白,採取更嚴謹的細胞週期檢查點,監控 DNA 損傷。一經發現,ATM-Chk2 和 ATR-Chk1 通路就會被激活,讓細胞運用同源性重組作出快捷而精準的 DNA 損傷反應,逃過死亡的命運 5。
更糟的是,化療有機會誘發普通癌細胞變回癌幹細胞的狀態,形成令頑症更「頑」的惡性循環。
電療跟化療都無效,對付癌幹細胞該怎麼做?
要徹底把癌細胞連根拔起,現時的治療方向是使用 DNA 修復抑制劑。
之前的研究中,研究人員把 Chk1 抑制劑用於腦癌幹細胞後,能有效破壞敵軍領袖的 DNA 急救站,使腫瘤更容易被電離輻射破壞,或可用於降低癌症對電療的抗性 6。
科學家亦開始發展新穎的「分化治療」(differentiation therapy),誘發菁英癌幹細胞分化成容易對付的普通癌細胞,從而加強傳統療法的效用7。
然而,癌幹細胞研究在近十多年才發達起來,我們對其認識仍然非常皮毛。這些細胞具基因差異,可各自演化,而普通癌細胞亦有機會因基因突變或環境改變而重返穩定的癌幹細胞狀態,可見癌細胞群體的組成是極為複雜的。
儘管癌幹細胞的特性眾說紛紜,只要持續研究它們的 DNA 修復機制,並找出其與一般幹細胞和普通癌細胞的相異之處,我們或能在不久的將來發展出更具針對性的治療方案,真正剿滅癌細胞!
小總結:現時的癌症治療無法有效地擊敗癌幹細胞,導致癌細胞再生,癌症復發。有些癌幹細胞處於休眠狀態,又擁有高度的 DNA 修復能力,對傳統療法產生更大抗性,是維持癌細胞種群的罪魁禍首。
- 註1:幹細胞分裂成幹細胞的現象
- 註2:幹細胞發展成具特化功能的細胞的現象
參考資料
- Bao, B., Ahmad, A., Azmi, A. S., Ali, S., & Sarkar, F. H. (2013). Overview of Cancer Stem Cells (CSCs) and Mechanisms of Their Regulation: Implications for Cancer Therapy. Current Protocols in Pharmacology, 61(1), 14.25.1–14.25.14. doi:10.1002/0471141755.ph1425s61
- Kreso, A., & Dick, J. E. (2014). Evolution of the Cancer Stem Cell Model. Cell Stem Cell, 14(3), 275–291. doi:10.1016/j.stem.2014.02.006
- Rasheed, Z. A., Yang, J., Wang, Q., Kowalski, J., Freed, I., Murter, C., … Matsui, W. (2010). Prognostic Significance of Tumorigenic Cells With Mesenchymal Features in Pancreatic Adenocarcinoma. JNCI: Journal of the National Cancer Institute, 102(5), 340–351. doi:10.1093/jnci/djp535
- Schulz, A., Meyer, F., Dubrovska, A., & Borgmann, K. (2019). Cancer Stem Cells and Radioresistance: DNA Repair and Beyond. Cancers, 11(6), 862. doi:10.3390/cancers11060862
- Maugeri-Sacca, M., Bartucci, M., & De Maria, R. (2012). DNA Damage Repair Pathways in Cancer Stem Cells. Molecular Cancer Therapeutics, 11(8), 1627–1636. doi:10.1158/1535-7163.mct-11-1040
- Ahmed, S. U., Carruthers, R., Gilmour, L., Yildirim, S., Watts, C., & Chalmers, A. J. (2015). Selective Inhibition of Parallel DNA Damage Response Pathways Optimizes Radiosensitization of Glioblastoma Stem-like Cells. Cancer Research, 75(20), 4416–4428. doi:10.1158/0008-5472.can-14-3790
- Jin, X., Jin, X., & Kim, H. (2017). Cancer stem cells and differentiation therapy. Tumor Biology, 39(10), 101042831772993. doi:10.1177/1010428317729933





























《運動基因》立體封面72dpi.jpg)