作者:董盈岑 陳俊安
前陣子火紅的冰桶挑戰募款活動,應該讓大家對於「漸凍人」(Amyotrophic lateral sclerosis, 肌萎縮性脊髓側索硬化症)並不陌生。這個好發於成年人的運動神經元退化疾病,病人體內特定的運動神經元會逐漸退化凋亡,特別是控制四肢活動的運動神經元會最先受損。
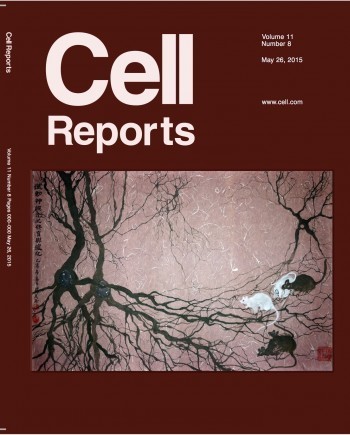
但是因為其制病機制仍然不明,目前除了支持性療法外,尚無有效的治癒或延緩方法。最近,由中研院分生所陳俊安老師的研究團隊發表的論文提出一群稱為mir17~92 的微型核糖核酸(microRNA,miRNA),在運動神經元發育與退化時扮演重要角色。這項研究成果登上 2015年5月26日「細胞報告」(Cell Reports)國際專業期刊,並榮登為當期封面 [1 ]。此項結果將來亦可進一步應用在解開「漸凍人」以及相關運動神經元退化疾病之未知機制。
人類完整轉錄體(transcriptome)裡至少含有超過一半以上的ncRNAs,他們不像大家熟知的信使RNA(mRNA)會被轉錄成有功能性的蛋白質,而是直接以RNA的形式去執行其任務。miRNA的作用機制,是藉由辨認與其序列相對應的標靶mRNA,並與之結合,進而抑制標靶mRNA轉錄成蛋白質。目前在人類已發現700 種以上的miRNA,而一種miRNA會有數十種以上的標靶mRNA,因此對基因調控的影響甚巨。然而 miRNA在胚胎神經系統發育的角色,仍處於混沌不明的狀況。
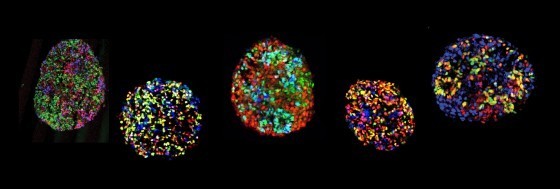
在兩年前,陳俊安老師的研究就發現當小鼠失去產生miRNA酵素Dicer時,控制四肢的運動神經元在發育時期就會大量死亡。為了找出關鍵的miRNA,陳俊安老師與實驗室成員將發育中小鼠的運動神經元分離出來,以次世代RNA定序法與雜交染色法進行miRNA表現的分析,發現這群miRNA在控制四肢的運動神經元中表現量特別高;當他們進一步以遺傳學方法剔除小鼠的mir17~92表現時,控制四肢的運動神經元便會大量死亡 [2 ]。也就是說mir17~92表現量的多寡,對於這群特定運動神經元的生存十分重要。但是為什麼mir17~92能特異性維持這些運動神經元的生存呢?
研究團隊進一步比較正常與失去mir17~92的小鼠運動神經元,發現mir17~92的標靶mRNA–PTEN可能會影響四肢運動神經元的生存。PTEN其實早已在癌症病理學中頗負盛名,因為它的存在可促進癌細胞的死亡; 而近年來的研究更發現,如果讓PTEN跑進癌細胞的細胞核中,則更加速癌細胞的凋亡。但是PTEN 對於神經細胞的影響,目前並不像癌細胞領域有清楚定論 [3 ]。
研究團隊利用幹細胞所衍生的運動神經元與動物實驗同步證實,在控制四肢的運動神經元中,高量的mir17~92會抑制PTEN蛋白質表現的數量,並同時影響其他酵素表現,而阻止PTEN進入細胞核中。如此PTEN不能啟動細胞凋零機制,這些神經細胞就可以快樂地活下去。此外,他們也用小鼠模式驗證,若在運動神經元失去mir17~92時,把PTEN降低回正常的的表現量,那些理應退化的運動神經元便可以活下來。這些證據更加支持mir17~92與PTEN 的調節作用,是影響四肢運動神經元生死存亡的關鍵。
這個複雜的調控機制,其實是神經在發育時為了建立適當網路聯繫所採取的策略。為了確保運動神經元產生之後,能夠正確延伸並聯結到遠端肌肉(特別是遙遠的四肢),過量的運動神經元會先被製造出來。而後這些運動神經細胞經由先天與後天篩選,讓本身具高mir17~92 表現量的運動神經元存活下來後,如此便可往標的肌肉延伸過去;讓最先靠近肌肉的運動神經元接收到肌肉所分泌的生長因子,進而建立強韌之連結。
陳老師研究團隊進一步推測,既然mir17~92和PTEN對於控制四肢運動神經元的存活很重要,是否在漸凍人疾病中,控制四肢的運動神經元因為失去mir17~92的保護而開始退化 。因此他們將來的後續研究,便想進一步探討在「漸凍人」的模式老鼠發病前,運動神經元中的mir17~92是否減少,同時伴隨PTEN在細胞核內累積,造成這些運動神經元的死亡。由於最近有個已進入臨床第三階段試驗的新治療法,將修飾過的小RNA分子打入中樞神經系統中,來延緩另一個神經肌肉疾病–脊髓性肌肉萎縮症(SMA)的發病,頗具療效。未來或許也可將mir17~92的類似物,以同樣方式使其進入運動神經元中,提升其保護作用,延長運動神經元與漸凍人或脊髓性肌肉萎縮症病人的存活。
這些推論仍需許多實驗去透徹驗證,但這篇有趣的論文除了讓我們對神經發育機制有更進一步的了解,也提供了漸凍人制病機制另一層面的探討。這也顯示基礎研究的重要性,或許一開始只是對於生理現象的好奇,但其成果上的突破,亦能幫助臨床疾病應用的發展。
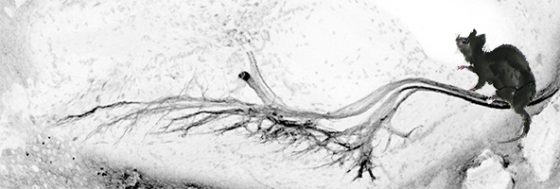
研究團隊成員包括兩位共同第一作者中研院分生所董盈岑博士與助理呂雅琳、學生彭冠智與顏雅萍、助理張綿以及交通大學洪瑞鴻助理教授。最後值得一提的是,陳俊安老師的母親- 蘇美玉女士,以其獨樹一幟的新嶺南派畫風描繪以小鼠為模式動物,研究運動神經元之發育與退化。陳老師母子聯手創作巧妙融合中華藝術之美于現代科學之中,讓這項研究榮登「細胞報告」(Cell Reports) 當期封面,成為杏壇佳話。
參考文獻:
- Tung et al., Mir-1792 Governs Motor Neuron Subtype Survival by Mediating Nuclear PTEN, Cell Reports (2015)
- A. Chen, H. Wichterle, Apoptosis of limb innervating motor neurons and erosion of motor pool identity upon lineage specific dicer inactivation. Frontiers in neuroscience 6, 69 (2012)10.3389/fnins.2012.00069).
- S. Song, L. Salmena, P. P. Pandolfi, The functions and regulation of the PTEN tumour suppressor. Nature reviews. Molecular cell biology 13, 283-296 (2012); published online EpubMay (10.1038/nrm3330).
相關連結: