運動神經元研究
還記得「漸凍人冰桶考驗」嗎?金城武淋下冰水的瀟灑令人難以忘懷,但本文想將你的注意力轉移到漸凍症本身。中研院分子生物研究所的陳俊安助研究員,與團隊從發育生物學的角度,尋找「會退化」和「不會退化」的運動神經元在基因表現上哪裡不同,希望未來有助於漸凍症的精準醫療。
先來進行眼力考驗,下圖野生型小鼠胚胎、 類 ALS (漸凍症)模式小鼠胚胎,看得出「運動神經元」哪裡不同嗎?
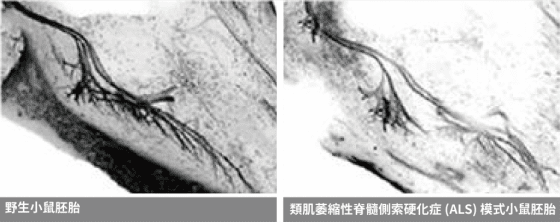
左圖的野生型小鼠,運動神經元軸突健康粗壯,可以牢牢抓住肌肉細胞,並控制四肢作出大腦命令的、或反射性的動作。但右圖的類 ALS 模式小鼠,運動神經下端的樹突變少了,無法牢牢抓住肌肉細胞,四肢也跟著萎縮、不聽使喚。
這個「運動神經元退化」的情況會發生在小鼠身上,也會發生在人類身上。「漸凍症」就是運動神經元退化導致的疾病,會從四肢開始無力,漸漸演進至全身肌肉萎縮、呼吸衰竭。
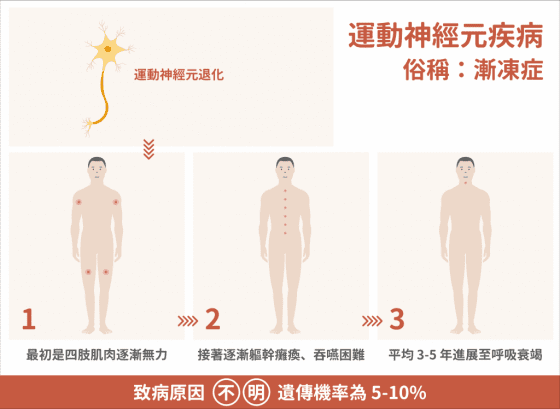
在運動神經元疾病的分類中,脊髓性肌肉萎縮症(SMA) 是遺傳性疾病,好發於嬰孩時期,致病機轉是因為爸爸媽媽同時帶了一套有缺陷的 SMN1 基因。當 SMN1 基因有缺陷時會讓運動神經元死亡,通常小朋友六個月大應該可以坐起來,但有些嬰兒的父母卻發現小寶貝沒辦法坐起時,檢查後才知道原來是脊髓性肌肉萎縮症(SMA)。
而其他的運動神經元疾病,包含肌萎縮性脊髓側索硬化症(ALS) 等,雖然也是由於運動神經元退化死亡,但尚有九成病人發病的原因是不清楚的。
為什麼運動神經元會退化?為何從四肢開始?為何有些肌肉不受影響?科學家尚在理解中。
什麼使運動神經元退化?
在《愛的萬物論》電影中,主角霍金博士從四肢開始退化,初期是手部肌肉拿不穩茶杯,漸漸雙腿肌肉無力、跌倒。但泌尿生殖系統較不受影響,生下了可愛的孩子們,他對朋友笑說是「另一個全自動的系統」。直到最後,霍金博士控制眼球的肌肉仍能正常運作,讓他可以用眼球操控鍵盤說話、書寫。

中研院分子生物所的陳俊安團隊專精於發育生物學,閱讀運動神經元疾病的文獻、和醫生討論,發現脊髓運動神經元在發育時都是從同樣的前驅細胞分化而來,但「四肢」的運動神經元會先發病,而控制眼球和泌尿生殖系統的運動神經元仍能正常運作。
「是否不同的運動神經元亞型(subtype) ,會有不同基因表現的差異,導致這種發病程度的不等?」陳俊安團隊從這裡開始思考,並將小鼠胚胎幹細胞(ES cell)分化成各式的運動神經元亞型,再將各種亞型進行次世代定序,檢查基因表現哪裡不同。
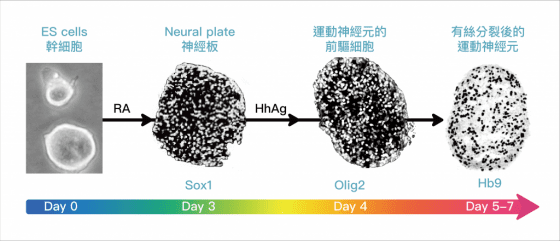
若以前讀的生物課已忘得差不多,沒關係,本文從你我體內的 DNA、RNA 、蛋白質追本溯源,其中藏著可能影響運動神經元退化的開關:mir-17~92 和 PTEN 。
mir-17~92:阻止控制四肢的運動神經細胞凋零
生物體內的細胞核中,DNA 就像影印機中的正本,會複印出帶有相同基因訊息的 RNA 。 RNA 有兩種: 一種是負責製造蛋白質的 mRNA(messenger RNA),就像要把基因訊息傳給蛋白質的傳訊官;另一種是 ncRNA(non-coding RNA),不負責製造蛋白質,而是直接以 RNA 的身分來執行任務。
有一些 ncRNA 會待在細胞核裡,像是後勤單位補給前線作戰資源。另外有一些 ncRNA 像是 microRNA 會直接出核,就像親身到前線出任務的軍官。
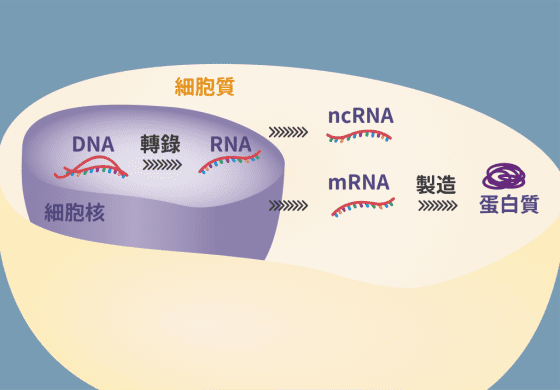
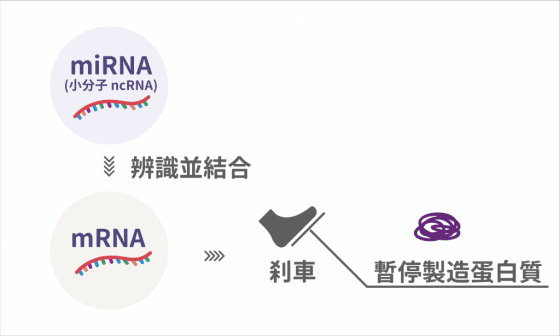
直接到前線出任務的 ncRNA 要做些什麼? 可忙著呢!其中一種是幫忙「踩剎車」,控制 mRNA 製造蛋白質的速度和數量。負責這個任務的是一種小分子的 ncRNA,亦即 microRNA ,會藉由辨認基因序列相對應的標靶 mRNA ,並與之結合,進而抑制標靶 mRNA 製造蛋白質。
在各種運動神經元亞型中,陳俊安團隊透過次世代定序和生化分析,發現「四肢運動神經元」中,有一群叫做 mir-17~92 的 microRNA 表現量特別高 ,且會抑制一種叫做 PTEN 的蛋白質、影響調控其進入細胞核的相關酵素表現,阻止 PTEN 進入運動神經元的細胞核中、造成運動神經元的細胞凋零。
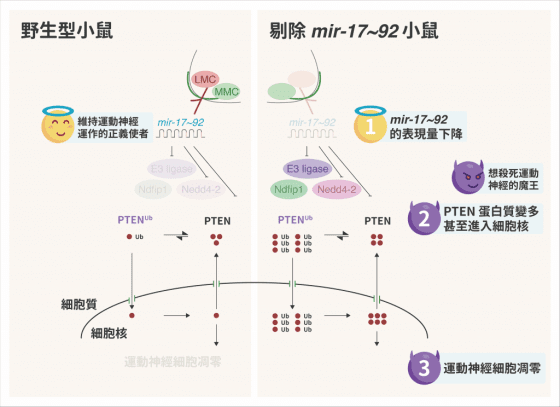
陳俊安團隊透過基因剃除小鼠進一步了解,發現若運動神經元中 mir-17~92 被剃除,這隻小鼠會變得很小隻、四肢萎縮不太能動,切片檢查看到控制手和腳的運動神經元幾乎都死掉,但控制肋骨、頭部、臉部的運動神經元都沒問題。仔細一看,這隻 mir-17~92 基因剃除小鼠四肢無法活動的狀況,和漸凍人有點類似——漸凍人也是四肢協調發生問題。
我們發現被剃除 mir-17~92 的小鼠和漸凍人相似,因此推論 mir-17~92 對於控制四肢運動神經元可能很重要,並思考其作為治療漸凍症的契機。
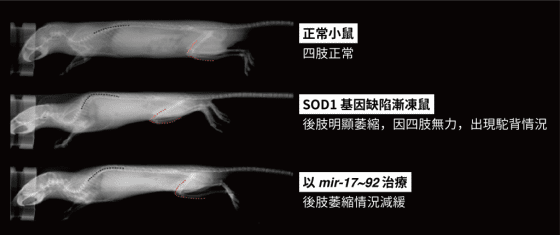
為了驗證推論,陳俊安團隊另外將 SOD1 基因缺陷漸凍鼠(漸凍症之一種模式小鼠)體內的 mir-17~92 表現量提高、做為治療的方式,發現其原本無力的四肢恢復得較為正常,且小鼠壽命也延長了 20 多天 。「 20 多天的壽命對 ALS 模式小鼠而言可能不算太長,大約是 1/6 ,但對漸凍人而言,延長 1/6 的壽命就是多了 將近 10 年」陳俊安說明。
mir-17~92:四肢運動神經的「電池」
陳俊安將人體比喻為台灣地圖,運動神經元像是從台北(脊髓中樞)出發、貫穿台灣(人體)的高速公路,各部位肌肉是各種運動神經元的終點站。臉部和舌頭比較近,像是台北到桃園的距離;腿部肌肉最遠,像是台北到墾丁的距離。
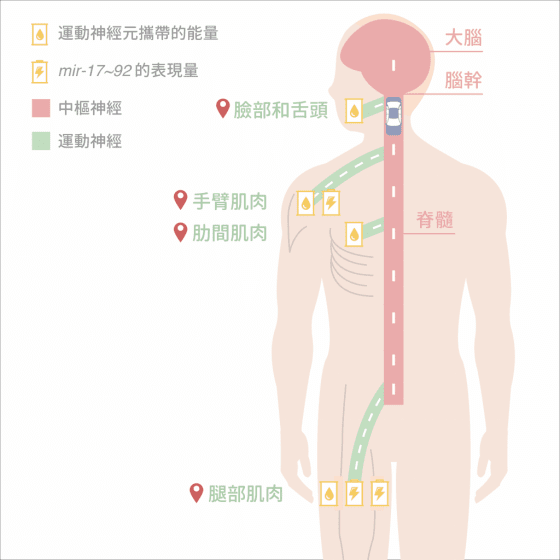
一開始從脊髓出發,各種運動神經元所帶的能量都相同,就像每台車都加了容量相同的油箱,到了終點站肌肉會釋放另一種蛋白質給運動神經元,補充神經元的能量讓神經元不會力竭而亡。但運動神經元軸突在前往肌肉的途中就是靠這桶油,若到不了肌肉終點站,運動神經元就會死掉。
以這桶油量從台北跑到台中沒問題,但跑到墾丁太過勉強,可行的方式是換成「油電混合車」。而 mir-17~92 就像四肢運動神經元的「電池」,幫助抑制 PTEN 蛋白質的表現量,阻止 PTEN 讓運動神經元凋零,幫助四肢運動神經元順利延伸到遠遠的手臂和腿部,控制四肢肌肉正常運作。
油電混合車很經濟實惠,但最怕「電池」壞掉!漸凍症發生的機制,可能是 mir-17~92這群四肢運動神經元的「電池」不夠力,最終導致無法順利控制四肢肌肉。
運動神經元疾病(漸凍症)的致病原因,至今仍然不明朗,也缺乏治療藥物。陳俊安團隊將繼續透過漸凍症病人的 iPSC(誘導性多功能幹細胞)培養運動神經元,驗證目前的推論是否可行,並深入了解運動神經元發育與退化的分子機制。
若要使 mir-17~92 的類似物進入運動神經元,提升其保護作用,已知的瓶頸是 microRNA 並非可以服用的小分子,需要從中樞神經系統進行基因治療。另外,現階段雖能透過漸凍症病人的 iPSC (誘導性多功能幹細胞)培養運動神經元,但陳俊安團隊仍在尋找該用什麼樣的機制來模擬漸凍症的發病過程,再看看用什麼方式減緩運動神經細胞退化。
為了持續前進下一步,陳俊安團隊期待能和台灣的醫院合作,以及借力基礎化學、生物化學、生物醫學等領域的專業團隊,一起討論努力的方向。
希望未來能為精準醫療提供更好的依據,了解不同運動神經元的亞型哪裡出了問題,並特別調整該運動神經元的基因表現。

延伸閱讀
- 從實驗室到馬拉松賽場:運動神經元研究職人──陳俊安
- 陳俊安的實驗室網頁
- 小小RNA立大功 – Mir17~92 扮演維持運動神經元之存活關鍵,作者:董盈岑、陳俊安
- Tung Y-T, Lu Y-L, Peng K-C, Yen Y-P, Chang M, Li J, Jung HK, Thamas S, Huang Y-P, Hung J-J, Chen J-A* (2015) Mir-17~92 Governs Motor Neuron Subtype Survival by Mediating Nuclear PTEN. Cell Reports (Cover featured article).
- 漸凍人特性分析 – 漸凍人協會
- 轉錄(遺傳學),作者:陳偉民、葉名倉
- 執行編輯|林婷嫻
- 美術編輯|張語辰
本著作由研之有物製作,以創用CC 姓名標示–非商業性–禁止改作 4.0 國際 授權條款釋出。
本文轉載自中央研究院研之有物,泛科學為宣傳推廣執行單位




































《運動基因》立體封面72dpi.jpg)