- 本文由旻諭、馨香共同寫作
每年《Science》的編輯和記者們都會選出「年度十大科學突破」,再讓大夥們一起投票選出當年度最最最重大的科學研究。當然,今年也不例外!廢話不多說,就讓我們直接從最受歡迎的票選冠軍談起吧!
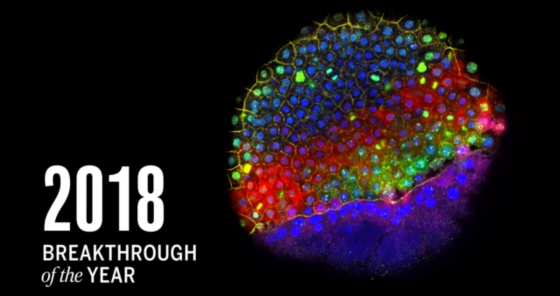
關鍵技術「三部曲」:追蹤受精卵裡的每、一、個細胞
你是否曾經疑惑過:人體的器官明明都是從同一顆受精卵不斷分裂而來,為甚麼卻可以長出心臟、肺臟、頭腦、手腳等等不同的器官跟組織?
其實這個問題也困擾生物學家很久了,從古希臘時代的醫生希波克拉底開始,生物學家一直很想了解:人類如何從單一細胞,發育成一個具有不同器官和數十億細胞的個體?
現在,出現了新的技術,讓我們很可能即將解開這個秘密!只要透過結合三個關鍵技術(合稱為 Single-cell RNA-seq),就能以「單一細胞」的超細微尺度,來追蹤每個細胞如何分化。這個技術組合可以大大促進基礎研究和藥物研究的發展,因此榮登 2018 年度最重大的科學突破!
如何進行呢?
- 從活體中分離出上千個完整細胞
- 為每一個細胞進行基因定序,得到每個細胞的基因表達情形
- 以電腦模擬或標籤 (labeling) 細胞的方式,重建細胞之間的時間與空間關係
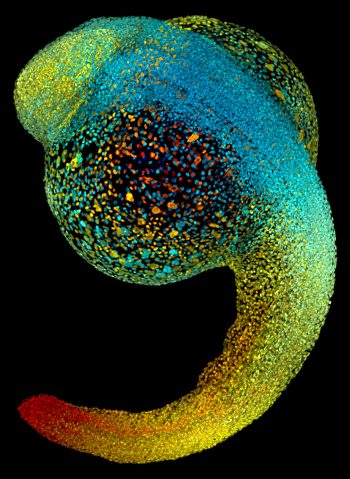
從上千個細胞的基因定序結果,研究人員可以一窺個別細胞在特定時間點有製造哪些 RNA ,對應到細胞的最終分化型態,藉以了解對某種細胞而言,哪些基因表現是重要的。如此一來,我們可以便能了解器官與組織的發育過程,也能研究畸形或是特定疾病的發生,究竟是在發育過程的哪一步出了差錯。
來自遙遠星系的好消息:成功定位微中子
電磁波、重力波等訊號,就像是由遠~方捎來消息的信使,讓科學家得以理解億萬光年外的宇宙發生了什麼事。在今年,科學家首度成功定位出高能微中子的來源,讓微中子也加入了信使的行列。
位於南極冰川底下深約 1.5-2.5 公里處的「冰立方」(IceCube),是由 5160 個光感測器組成的微中子觀測站,總體積大約有一立方公里。2017 年 9 月,冰立方偵測到一顆撞擊冰分子的高能微中子,透過分析反推出微中子的入射方向,並即時向全球天文台發出通告。數天後,NASA 的費米伽瑪射線太空望遠鏡團隊指出,他們日前觀測到一顆正處於活耀期的耀變體 (blazar),其方位和冰立方指出的高能微中子來源是相符的。
今年 7 月,數千位研究者共同發表了正式報告,確定此高能微中子就是來自這一顆距離地球 57 億光年遠、正在發出強光的耀變體。耀變體會製造伽瑪射線和微中子,也很有可能噴射如質子、氦原子核等其他高能粒子,這表示,每天轟炸地球的宇宙射線有可能就是來自那裡。

- 延伸閱讀 1:【百秒說科學】 微中子系列第零集 – 微中子到底系蝦咪?
- 延伸閱讀 2:以南極冰層偵測宇宙訊號:「冰立方」讓高能微中子天文學曙光乍現
以電子束掃描,快速鑑定分子結構
以前,想要確認有機化合物分子結構,可能要花上個好幾天、好幾週,甚至好幾個月。不過,就在今年 10 月,剛好有兩個研究團隊同時發表論文,這個新的掃描方法只要花短短幾分鐘就能確定小型有機化合物分子結構!
過去幾十年來,科學家們都是用「X 射線晶體學」的方法來確認分子的結構:將一個個分子排排站形成一個 3D 晶體結構之後,以各種角度發射 X 射線,再從 X 射線繞射的結果來推估電子密度分布,最後依這個電子密度分布解讀判定分子結構。
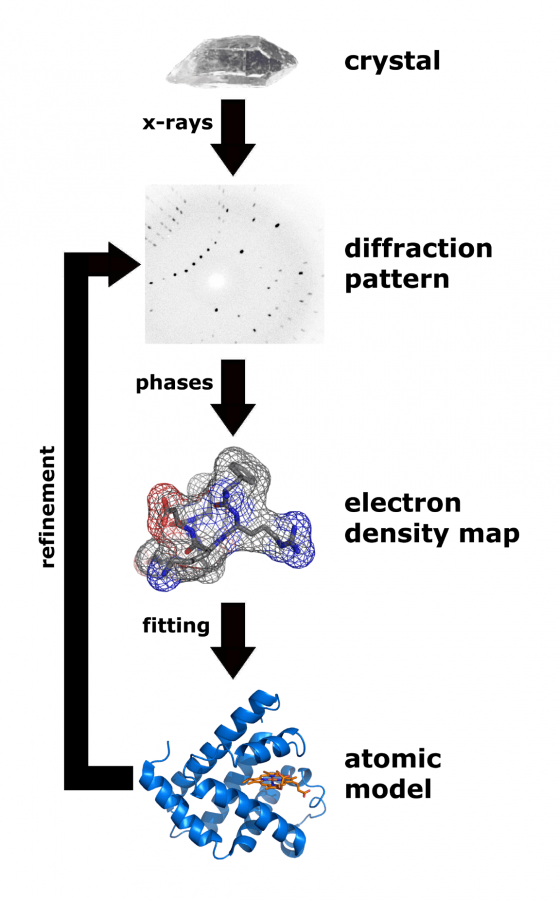
但要讓目標的物質(通常是蛋白質)形成足夠大的晶體並不是那麼容易的事,因此往往成為確認晶體結構最大的門檻。新方法以「電子束」取代 前述方法中的「X 射線」,對著 3D 結構的晶體發射電子束,追蹤每一個微小角度變化的電子束繞射結果,就能在幾分鐘內推敲出分子結構。而更重要的則是,這個新方法所需的晶體大小僅需舊方法的十億分之一!
- 編按:原版誤植所須晶體大小比例,2017/12/31修正。
能夠確認分子結構,可以幫助科學家更了解該分子的特性,這對新藥合成、分子探針設計和疾病追蹤等都有很深遠的影響。
發現格陵蘭冰川下的巨大火山坑
今年十一月,科學家透過飛機雷達發現,在一萬三千年前,有顆小行星砸在格陵蘭島西北部的海華沙冰川 (Hiawatha Glacier) ,不僅立刻蒸發了岩石,還在北極上空發出衝擊波,產生一個寬 31 公里的隕石坑(幾乎跟臺北市一樣大)。
海華沙隕石坑 (Hiawatha crater) 長年深埋在一公里厚的冰川之下,是地球上最大的 25 個隕石坑之一。雖然這次隕石撞擊地球的影響程度,沒有 6600 萬年前造成恐龍滅絕那次來得可怕,但海華沙隕石坑的形成可能對全球氣候產生巨大影響:當小行星撞擊海華沙冰川,其產生的衝擊導致融水湧入北大西洋,可能阻礙了通往歐洲西北部的暖流,使得溫度驟降。這項發現或許可以解釋具爭議性的新仙女木事件 (Younger Dryas)。
#MeToo STEM 運動發燒!拒絕科學界性騷擾
「我們必須改變這個繼續允許性騷擾的文化和環境。」──美國國家醫學院主席 Victor Dzau @華盛頓「預防性騷擾工作坊」(2018.11)
一直以來,科學界的性騷擾一直被低估、忽視。不過在今年六月,美國國家科學院、工程和醫學院發布了一份關於科學、工程學和醫學領域女性遭性騷擾的關鍵報告。報告指出,超過 50% 的女教職員工以及 20%-50% 的學生皆曾遭受性騷擾,其中最常見的形式包含語言及非語言的性別歧視。
今年,幾個機構開始採取行動,如美國科學促進會 (AAAS) 在九月通過了一項相關政策,說明美國科學促進會研究員一旦被確認是性騷擾者,將遭到終生剝奪名譽。美國國家學院主席也在五月承諾研究人員若被確定為性騷擾者,將從榮譽排行榜中被剔除。
幾位評論家認為改變的速度可能還不夠快。美國田納西州范德比大學的神經科學家 BethAnn McLaughlin 在今年成立倡導組織 #metooSTEM,她特別提到美國衛生研究院 (NIH) 並沒有通過任何防治性騷擾的政策或採取任何相關行動。McLaughlin 以 46 秒的沉默作為公開談話的開場,她說:「每一秒代表美國衛生研究院提供資金、卻不過問研究員是否違反性擾法規的每一年。」(1 second for every year that NIH has given money to scientists and doctors and not asked if they have violated Title IX)
- 註:Title IX 第九條是 1972 年美國禁止對學生進行性騷擾的法規。

- 延伸閱讀 1:如果妳收到網路騷擾,怎麼反應?她的做法是為女科學家新增維基百科條目
- 延伸閱讀 2:【論文故事】別讓科研野外考察變成性騷擾高發區
發現擁有尼安德塔媽媽、丹尼索瓦爸爸的混血中二少女
2012 年,研究人員在西伯利亞的一個洞穴中找到一塊來自五萬多年前女性的骨頭碎片,並從 DNA 的比對結果發現,她居然是尼安德塔媽媽與丹尼索瓦爸爸愛的結晶!這件出土的化石被命名為「Denisova 11」,長度 2.47 公分,且從皮質骨密度推估她去世時至少已有 13 歲(因此叫她中二少女應該不過份(笑)。
這塊骨頭的基因定序結果,顯示其 X 染色體片段數目與體染色體一樣多,表示她是女生。(不論男女,一對體染色體都是兩條,而性染色體女性有兩條 X,男性只有一條 X。)且她的粒線體 DNA,也就是完全遺傳於母親的 DNA 是尼安德塔型,因此可以確定母親為尼安德塔人,爸爸為丹尼索瓦人。如果細看她的基因體,可以發現她爸其實本來就混了一些尼安德塔血統。
在這之前,研究人員知道尼安德特人、丹尼索瓦人和現代人類,偶爾會在冰河時代的歐洲和亞洲進行雜交,卻未曾確切發現過他們的後代。
這次的發現還帶來了另一個驚人的研究結果:尼媽的血緣比較接近克羅埃西亞的人類,而和同在丹尼索瓦洞穴的同類血緣比較疏遠,代表尼媽這群尼安德塔人時常遷徙於歐洲和西伯利亞兩地之間。這項研究成果可說是提供更多人類的演化史線索!

偵破懸案新星:「鑑識系譜學」時代來臨
今年四月,美國警方宣布他們成功破解了史上最撲朔迷離的懸案──金州殺人案 (Golden State Killer) ,逮捕了其中一位嫌疑人。
- 註:金州殺人案是 1970 到 1980 年代在加州的一系列強姦與謀殺案。
警方利用從犯罪現場蒐集到的 DNA 樣本,比對公共家譜 DNA 資料庫 (public genealogy DNA database),進而鎖定嫌疑人的家屬。執法單位已經利用「鑑識系譜學 (Forensic genealogy)」成功偵破其他 20 件懸案,讓鑑識系譜學成為當代功不可沒的鑑識界新星。
在金州殺人案中,當局使用一個叫「GEDMatch」的公共線上 DNA 資料庫。GEDMatch 資料庫是由兩位德克薩斯州和弗羅里達州的業餘系譜學家負責經營,每個人都可以提交自己的 DNA 定序結果到這個資料庫中。調查人員把從犯罪現場蒐集到的 DNA 樣本資訊,上傳到 GEDMatch 資料庫之後,便可找到嫌疑犯的遠房親戚,進而確定嫌疑犯身分。
藥品新招!RNAi 藥物在歐美獲准上市
核糖核酸干擾 (RNA interference, RNAi) 是一種可以讓基因沉默(或者說把某個基因「關掉」) 的技術。理論上透過這個技術,我們可以用 RNA 分子「關掉壞基因」、讓疾病不會發生。RNAi 這項技術早在 20 多年前就已經發明,但因為 RNA 分子實在太脆弱,很難讓 RNA 分子在抵達正確的組織前不受破壞,因此這項技術一直都無法實際應用於藥物設計。
直到 2008 年,這項難題終於有解方!美國麻薩諸塞州劍橋市的 Alnylam Pharmaceuticals 公司提出解套方法:利用一種「脂質奈米顆粒」來保護基因沉默 RNA (gene-silencing RNA),確保這段 RNA 可以成功被送達目的地。
Alnylam 設計出的 RNAi 藥物「Onpattro」可用來治療遺傳性轉甲狀腺素介導的類澱粉變性 (hereditary transthyretin-mediated amyloidosis, hATTR) 所引起的多發性神經病變 (polyneuropathy)。當「Onpattro」和脂質奈米顆粒結合,並運送至肝臟之後,可以阻止摺疊錯誤的蛋白質產生,也就能避免因為蛋白持累積形成的心臟與神經損傷。
RNAi 藥物「Onpattro」在今年 8 月通過美國食品和藥物管理局 (FDA) 和歐洲藥品管理局的批准,並以每年 45 萬美元的定價進入市場。
- 延伸閱讀 1:小小的 MiRNA 如何調控基因表現?
- 延伸閱讀 2:全球第一! RNAi 藥物獲 FDA 核准
從分子痕跡一窺五億年前的世界:世上最早的動物在這裡!
今年科學家偵測到了來自超過五億年前生物的分子痕跡,讓人們對於地球早期的動物有更進一步的了解。
九月,位於坎培拉的澳洲國立大學研究團隊試圖從一些特殊的古老化石上找尋有機分子。這些來自俄羅斯白海懸崖邊的化石,沒有經過高溫高壓,且上面有一層看起來由有機物質構成薄膜。研究團隊猜想或許能找到未被摧殘的有機分子,因此他們取下化石上的薄膜、溶解它,並以氣相層析法和質譜法分析。研究結果發現,他們在埃迪卡拉紀(據今 5.42 億至 6.35 億年前)的狄更遜水母 (Dickinsonia) 化石中找到類膽固醇的分子,由於類膽固醇分子是動物的象徵,代表某些埃迪卡拉紀生物很可能是地球上最早的動物之一。

而在今年十月,另一個研究團隊從距今 6.6 億到6.35億年前的岩層裡,發現一種只有海綿動物會製造的分子。這代表「海綿」這種型態的動物,可能比目前已知最古老的化石還早出現了一億年。
維持細胞運作的秘訣:形成「液滴」
細胞內的眾多蛋白質、RNA 是如何在茫茫大海中找到彼此,在正確的時間與地點行使功能呢?近年來,科學家逐漸理解到,答案在於這些物質形成的「液滴」(liquid droplets) 結構。
自 2009 年開始,研究者發現很多蛋白質可以分離、聚集形成一顆顆液滴。此現象類似於「液-液相分離」(liquid-liquid phase separation),如同水和油是分離的,在水中的兩顆油滴碰在一起時,可自然融合為一。愈來愈多證據顯示,細胞內蛋白質、RNA 構成的液滴是生化反應的關鍵,組織了維持細胞運作的工作秩序。
2017 年有研究發現,細胞核中有液滴會幫助染色質濃縮,使位於該區域的基因無法表現。今年,有三篇刊登於《科學》期刊的論文指出,促進 DNA 轉錄為 RNA 的蛋白質,會聚集成液滴附著在 DNA 上。雖然運作的細節還有待繼續研究,然而 DNA 轉錄為 RNA 是製造新蛋白質的第一步,這些研究透露了液相分離在「如何選擇性地表達基因」這個生命的重要謎團扮演一定的角色。
- 如果想了解更多,歡迎參閱《Science》精心製作的影片
參考資料:
- 2018 BREAKTHROUGH OF THE YEAR Science, 2018.12.20
- The #MeToo movement shook up workplace policies in science
- Hyman Lab : phase separation