現今肆虐全球的 Covid-19 變異株——Omicron,是原始病毒株的 R0 值 2.5 的 4 倍;也就是說,當病毒進入無抵抗力的族群中,1 人感染後,接著能傳染給 10 個人!
而時下最關心的不外乎就是:我們打的疫苗是否已經無效?還是說,感染後多為輕症的Omicron,有沒有可能已經流感化了?
為什麼 COVID-19 不斷突變?
想必你對這傳染力如此驚人的 Omicron 一定有很多疑問,它究竟從何而來?又為什麼病毒會不斷變異?——這得要從 SARS-CoV-2 說起。
我們回顧一下:2019年底,一種新型冠狀病毒現蹤並且快速席捲全球,世界衛生組織將其命名為 SARS-CoV-2。
SARS-CoV-2 是一種以 RNA 作為遺傳物質的病毒,RNA 的結構較雙股螺旋且立體的 DNA 來得不穩定,因其本身只有單鏈容易被分解,在複製的過程中頻繁出錯,重重錯誤累積下來就形成了突變,進而影響病毒特性,這也是為什麼變異後的病毒傳播力增加、致死率降低(或提高),甚至突破疫苗的防護。而能適應環境的變異株便會留下來,越傳越廣。
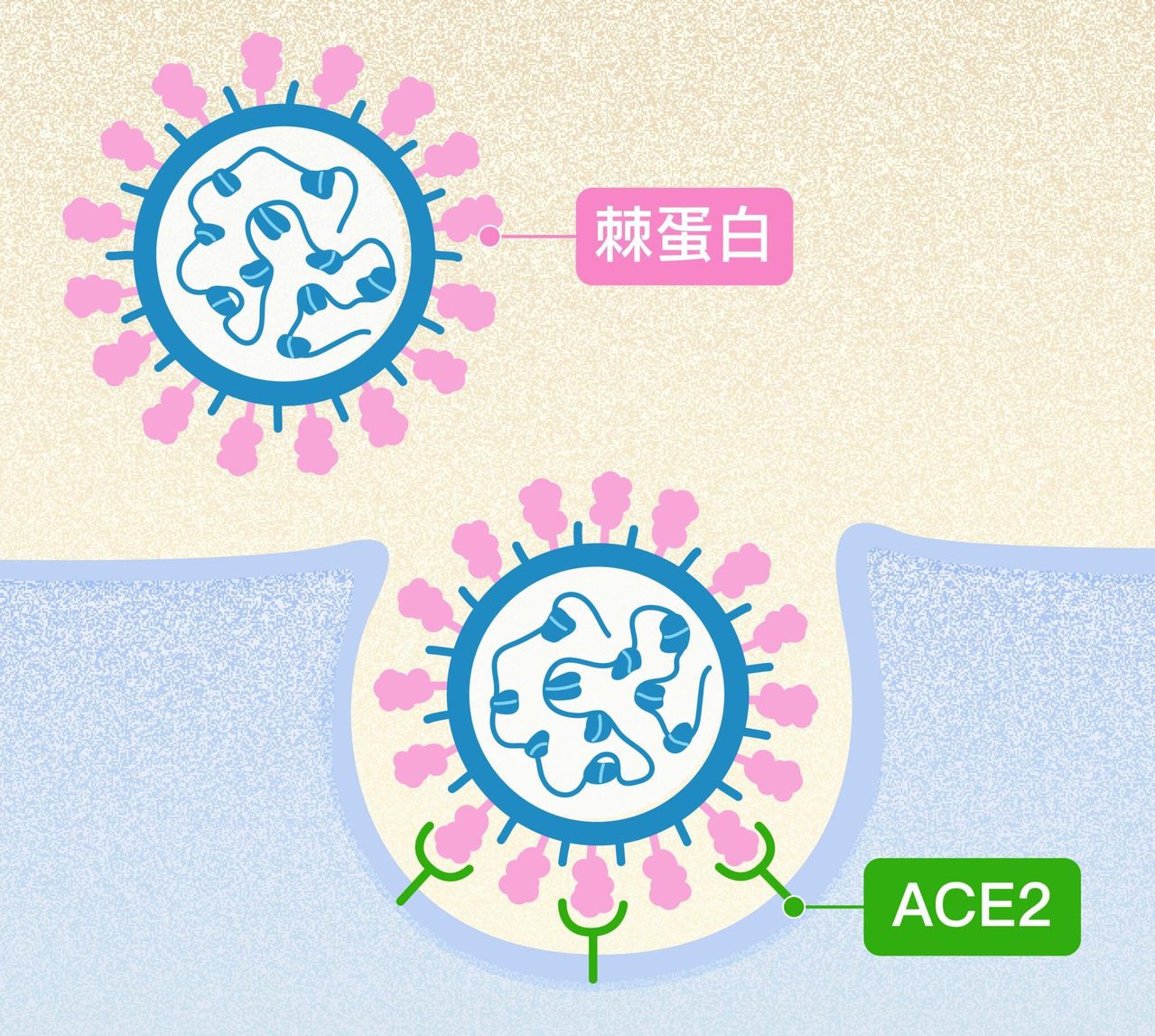
除此之外, SARS-CoV-2 亦為冠狀病毒,其上的棘蛋白結構也會因突變而有所變化,能對應結合人體細胞表面的抗原 ACE2,親和力一旦提升,病毒就能加速進入人體,複製出更多病毒,傳染力因此增強。
在這邊我們可以先提出疑問:變異越多,就代表威力更強嗎?
COVID-19 目前的 5 種變異株
目前我們常聽到的 5 大變異株,分別為 Alpha、Beta、Gamma、Delta 和 Omicron。
以下逐一簡單介紹:
- Alpha 變異株(B.1.1.7)為最早出現,由於其棘蛋白發生變異,使得 Alpha 更容易與人體結合,傳播率較最原始 COVID-19 病毒株高出 60% 以上。
- Alpha 現蹤的同時,南非出現了 Beta 變異株(B.1.351)。比原始病毒株高出 50% 左右,稍低於 Alpha。關鍵的是,Beta 的部分變異點證實會降低疫苗保護力。
- 巴西出現 Gamma 變異株(P.1)後,初期當地曾爆發大流行,科學家原以為群體免疫了,沒想到竟再次引爆,造成超過 35 萬人死亡。
- 2021年最流行的變異株 Delta(B.1.617.2),其 R0 值高達 7。相較於其他變異株,Delta 的重症率較高、痊癒較緩慢,也更容易感染兒童和年輕族群。
- 2021 下半年,Omicron 變異株(B.1.1.529)橫空殺出,首次在波札那被發現,台灣則在 12 月時出現了首例境外移入個案。Omicron 的突變位點共有 37 個,其中 15 個集中在棘蛋白結構上的受體結合區域,也是病毒與人類細胞 ACE2 受體結合區域。
由此可以發現,變異越多,特性亦有所不同,並不能肯定地說它越來越無害或是變得更嚴重,也許是傳染力稍低但重症率高,亦可能反之。
那 Omicron 呢?
Omicron 的高傳染力和較弱的毒性
年初兩份刊登在《自然》期刊上的研究證實, Omicron 變異株的毒性較弱。
關於冠狀病毒進入人體細胞的步驟,當冠狀病毒利用表面棘蛋白上的受體結合域(receiptor-binding domain)與人體細胞的 ACE2 受體結合後,其中一個路徑是利用人體細胞 TMPRSS2 蛋白酶切斷棘蛋白,藉此徹底進入,進而感染細胞。研究發現 Omicron 變異株不太知道怎麼利用 TMPRSS2 蛋白酶切斷棘蛋白,因此弱化了感染人體以及自我複製的能力。
另一份研究則指出,Omicron 進入肺部引起重症的機率相對較低,病毒主要停留在上呼吸道,所以症狀也類似急性上呼吸道感染,俗稱感冒。

值得注意的是,也因為症狀輕微不易察覺,病毒更容易傳播出去,短時間造成內更多病例。根據刺絡針醫學期刊(Lancet Respiratory Medicine)上的研究指出,Omicron 的 R0 值為 10,是目前傳播力最強的變異株。
此次臺灣所爆發的大規模本土疫情,主要病毒株就是 Omicron 的亞型「BA.2」;雖然單日確診數破千,但超過 99% 都是無症狀和輕症。
追加施打疫苗究竟能不能擋下 Omicron ?
上述提到 Omicron「亞型」BA.2,何謂亞型?其實就是變異株的變異株。
Omicron 目前擁有 5 種亞型,包括 BA.1、BA.2、BA.3、BA.4 和 BA.5。其中在台灣所流行的 BA.2,其傳播率較 BA.1 提高了 40%,不過目前沒有證據顯示病毒的危害變得更嚴重。
但這並不代表我們不需要疫苗的保護力!
根據《刺胳針》關於 Omicron 的研究結果顯示:與「未施打疫苗」相比,「有追加施打 mRNA 疫苗」的人,其住院的風險下降約 78%。
從病毒演化方式看 Omicron 流感化的可能性
Omicron 的重症率變低、傳染力更強,是不是就代表未來 COVID-19 會變得像流感一樣呢?事情當然沒有這麼簡單!
我們從病毒演化的系統動力學來看,若是類似流感病毒的演化模式,應該會呈現階梯狀(如圖),每隔一段時間,就會有一個新的變異,而其他的分支則會滅絕;相對每一次迭代,可以有一定的預測性。

在去年 Delta 盛行時,多半的專家都推測下一個變異株應會以階梯式演化,然而 Omicron 的出現卻並非如此,而是像輻射狀演化出來。像這樣下一個大變異不是來自上一個,此類型的演化樹呈平衡輻射狀,其最明顯的特徵為容易發生「免疫逃逸」——新的變異會降低免疫系統識別的能力,這就是為什麼 Omicron 仍能感染已經注射疫苗的人。
此外,Omicron 絶對不是最後一個變異株。相反地,從全球感染趨勢看來,由於感染人數仍持續上升,目前是更多變異株出現的最佳時機,病毒也將無可避免地持續變異。至於變得更弱還是更強,還沒有研究能夠預期這結果。
COVID-19 可能真正流感化嗎?
也許你會想問,還需要多久才能確認 COVID-19 是否真正流感化?
面對 COVID-19,我們雖然知道了很多事情,但還有太多的未知。疫情雖然已經蔓延兩年多,但這也代表我們對它的認識僅有兩年多。COVID-19 在未來會不會真的像流感一樣,我們仍無法知道,仍需要更長時間的觀察。
而我們肯定知道的是,目前追加疫苗對於變異株仍有一定保護力,並且降低住院以及重症機率。儘管 Omicron 多數為輕症,仍要盡快打疫苗來保護好自己和他人。
結語
COVID-19 疫情肆虐至今,過去防疫有成的台灣正式進入一個新階段,充滿未知變數,周圍鄰近國家如韓國、香港、中國等也為防疫提供了不少教訓與資訊。
此刻最關鍵的行動是:用更強制且快速的手段提高疫苗覆蓋率,保護高風險族群,並隨時準備升級疫情警戒。畢竟 Omicron 不是疫情結束,反而更有機會誕生更強病毒株。
參考資料
- 進擊的病毒:變異如何影響疫情?疫苗效力會因此減弱嗎?
- 為何新冠病毒突變之後傳染力更強?——關鍵在於變異株的棘蛋白結構
- 新冠病毒突變逃脫秀
- omicron – 台灣科技媒體中心 (smctw.tw)
- 嚴重特殊傳染性肺炎臺灣疫情
- COVID-19病毒變身全解析
- Omicron 變異株來歷假說:長期感染?悄悄演化?跨物種回傳?
- Delta印度變種病毒傳播力更強?打疫苗會促進變異株產生?新冠變種病毒七問
- Omicron variant and booster COVID-19 vaccines – The Lancet Respiratory Medicine
- 「細胞與動物實驗發現Omicron致病力較低」專家意見
- 「Omicron變種病毒亞型BA.2」專家意見
- 「刺胳針研究:英國Omicron和Delta的住院、死亡風險比較」解析 – 台灣科技媒體中心 (smctw.tw)
- Facebook聊聊XE,和真正的流感化. 來聊聊XE | by 姜冠宇醫師整合手記 | Apr, 2022 | Medium
- Viral phylodynamics