儘管 COVID-19 疫苗已被發明,但出貨嚴重不足的現實,讓「混打不同廠牌疫苗」是否可行,成了許多人的疑問。為了回應這個關鍵需求,歐洲已於去年底試驗混打疫苗,成果如何呢?

相較於兩劑疫苗都相同廠牌,混打 AZ 和輝瑞疫苗,似乎能引發更高的免疫力,對於變異株,也有更強的抵抗力。
混打 AZ 和輝瑞疫苗,誘發的免疫力似乎更好
AZ 混打 BNT疫苗
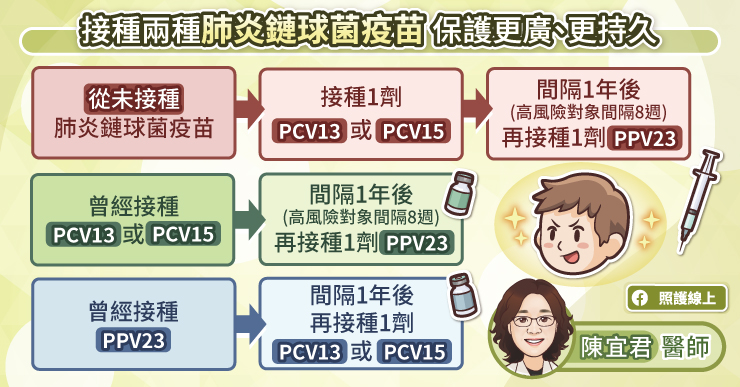
位於德國柏林的夏里特醫院(Charité – Universitätsmedizin)招募了 340 名醫護(約 20~40 歲之間),接受混打實驗。比較施打兩劑皆同品牌的「輝瑞-BNT疫苗」(間隔 21 天);以及施行混打,首劑 「AZ 疫苗(牛津疫苗)」、第二劑「輝瑞-BNT」(間隔 71 天)的人體試驗 [1]。
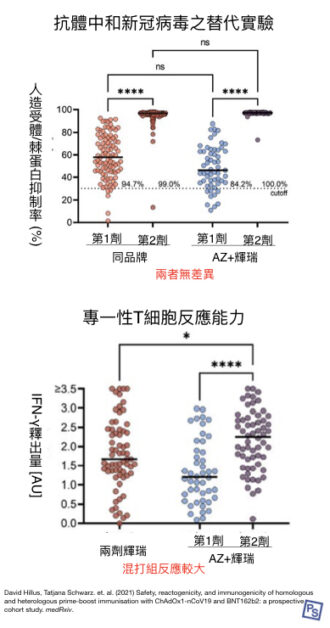
在不良反應方面,同品牌和混打之間,似乎沒有差異(如下圖所示);不過,接種首劑 AZ 疫苗時,頭痛、疲勞、發寒等不適都較為頻繁。
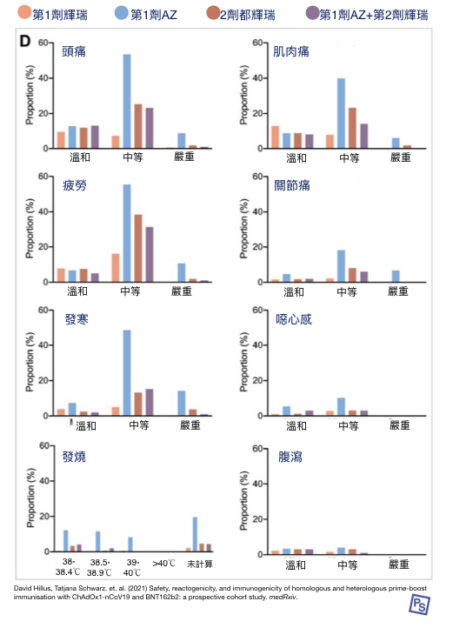
而疫苗誘發的免疫力,混打組的數據,似乎更好一些些。
抗體層面,多數皆顯示混打組的能力,和兩劑輝瑞相同;抗體中和病毒效價實驗顯示,兩組的能力無差異(如下圖所示) [註1],「AZ+輝瑞」和「兩劑輝瑞」所誘發的抗體,阻止病毒侵入細胞的能力相似。
而細胞免疫的要角:T 細胞層面,團隊將棘蛋白的一部分(S1)摻入血中,觀察能辨認病毒蛋白質的 T 細胞,活化後分泌的 IFN-γ 量。結果如下圖2,「AZ+輝瑞」所活化的 T 細胞反應,居然比「兩劑輝瑞」更高;
顯示在細胞免疫層面,混打疫苗說不定能引起更高的免疫力。
混打對變異株病毒的效果
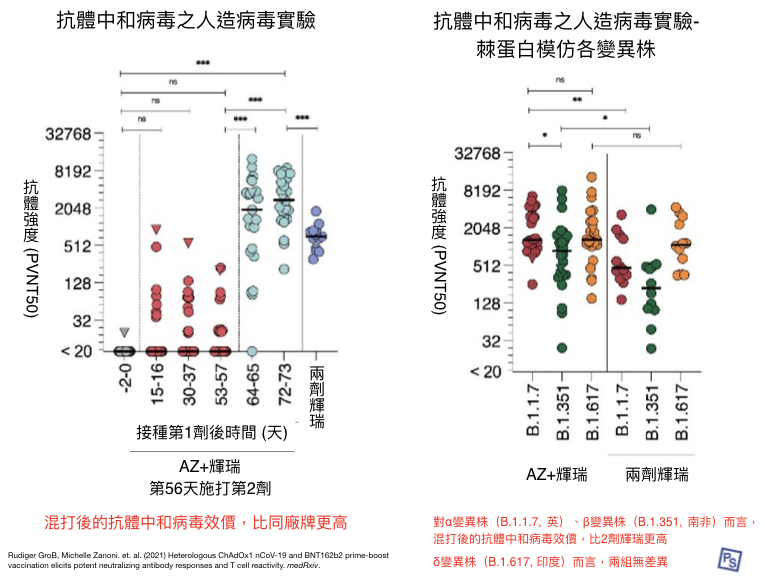
德國烏爾姆大學(Ulm University)團隊則是招募了 26 名醫護(平均 30 歲),接受混打疫苗首劑 AZ 疫苗、第二劑輝瑞疫苗(間隔8週),並且觀察其抗體中和變異株的能力 [2]。
對抗變異株的結果也令人驚奇:混打組的數據,似乎更好。
如下圖 3,在抗體中和病毒效價實驗中 [註2] ,以 α 變異株(B.1.1.7,俗稱英國變異株)和而言,「AZ+輝瑞」的抗體中和病毒效價,比「兩劑輝瑞」高出 3.9 倍!
而 β 變異株(B.1.351,俗稱南非變異株)也出現類似情況。此外,近期熱議的 δ 變異株(B.1.617,俗稱印度變異株)也被加入了此次的研究,「AZ+輝瑞」的抗體效價,並未因突變而降低。
整體而言,在對抗變異株的能力上,混打策略展現了令人驚奇、效果似乎更好的數據。
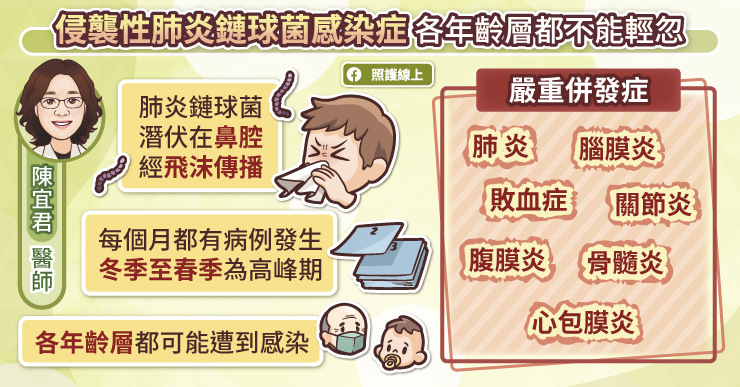
注意!不可忽略的不良反應
德國研究似乎展示了混打疫苗的優越性。在抗體中和病毒的能力上,混打「AZ+輝瑞」應不弱於「兩劑輝瑞」,且在活化 T 細胞上,可能稍強;而對抗變異株病毒上,混打「AZ+輝瑞」甚至展現了更高的中和效價。
綜上所述,混打不同廠牌的 COVID-19 疫苗,仍似乎可能是項可選擇的策略。
但是,我們仍必須注意不良反應的影響。英國一項約九百人的臨床試驗發現,混打(「AZ+輝瑞」或「輝瑞+AZ」),相較於兩次皆施打同廠牌(「AZ+AZ」或 「輝瑞+輝瑞」),出現不適感的比例更多、更強 [3]。
混打COVID-19疫苗的學理推論
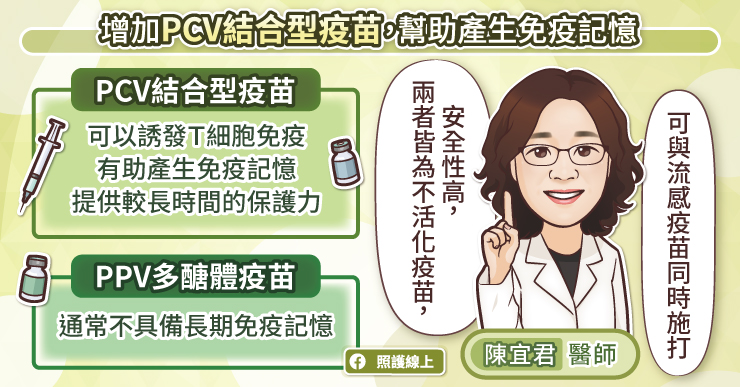
為什麼接種不同廠牌疫苗,免疫反應好像更好?科學家目前有些推論 [4],混打「不同技術」的疫苗,或許可以綜合各技術類型疫苗的優勢。
舉例而言,滅活/去活化病毒疫苗(如:科興、國藥)和蛋白質疫苗(如:高端、Novavax),主要誘發體液免疫(humoral immunity),但活化的細胞免疫力(cellular immunity)較弱。而腺病毒載體(如:AZ、嬌生)和 mRNA 疫苗(如:輝瑞、Moderna),能同時誘發體液和細胞免疫 [5]。
因此使用「蛋白質疫苗」加上「腺病毒載體/mRNA 疫苗」,或許能成為一種截長補短的有效策略。
此外,AZ、嬌生等疫苗,因外殼是腺病毒,可能會誘發人體的抗體攻擊。當人體接種第 1 劑的腺病毒載體疫苗,可能也會同步活化攻擊載體的抗體;注射第 2 劑時,這些抗體可能會直接消滅腺病毒載體、降低疫苗效力。因此「腺病毒載體疫苗」+「mRNA/蛋白質疫苗」,或許可作為一種迴避自我攻擊、降低疫苗效力的有效戰術。
混打疫苗是需要面對的議題
混打不同廠牌的疫苗是否可行,已是各國搶著研究的議題;我個人認為,在疫苗稀缺的台灣,這更是無法迴避的討論。

英美已在5月提出「Cov-Boost」、第3劑混打計畫,參與疫苗包含了尚未上市的Novavax,和台灣較陌生的中國科興、國藥疫苗。台灣能取得的疫苗,並不若英美多樣化,但國內高危險族群亦可能需追加第3針,以確保她們的安全。台灣的研究不可保守自封,應急起直追,越早建立本土研究越好。
保持冷靜,繼續前進。Keep Calm and Carry On.
補充:目前尚無 AZ+Moderna 的混打研究結果。
英國牛津大學已在今年(2021)2月展開多項混打實驗:
輝瑞+輝瑞,間隔12週
輝瑞+Moderna,間隔12週
輝瑞+Novavax,間隔12週
AZ+AZ,間隔12週 ‧AZ+Moderna,間隔12週
AZ+Novavax,間隔12週若有最新資訊,將隨時轉譯。參考文獻:Elisabeth Mahase (2021) Covid-19: Moderna and Novavax vaccines to be tested in mixing vaccines trial. BMJ. DOI: https://doi.org/10.1136/bmj.n971
備註
註1:此處的抗體中和病毒實驗,並非採用活病毒(活病毒危險性高),而是使用人造的 ACE2 受體、人造棘蛋白的 RBD 部件進行實驗。抗體辨認、結合棘蛋白的 RBD 部件能力越高,越能阻止兩者結合,理論上就能抵抗病毒入侵 [6]。
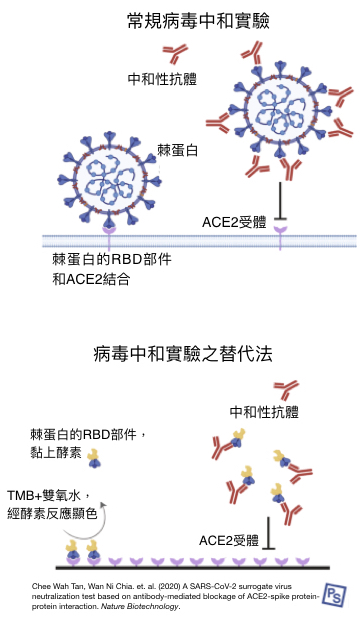
註2:此處的抗體中和病毒實驗,並非採用真的 COVID-19 病原(危險性高),而是透過基因工程,讓無害病毒表面長出其關鍵的棘蛋白,以進行實驗。
參考文獻
- David Hillus, Tatjana Schwarz. et. al. (2021) Safety, reactogenicity, and immunogenicity of homologous and heterologous prime-boost immunisation with ChAdOx1-nCoV19 and BNT162b2: a prospective cohort study. medRxiv. DOI: https://doi.org/10.1101/2021.05.19.21257334
- Rüdiger Groß, Michelle Zanoni. et. al. (2021) Heterologous ChAdOx1 nCoV-19 and BNT162b2 prime-boost vaccination elicits potent neutralizing antibody responses and T cell reactivity. medRxiv. DOI: https://doi.org/10.1101/2021.05.30.21257971
- Robert H Shaw, Arabella Stuart. et.al. (2021) Heterologous prime-boost COVID-19 vaccination: initial reactogenicity data. The Lancet. DOI: https://doi.org/10.1016/S0140-6736(21)01115-6
- Heidi Ledford (2021) Could mixing COVID vaccines boost immune response? Nature. DOI: https://doi.org/10.1038/d41586-021-00315-5
- 張金堅,許辰陽等 (2020) 新冠肺炎 (COVID-19) 的免疫學探討。臺灣醫界
- Chee Wah Tan, Wan Ni Chia. et. al. (2020) A SARS-CoV-2 surrogate virus neutralization test based on antibody-mediated blockage of ACE2–spike protein–protein interaction. Nature Biotechnology. https://doi.org/10.1038/s41587-020-0631-z