用基因治療的概念,對抗新興傳染病
疫苗的最高策略之一是「模擬被自然感染」,刺激免疫系統、生成記憶型 B、T 細胞,以產生體液型 (humoral immunity) 和細胞型免疫 (cell-mediated immunity)。因此,疫苗的古老技術裡,有種方式是利用多次繼代培養,養出致病力較弱的子代,再將弱化但仍活著的病毒注入人體 [註1],讓病毒在人體細胞裡繁殖,偽裝成被野生株病毒感染的假象 [1]。麻疹、德國麻疹疫苗等皆是此類型。
然而,面對高毒性的新興病原體,如:新型冠狀病毒(SARS-CoV-2)等,直接餵活病毒給人體,肯定不是件好主意。因此科學家從基因治療領域借鑑,將目光轉向「能傳遞基因的病毒載體」。
基因治療的原理是:
- 將人工設計、可產生目標蛋白質的 DNA 送入人體細胞
- 將人工設計的 DNA 轉錄成 RNA,細胞再將 RNA 轉譯成目標蛋白質
- 目標蛋白質取代患者的缺陷蛋白質,治癒病人
而研發疫苗的科學家,借用了基因治療的概念,將「目標蛋白」換成病毒蛋白質、讓細胞產生病毒蛋白質,創造出被感染的假象。當免疫細胞看到表面佈滿病毒蛋白質的細胞,就會認為人體正被病毒感染,因此啟動整個免疫反應,藉此模擬自然感染、訓練免疫系統。
要怎麼讓細胞產生病毒蛋白質呢?細胞就像中央廚房,遵守著 DNA 主廚的指令,主廚 (DNA) 寫出食譜 (mRNA),細胞廚房就會依照食譜烹調出料理(蛋白質)。
若科學家希望細胞作出一份病毒蛋餅,那我們就將設計過的主廚 (DNA) 安全地送到廚房,主廚就會寫出正確的食譜 (mRNA),細胞廚房便能烹調出一份我們心目中的病毒蛋餅(冠狀病毒棘蛋白)了。

腺病毒載體技術的優勢和缺點
基因治療裡,眾多技術都能將基因送至細胞內。而在新型冠狀病毒瘟疫(COVID-19)威脅下,許多疫苗科學家將目光投向了「腺病毒載體」技術。
腺病毒是顆 20 面體的中型、無膜、雙股 DNA 病毒,約 70-100 奈米 (nm) [2]。科學家創造出有缺陷的腺病毒,該缺陷病毒僅能在特殊細胞內繁殖,因此確保該人工病毒不會危害人體,或流竄到自然生態圈裡。
而人工腺病毒的 DNA 可乘載新型冠狀病毒的棘蛋白 (spike protein) 的 DNA;當此人工腺病毒注射至人體、感染人類細胞,進而成功地將棘蛋白 DNA 送至細胞內、再轉錄成 RNA,最終產生病毒蛋白質。被人工腺病毒感染的細胞,會在表面產生出病毒棘蛋白,而後被免疫細胞發現、刺激免疫反應 [3]。如此便能「模擬被自然感染」,以達到疫苗的效果。
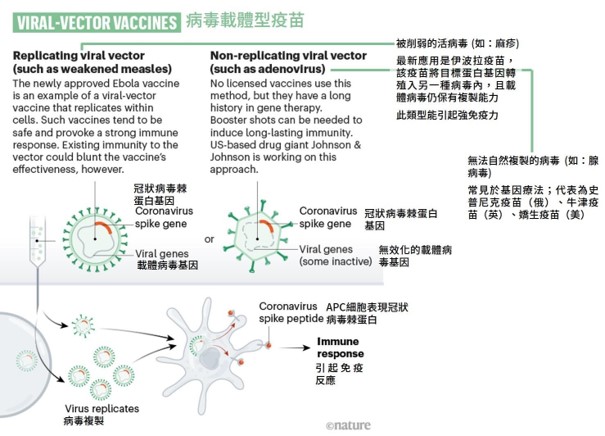
然而,腺病毒載體有其本身的優/劣勢:
優點
- 研發歷史悠久,腺病毒載體技術從上世紀 70 年代起研發 [4]。
- 相較於 mRNA 疫苗需零下之保存溫度,腺病毒載體疫苗僅需維持在 2-8℃,冷鏈保存友善。
- 相較於蛋白質次單元型或去活化型疫苗,腺病毒載體能夠引起強烈的免疫反應,無需額外添加佐劑協助 [5]
缺點
野生株的腺病毒能引起普通感冒,據估計,約有 5 % 的一般感冒是由腺病毒感染 [6]。換言之,多數人可能對眾多亞型的腺病毒帶有抗體,當疫苗注射至人體時,抗體就會破壞腺病毒,導致疫苗失效。據研究,約有 35-95%(依居住地不同而有差異)的人類帶有第 5 型腺病毒 (AdHu5) 的抗體 [5]。
因此疫苗科學家們,紛紛改用其他亞型、物種的腺病毒為素材,試圖避開人體內原有的抗體。
- 中國的康希諾疫苗 (CanSino):使用第 5 型腺病毒 (Adenovirus Type 5) 作載體,優勢為 1 劑。已獲中國、墨西哥等國通過使用。
- 美國嬌生疫苗 (Johnson & Johnson):使用第 26 型腺病毒 (Adenovirus Type 26) 作載體,規避原有抗體,優勢為 1 劑。已獲美國通過使用。
- 英國牛津疫苗 (Oxford-AstraZeneca):使用黑猩猩腺病毒 (ChAdOx 1) 作載體,規避原有抗體。須打 2 劑。已獲台灣、世界衛生組織 / WHO、歐盟、英國等國通過使用。
- 俄羅斯史普尼克疫苗 (Sputnik V):第 1 劑使用第 26 型腺病毒 (Adenovirus Type 26),第 2 劑使用第 5 型腺病毒 (Adenovirus Type 5)。兩劑採用不同載體的設計,降低第 1 劑產生的抗體,可能會攻擊第 2 劑疫苗載體的可能性。已獲俄羅斯、墨西哥、匈牙利等國通過使用。
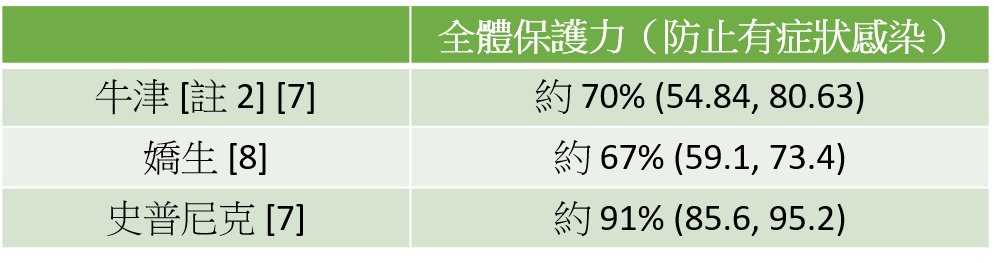
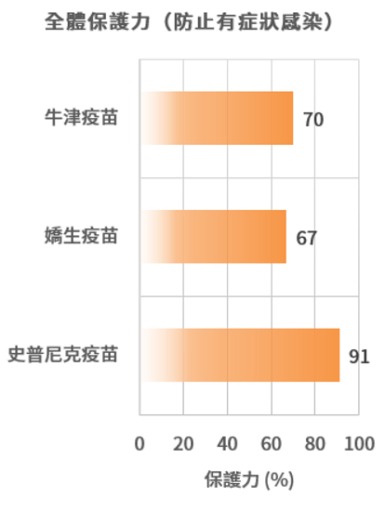
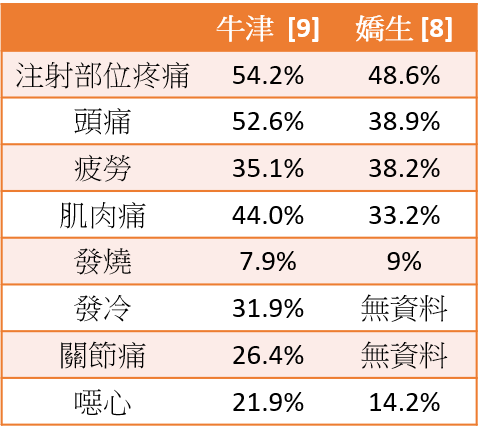
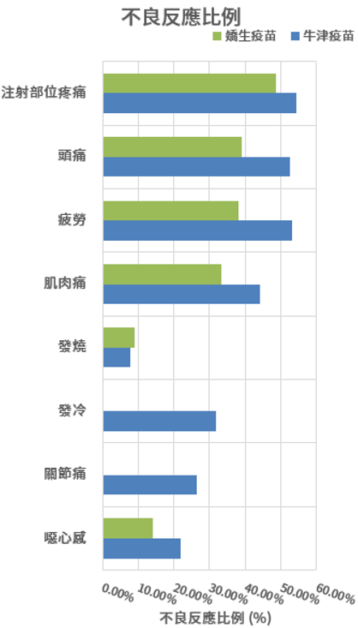
牛津、嬌生、史普尼克疫苗之保護力和不良反應
資料採用已公開且經同儕審核的三期臨床報告,或已公開且經政府審核通過緊急許可之三期臨床報告。
保護力
不良反應
新型冠狀病毒瘟疫/COVID-19 讓多項科學跨越行政障礙而落地、接受真實世界的考驗。腺病毒載體疫苗也是受惠的領域之一。在可期的未來裡,我們將可逐漸看到腺病毒疫苗挑戰 HIV、C 型肝炎等疾病,協助人類克服前所未有的頑疾。
保持冷靜,繼續前進。Keep Calm and Carry On.
註釋
註1:病毒不被視為生物,因此並沒有「活著」或「死亡」的狀態。但為求容易理解,本文將仍帶有活性、可感染細胞的病毒視為「活病毒」。
註2:牛津疫苗依兩劑間隔時間不同,保護力有所差異。大約落在 55~81% 之間。詳細數據可參考《蔣維倫 (2021) 醫護出現拒打潮?牛津疫苗的不良反應真有這麼恐怖?泛科學》
參考文獻
- 認識流感疫苗。行政院衛生署疾病管制局
- Chapter 67 Adenoviruses. Medical Microbiology. 4th edition. University of Texas Medical Branch at Galveston; 1996.
- Ewen Callaway (2020) The race for coronavirus vaccines: a graphical guide. Nature. DOI: https://doi.org/10.1038/d41586-020-01221-y
- Chao Zhang and Dongming Zhou (2016) Adenoviral vector-based strategies against infectious disease and cancer. Human Vaccines & Immunotherapeutics. https://doi.org/10.1080/21645515.2016.1165908
- Mangalakumari Jeyanathan, Sam Afkhami, Fiona Smaill, Matthew S. Miller, Brian D. Lichty & Zhou Xing (2020) Immunological considerations for COVID-19 vaccine strategies. Nature Reviews Immunology. DOI: https://doi.org/10.1038/s41577-020-00434-6
- William S.M. Wold and Karoly Toth (2013) Adenovirus Vectors for Gene Therapy, Vaccination and Cancer Gene Therapy. Current Gene Therapy. 13(6): 421–433.
- 蔣維倫 (2021) 今晚,你想打那支?新冠病毒疾病(COVID-19)疫苗們的保護力。泛科學
- Janssen Ad26.COV2.S Vaccine for the Prevention of COVID-19. Vaccines and Related Biological Products Advisory Committee Meeting. 2021/02/26. U.S. Food and Drug Administration.
- Information for Healthcare Professionals on COVID-19 Vaccine AstraZeneca. UK Medicines & Healthcare products Regulatory Agency. 2021/02/23