2019 年底起源自武漢的傳染病仍在蔓延,病毒之外,陰謀論也大肆流傳,此外還有一些品質差勁的分析。根據目前資訊推論:人類病源來自未知的單一起源,距今時間很短,一開始就能人傳人。
相關分子演化分析可參考前文〈病毒不是源於武漢的海鮮市場?從分子演化學角度看2019新型冠狀病毒(武漢肺炎)的起源與傳播〉
本文略長,重點如下:
- WARS 在雲南找到最近親戚,兩者非常相似。(比 SARS 近得多)
- WARS 的中間宿主尚未確認,但現有和蛇有關的分析完全是錯誤的。
- 仔細檢視後,WARS 的 S蛋白質變異和 HIV 毫無任何關係。(該論文已由作者撤稿)
- 沒有可靠證據支持現有的陰謀論,WARS 極可能是自然演化而來的病毒。
- 現階段出現一些搶快不可靠的研究,即使同儕審查過的論文也不可盡信。
中國官方對疫情沒有說實話,卻也缺乏黑手介入操弄病毒的證據。在這眾人都在搶快的時刻,即使是學術期刊發表也未必無誤,一定要保持判斷力。
- 本文於2020 年 2 月 3 日刊登,仍有許多與 2019-nCoV 相關的研究正在進行,目前發表的研究並非最終結果。

雲南找到最近親戚,支持 WARS 是純天然病毒
導致武漢疫情的是一種冠狀病毒(coronavirus),本文之後會使用 WARS 這個簡稱。目前 WARS 一共有 53 個病毒基因組被定序出來,彼此間差異非常非常小。近日一大關鍵情報來自中國科學院的武漢病毒研究所,石正麗領頭的論文(上傳初稿,尚未正式發表),其中報告了一款之前沒有發表過的新病毒「RaTG13」,遺傳上和 WARS 最相似,兩者序列相似度為 96.2%;作為對照,SARS 和 WARS 的相似度是 79.5%。1, 2

石正麗的合作者 Peter Daszak(屬於一個叫作 EcoHealth Alliance 的機構)在 Science 新聞受訪表示,他們之前花費 8 年,在中國各處採集約一萬個蝙蝠及 2000 個其他動物的樣本,總共偵測到 500 款之前未知的冠狀病毒。(因此我實在不喜歡廣傳「新型冠狀病毒」此一名稱,未來恐怕很容易引起誤會)
Daszak 表示中國蝙蝠冠狀病毒的多樣性非常驚人,和 WARS 最相似的 RaTG13 是 2013 年於雲南採樣到。但是這不等於 WARS 直接來自雲南,因為和自然狀態相比,人為取樣一定相當侷限;和 WARS 相似的近親或許在更多地方存在,我們根本無從得知。
平時論文慢慢來,這時發表都搶快!
也許有人會懷疑,既然知道有樣本為什麼之前不講,出事後才趕快發佈,豈不擺明有鬼?不過這其實是學術研究的常態,許多研究團隊平時都堆積著大量尚未發表的資料,除非有突發狀況,否則不會特別趕時間。
大家想想看,在此之前 RaTG13 有什麼好提的?假如不知道 WARS 會感染人類,RaTG13 不過就是那新偵測到的 500 款病毒中,其中一種沒人有興趣的新型病毒,毫不特殊,有什麼值得特別重視的價值?
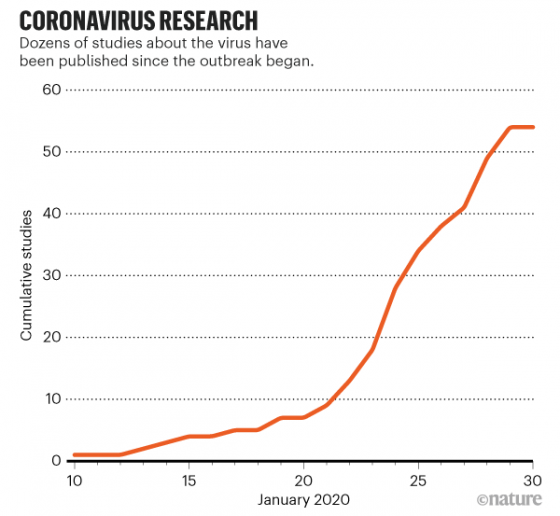
不正常的反而是現在的狀況:WARS 疫情大爆發後,冠狀病毒成為頭號顯學,最近 20 天冒出超過 50 篇論文(多數仍尚未正式發表)。學者燃燒小宇宙的成效可以十分驚人,這種生產論文的速度儘管罕見,但是技術上辦得到。結果又有人懷疑論文哪有可能寫這麼快,一定是中國人早就有資料,但是故意不講……這就是父子騎驢吧。3
解釋 WARS 不需要陰謀論
現階段對於 WARS 的陰謀論比比皆是,例如一說認為之前在加拿大高度管制實驗室工作,被指控涉及間諜,遭到開除的中國科學家和 WARS 疫情有關係;也有人質疑 WARS 是在武漢 P4 實驗室研發,外洩的生物武器。4
然而,與目前更加明確的線索相比,並不需要這些陰謀論解釋 WARS 的起源。這次疫情中國政府沒有說實話、中國在歐美有間諜活動、之前處理實驗不夠謹慎讓 SARS 外洩過,這些都是事實,也無法排除中國私下研發生物武器的可能性。但是要證明 WARS 和中國研發生物武器有關係,目前沒有合理的證據。
反倒有更強力的證據指出,WARS 就是另一場源於自然的智人危機。
WARS 和最近親戚分家後,才獲得跨物種感染力
華盛頓大學的 Trevor Bedford 根據序列差異,估計雲南的 RaTG13 和武漢的 WARS 分家的年代,介於 25 到 65 年前;此一數字會受到突變率與宿主影響(提醒一下,我們仍然不知道 WARS 的原始宿主是哪種動物)。不過大概可以確定,兩者分家雖然不是太久,卻也已經有一段時間,不像是最近幾年的事。
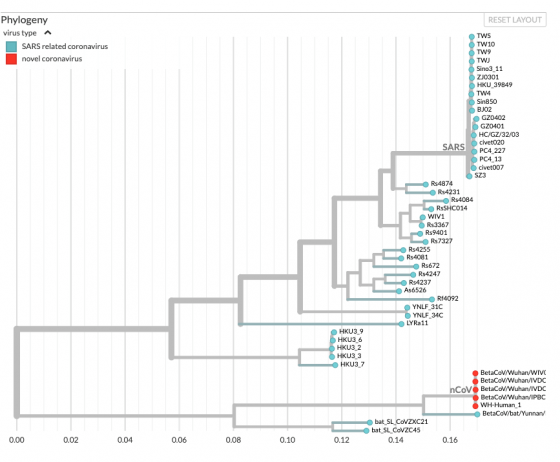
之前格拉斯哥大學的 David L Robertson 一度認為,WARS 經歷過至少兩次遺傳重組,但是見到序列更像的 RaTG13 後他就放棄該觀點。這不表示重組沒有發生過,而是因為兩種病毒彼此非常相似,意即重組事件發生的時間是在 WARS 和 RaTG13 還沒有分家之前。由此可知 RaTG13 也經歷過和 WARS 一樣的重組,它卻依舊是感染蝙蝠的尋常病毒,表示讓 WARS 變得獨特的那些突變,和更早發生的重組缺乏直接關係。5
直接比較 WARS 和 RaTG13 會發現兩者整體非常相似,唯獨有個與感染能力高度相關的 S蛋白質(spike protein)基因差異較大;一些科學家認為 WARS 獨特的 S蛋白質,是它能順利侵略智人的關鍵。然而,WARS 當初如何由動物移民到智人身上,是否有透過中間宿主,目前仍缺乏可靠的證據。
順帶一提,目前以細胞株為材料的初步體外測試發現,蝙蝠、豬、麝香貓(civet)都會感染 WARS,不過今年本命年的小鼠不會感染。而常見的寵物貓、狗,至今也沒有牠們會感染 WARS 的證據,不需要恐慌。
說到中間宿主和 S蛋白質,最近兩篇錯誤相當明顯的論文分別與它們有關,本文將逐一介紹。
錯誤發表一:WARS的中間宿主是……蛇?
疫情爆發後不久,一項通過同儕審查的研究宣稱找到 WARS 的中間宿主「蛇」。這篇論文的思維和分析方法都嚴重錯誤。正式昭告天下,在當下疫情熱烈,搶快發表的大競速時代,即使是同儕審查過的論文也無法保證最基本的品質。6, 7
簡單說是這樣:該論文選用的分析方法「codon usage bias(密碼子利用偏好)」達成了錯誤的結論。此分析方法儘管常見,目的卻根本不是尋找宿主。這是只會計算數字,絲毫不懂背後生物原理與概念的低級錯誤。
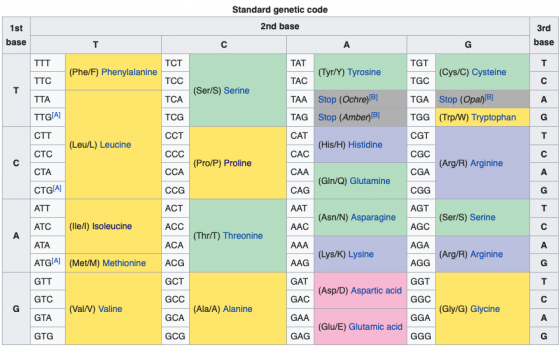
codon usage bias(用中文反而會讓稍有概念的人看不懂,因此使用英文)是什麼呢?遺傳密碼的核苷酸以三個為一組,一共有 64 種密碼子,卻只會對應到 20 種氨基酸;因此有時候在 DNA(或 RNA)層次上密碼子發生了改變,轉譯後的氨基酸仍然保持不變。
以脯胺酸(proline)舉例,有 4 種密碼子 CCT、CCC、CCG、CCA 對應這個氨基酸,不同生物都是用這 4 種密碼子生產脯胺酸,各種生物的比例卻不一樣。
比方說不同生物都使用這 4 種密碼子,維尼熊的比例是 6、4、3、87%,米老鼠卻是 40、15、5、40%,空心菜則是 22、28、32、18%;不同生物相異的偏好,就是所謂的密碼子—利用—偏好。
有 4 種密碼子對應氨基酸的狀況下,倘若隨機分佈,每種密碼子出現的機率應該是 4 分之 1,但是實際上往往不是隨機出現,不同生物、不同基因的同一種氨基酸,會特別傾向使用某些密碼子。
codon usage bias 不一定存在,假如存在也可能有許多不同的成因。理論上寄生於某種生物的病毒,如果自己的 codon usage bias 和宿主類似,也許能帶來一些生存上的優勢,不過這只是理論。8
重點在於,不可能光靠病毒的 codon usage bias 一種指標就判斷宿主!只用 codon usage bias 推論宿主,是對相關概念完全外行的表現;讓這種貨色正式發表,不管為什麼,都是期刊與編輯該深刻反省的責任。
若是覺得上述解釋太難看不懂,人在瑞典的博士生北歐心科學有個妙喻:
「就像說用美金就是美國人」,結果中國跟伊朗人也用美金,都被一視同仁為美國人。
WARS、SARS 與 MERS 的密碼子偏好都更接近蛇,但後兩者宿主都不是蛇
序列分析垃圾進,只會有垃圾出,沒什麼好講的。即使再退一步說,該論文設計實驗時也沒有通過最基本的假說—驗證。Robertson 和斯克里普斯研究所(Scripps Research)的 Kristian Andersen 都重新分析 WARS 的密碼子利用,一致認為該論文的結論錯誤。9
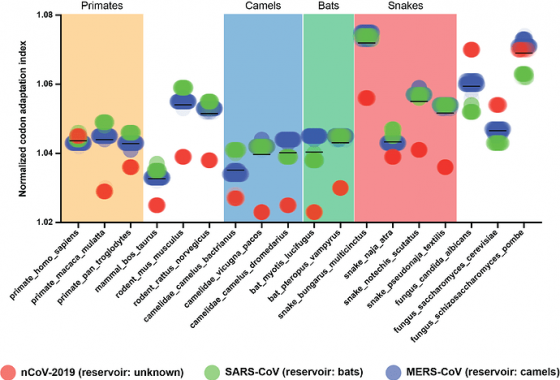
Andersen 還示範正確「假說—驗證」的作法(感謝大大無私分享!),比方說 SARS 的宿主是蝙蝠、MERS 是駱駝,假如有其他動物的偏好比蝙蝠更像 SARS,或是比駱駝更像 MERS,就表示用 codon usage bias 判斷宿主的策略行不通。
結果當然是行不通。Andersen 分析發現和不同生物相比,SARS 沒有最接近蝙蝠,MERS 也不是最接近駱駝;它們反而更接近蛇,以及不會感染的小鼠。WARS 的密碼子偏好和各種生物相比,則普遍小於兩位親戚,和蛇(以及小鼠)相對較像,但是都比不上釀酒酵母等三種「真菌」,可是真菌當然不可能是冠狀病毒的宿主!
必須注意的是,這些分析無法排除蛇是中間宿主的可能性,但是結果明確指出:
冠狀病毒的 codon usage bias 和宿主沒有明顯關係,這項指標無法用於判斷宿主。
錯誤發表二:WARS 有片段跟 HIV 有關?(該發表已撤稿)
另一份 1 月 31 日上傳,尚未正式發表的論文初稿宣稱,在 WARS 的 S蛋白質上找到 4 處插入(insertion),此部份序列沒有在其他已知的冠狀病毒中見過,卻和會導致愛滋病的 HIV 一致,不像是隨機發生。10
這項研究由於比較對象太少,所以得到完全錯誤的結論。甚至有人建議可以用來測驗生技公司員工的水平,轉貼卻毫無批評者,直接開除。在本文完成以後,該論文初稿已經被作者暫時撤回。

分析問題時,選擇比較的對象相當重要。該文只拿 SARS、WARS 和 HIV 三種病毒比較,取樣太過侷限,不可能得到有意義的分析。
Bedford 同時比對多種由蝙蝠採樣來的冠狀病毒,發現不同品系的 S蛋白質之間相比,它們序列上本來就會加加減減、多一點少一點;而 WARS 的 S蛋白質這方面並不特殊,應該是天然演化的結果。11
Bedford 首先提出,那 4 處所謂的「插入」片段序列都非常短,在非常多已知的生物基因組上也能找到 100% 符合的對象,無法證實它們來自 HIV。他接著逐一詳細分析(樓主好人一生平安!),結論是12
4 處序列中沒有任何一段,真正來自外源遺傳物質的插入。

「插入」片段都在近親身上找得到,和 HIV 無關
WARS 和來自雲南的最近親 RaTG13 相比,第一段序列「GTNGTKR」也在雲南兄弟的基因上存在。第二段「YYHKNNKS」該論文判斷為一獨特插入,卻是人為調整序列所致(提醒各位這算正常操作),事實上雲南兄弟也存在這段序列。

WARS 和 RaTG13 皆具有這兩段序列,表示它們早在兩者分家以前已經存在,不可能是 WARS 基因組上才插入的新片段。
第三段「GDSSSG」也可能受到人為調整影響,不過就算真有插入,看起來 RaTG13 也具有這段,WARS 並不獨特。

第四段「QTNSPRRA」,雲南兄弟也有前方的 QTNS ,卻沒有後方的 PRRA,表示 PRRA 大概真的是 WARS 獨自誕生的新突變,可以說它是插入,但是這麼短的序列變異常常發生,在基因組上比比皆是,毫無特殊之處。(提醒各位,WARS 的 S蛋白質和親戚的差異本來就大)
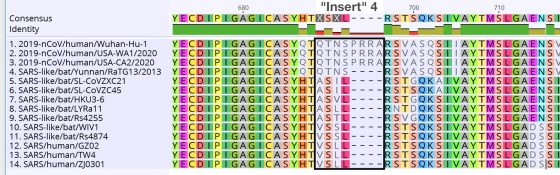
總之,Bedford 的分析明確否定了「WARS 基因組上有 4 處與 HIV 一致的非隨機插入」,這是很值得學習的一次教訓。
最類似 WARS 的雲南樣本 RaTG13 目前尚未正式發表,沒有將它加入比對,或許並非不可饒恕的大罪。但是只選取三種遺傳上差異極大的病毒直接比對(即使是 SARS 和 WARS 也超過 20% 不同),又遽下太不符合常理的偏頗結論,就是徹底失格的分子演化分析了。

資訊虛實難辨,保持判斷力!
再來一次劃重點:
- WARS 在雲南找到最近親戚,兩者非常相似。
- 中間宿主尚屬未知,現有證據與蛇無關。
- WARS 和 HIV 毫無關係。
- 目前沒有可靠證據支持陰謀論,WARS 極可能是自然演化而成。
來到本文的盡頭,不論你是已經辛苦看完一大串外星文字,或是直接跳到結尾看結論,希望都能帶給讀者最重要的訊息:
「在此大家都在搶快的時刻,資訊虛實難辨,即使同儕審查過的論文也不可盡信,更需要保持判斷力。」
參考文獻
- 尚未發表的初稿:Discovery of a novel coronavirus associated with the recent pneumonia outbreak in humans and its potential bat origin,本文完成後正式發表於 Nature 期刊:A pneumonia outbreak associated with a new coronavirus of probable bat origin
- Mining coronavirus genomes for clues to the outbreak’s origins
- China coronavirus: how many papers have been published?
- Online claims that Chinese scientists stole coronavirus from Winnipeg lab have ‘no factual basis’
- nCoV’s relationship to bat coronaviruses & recombination signals (no snakes) – no evidence the 2019-nCoV lineage is recombinant
- Hu, D., Zhu, C., Ai, L., He, T., Wang, Y., Ye, F., … & Zhu, J. (2018). Genomic characterization and infectivity of a novel SARS-like coronavirus in Chinese bats. Emerging microbes & infections, 7(1), 1-10.
- 质疑:蛇是武汉新型病毒的中间宿主吗?
- Wong, E. H., Smith, D. K., Rabadan, R., Peiris, M., & Poon, L. L. (2010). Codon usage bias and the evolution of influenza A viruses. Codon Usage Biases of Influenza Virus. BMC evolutionary biology, 10(1), 253.
- nCoV-2019 codon usage and reservoir (not snakes v2)
- Uncanny similarity of unique inserts in the 2019-nCoV spike protein to HIV-1 gp120 and Gag
- Trevor Bedford 發表於推特的初步分析
- Trevor Bedford 發表於推特的進一步分析
本文亦刊載於作者部落格《盲眼的尼安德塔石匠》暨其 facebook 同名專頁。