編按:此為細菌療法系列文章的最終章,歡迎讀者至文末點擊並閱讀所有文章。
免疫療法是藉由活化人體的免疫系統,來達到殺傷癌細胞的效果,但實體固態腫瘤的腫瘤微環境就如同癌細胞的防禦結界一樣,讓免疫療法難發揮功效。因此,科學家們想起並徵召了能夠打破結界的「細菌療法」,希望可以藉此對付腫瘤微環境,讓我們更有效的殺死癌細胞。
可惜的是,雖然細菌療法在動物實驗上有不錯的效果,但到了臨床試驗的階段,效果仍是差強人意。
大難題:如何殺死癌細胞但不傷身?
和所有藥物一樣,如何平衡其毒性和治療效果,是細菌療法不能迴避的問題!我們必須讓細菌足以對付癌細胞,但細菌的毒性又不可以太高,以免讓我們的身體與癌細胞同歸於盡。
早期柯立用熱滅活的方式來降低細菌的毒性,現代科學家們則用基因工程的方式降低毒性。
科學家努力降低細菌的毒性後,雖然動物實驗偏樂觀,但細菌療法一運用到人體並進行臨床實驗後,卻出現許多科學家不樂見的結果。有時細菌毒性太強,讓病患處於高風險中(如見前篇文章中李斯特菌的臨床試驗結果),有時又出現減毒力度太猛,細菌療法失效的情形(如前篇文章沙門氏菌-VNP20009 的臨床試驗結果)。
其實這個問題,某種程度上,源自動物實驗和臨床試驗的鴻溝。
我們不一樣~實驗小鼠和人類大不同!
因小鼠的成本低、體積小、易操作,並且有著豐富的生理遺傳資料與多樣性,所以實驗小鼠是當前學界最常用於動物實驗的動物。
而用於細菌治療的實驗小鼠,大都是在無特定病原 (Specific Pathogen Free,SPF)註1的環境下飼養,在動物實驗開始之前,這些小鼠的免疫系統都沒有與細菌正面交鋒的經驗,因此在被細菌感染後,小鼠們的免疫反應和人類自然不同。
當然,如果使用免疫缺陷的裸鼠註2,那結果可能又更不一樣了。
和在 SPF 環境下生長的小鼠不同,人類打一出生,就不斷與各種病原體對抗,這讓我們的免疫系統相當善戰,而免疫系統的記憶性,讓我們面對相似的病原體時,能更快應對。
拜此特性,能輕易讓實驗小鼠產生免疫反應的細菌,在人體未必能引起免疫反應,若要讓人體產生和實驗小鼠類似的反應,勢必要提升注射細菌的劑量,但這又容易讓產生過多的毒性。因此,如何找到細菌療法在人體的適合劑量,是臨床試驗的重要挑戰。
在細菌療法前,患者已接受過其他療法了
另一個讓細菌療法在臨床效果不佳的原因,其實現在的免疫療法也有遇到。
這兩種療法的核心思想,都是活化人體的免疫系統,來殺傷癌細胞,但很多接受免疫療法或免疫療法的病患,已經先接受過化療和放射療法了!
雖然化療和放射療法都能殺死腫瘤細胞,但同時也會傷害人體其他細胞,甚至讓免疫系統受損,使得病患的免疫力下降。
由於病患的免疫系統已經被削弱,若此時才讓病患接受細菌療法、免疫療法,活化免疫系統的效果自然不如預期。
這也部分回答了,為什麼現代醫學界難以重複當年柯立的實驗。
柯立當年使用柯立毒素時,是做為「第一線」的抗癌手段,不僅放射療法剛出現,化學療法甚至尚未問世!也許就是因為病患體內的免疫系統並不會受到化療或放射療法的摧殘,所以柯立才可以透過細菌感染快速、有效的活化免疫系統。
除了臨床試驗上的挑戰,細菌療法其實也遇到柯立當年被質疑的窘境——治療機制不確定、治療的副作用。

細菌療法跟免疫療法到底有什麼差?
或許看到這邊,你會疑惑細菌療法和免疫療法有何差異,不都是活化免疫系統來治療癌症嗎,怎麼會有機制不確定的問題?
其實嚴格來說,細菌療法也是在免疫療法這個大框架之下,只不過細菌療法(或者說柯立毒素)比起現代使用的各類免疫療法的歷史更早。
現代的免疫療法其機制都相當確定,例如 CTLA-4 和 PD-1 抑制劑,就是關閉 T 細胞上的免疫煞車,讓 T 細胞的活性不會被癌細胞關閉,進而達到攻擊腫瘤的能力,但細菌療法對於免疫細胞活化的機制,就不像現代免疫療法這麼清晰了。
雖然現代的免疫學已能「大致」推測出細菌療法的機制(例如前幾篇文章中提到的活化類鐸受體),在動物與人體實驗中,也確實觀察到免疫系統的活化。但不同病患間,免疫系統活化的程度都不同,而且不同的治療用細菌,活化免疫系統的機制也不完全一樣,至今科學家們對於細菌療法背後的詳細機制,並沒有統一的解釋。
全面活化免疫系統,攻向最可怕的敵人!
現代與過往的細菌療法一樣,都是以「發燒」作為活化免疫系統的指標。不少研究指出,發燒就像一個緊急命令,會啟動一系列細胞訊號,強制活化免疫系統,命令它們摧毀所有非我族類者。

關於細菌療法,目前最被學界所接受的解釋方法是:「根基於發燒的免疫活化效果」。
雖然免疫細胞雖在腫瘤微環境受到強烈的抑制,但一旦接受到發燒的命令,會被強制活化並進攻腫瘤組織1。
免疫療法能活化的免疫細胞種類和強度有限,但細菌療法中的「發燒」是全面活化免疫系統,而且力度更強(有時強到會殺死人!)。
此外,人體的免疫系統與細菌已爭鬥上萬年,在免疫系統眼裡,細菌的威脅是遠高於癌細胞的。
因此當細菌這種最高等級的敵人,出現在腫瘤組織這種次級敵人內,免疫系統也就不再理會癌細胞的安撫,會將腫瘤連同細菌一起燒毀!
細菌療法的危險性以及發展潛力
然而在現代,開發藥物所要求的藥理機轉和副作用影響比柯立的年代更高。因此,即使細菌療法有著比其他免疫療法更強力的免疫活化效果,也有對抗腫瘤微環境的能力,但畢竟細菌療法將發燒定位為治療指標,使得許多國家的 FDA 都不允許細菌療法進入臨床試驗,就算允許,也是限制重重2。

整體而言,比起現代的癌症治療方法,細菌療法有著以下優勢,因此不少科學家認為細菌療法的潛力不小:
- 細菌療法能專一的對抗腫瘤微環境,這是目前其他癌症療法都難達成的能力。
- 細菌療法活化免疫系統的強度,比起其他免疫療法更強
- 藥物治療須不斷投藥才可以維持維持效力,但細菌能在腫瘤組織中自行生長,讓其效力可以延續。
單打獨鬥,不如與其他療法合作!
雖然只使用細菌療法,在臨床上效果不甚理想,但現代醫學在治療癌症上,也不會只用單一療法。因此,若能將細菌療法搭配傳統的化療、放射療法、標靶治療,甚至是免疫療法,是更實際的想法。
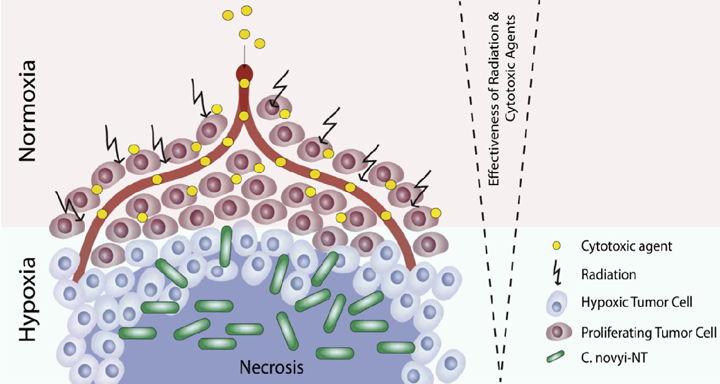
前篇文章有提到,目前化療、放射療法和免疫療法,都難以對付腫瘤微環境,但細菌療法卻可以專攻腫瘤微環境。因此,科學家們是這麼想的:用細菌破壞腫瘤微環境的同時,投入化學療法或放射療法或免疫療法,藉此讓治療效果最大化。
目前在動物實驗中,當諾維氏梭菌-NT、沙門氏菌-A1-R和李斯特菌合併化療或放射療法時都有不錯的成果,實驗結果指出,若能夠雙管甚至多管齊下,我們就可以用更少的化療或放射療法的劑量來消滅腫瘤。
目前這三隻細菌,也正在準備合併療法的臨床試驗。
二度捲土重來,不停歇的細菌療法
百年前,柯立將細菌療法帶入癌症治療中,雖然柯立與細菌療法一度被歷史遺忘,但在柯立的女兒海倫和眾多科學家的努力下,柯立的研究不僅重見天日,也啟發了免疫療法。
雖然隨著免疫療法的成熟,又讓細菌療法逐漸被忘卻,但面對難纏的腫瘤微環境,細菌療法又再度被科學家們想起。今日,學界配合著現代的基因工程和腫瘤治療法,再透過細菌療法專一的對付腫瘤微環境的能力,讓細菌療法成為 21 世紀極具潛力的新星。
雖然某種程度來說,將細菌打入體內來治病仍是一件很瘋狂的事情,但科學總是充滿各種可能與嘗試,以後細菌療法可能變成癌症治療的標準程序也說不定呢!
嘿嘿,未來的事情又有誰會知道呢?這個世界就是充滿各種未知和可能性,所以才有趣啊!
作者後記
細菌療法的系列,到此就告一段落了。當初本以為,兩篇文章就能完結細菌療法的前世今生,但隨著深入了解相關研究,發現這個題目的內容,實在太多太有趣了!於是就擴充成系列文章。
對我個人來說,細菌療法這個題目,是很「私人」的。還記得大學時第一次看到細菌療法的論文(諾維氏梭菌-NT在裸鼠的實驗上),第一反應也覺得這篇論文是不是瘋了!但深入了解後,反而覺得細菌療法的免疫活化概念是很有潛力的。
後來免疫療法開始火熱起來,雖然臺灣出現不少介紹免疫療法歷史的文章,也都有提到柯立和柯立毒素的貢獻,但卻遲遲不見介紹「細菌療法」這個柯立毒素直系血親的文章。
於是我決定自己撰寫,將細菌療法介紹給大眾,也算給自己一個交代。
當然細菌療法的研究遠不只如此,可能我也有不少疏漏,對於一些研究,我的解釋也未必正確,這點還請大家見諒。(編按:讀者若有任何疑問或是建議,懇請您在文章底下留言告訴我們!)
但我希望這個系列文章,能拋磚引玉,讓更多專家能從更專業的角度,將細菌療法這個瘋狂但充滿潛力的方法,介紹給更多讀者。
科學不是死板沉悶的,裡面也充滿各種奇思妙想。希望看完這整個系列,也能激起你的好奇心。科學就是源自好奇,人類永無止境的好奇心,就是科學發展最好的推進器!
註釋
- 無特定病原 (Specific Pathogen Free,SPF),是用於實驗動物的一個術語,保證動物沒有攜帶特定的病原。使用 SPF 動物可以確保不會有特定的疾病對試驗結果造成干擾。例如,在研究藥物對肺功能的影響時,動物最好沒有攜帶流感之類的呼吸道病原。
- 裸鼠是指胸腺先天發育不良的小鼠,體內幾乎沒有 T 細胞,因此可接受外來移植的細胞,較不會有免疫排斥現象。但裸鼠仍有正常的 B 細胞、自然殺手細胞 (NK cells) 和巨噬細胞 (macrophages),因此裸鼠仍有免疫反應。
參考資料
- Evans, S., Repasky, E. & Fisher, D. Fever and the thermal regulation of immunity: the immune system feels the heat. Nat Rev Immunol 15, 335–349 (2015)
- Karbach J, Neumann A, Brand K, Wahle C, Siegel E, Maeurer M, Ritter E, Tsuji T, Gnjatic S, Old LJ, Ritter G, Jäger E. Phase I clinical trial of mixed bacterial vaccine (Coley’s toxins) in patients with NY-ESO-1 expressing cancers: immunological effects and clinical activity. Clin Cancer Res. 2012 Oct 1;18(19):5449-59.
- Staedtke V, Roberts NJ, Bai RY, Zhou S. Clostridium novyi-NT in cancer therapy. Genes Dis. 2016;3(2):144-152.
- Torres W, Lameda V, Olivar LC, Navarro C, Fuenmayor J, Pérez A, Mindiola A, Rojas M, Martínez MS, Velasco M, Rojas J, Bermudez V. Bacteria in cancer therapy: beyond immunostimulation. J Cancer Metastasis Treat 2018;4:4.
- Felgner S, Kocijancic D, Frahm M, Weiss S. Bacteria in Cancer Therapy: Renaissance of an Old Concept. Int J Microbiol. 2016;2016:8451728.
細菌療法系列文章
- 太瘋狂了!注射細菌,竟然能夠「以毒攻毒」打敗癌細胞?細菌療法的前世(上)
- 太瘋狂了!注射細菌,竟然能夠「以毒攻毒」打敗癌細胞?細菌療法的前世(下)
- 不只能夠「以毒攻毒」,當細菌從攻癌武器變成交通工具!細菌療法的今生(上)
- 不只能夠「以毒攻毒」,當細菌從攻癌武器變成交通工具!細菌療法的今生(下)
- 在以毒攻癌的同時,怎麼才不會毒死自己?細菌療法的挑戰與展望