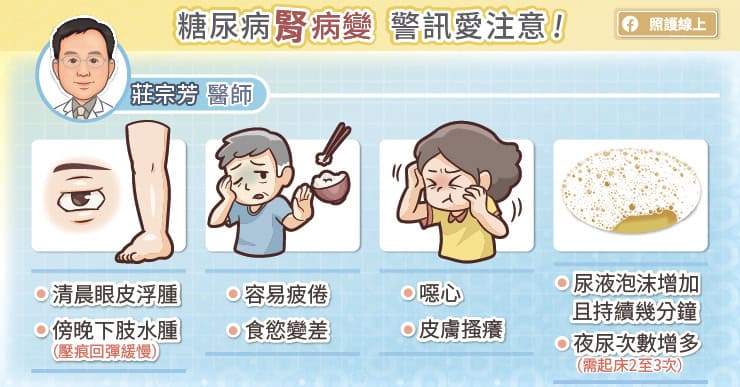
糖尿病(diabetes)似乎是有人類就有的疾病,早在西元前 1552 年埃及就有記載小便頻繁導致身體虛弱的現象。西元 200 年左右,希臘哲學家亞里斯多德首先使用 diabetes 來描述此一現象。在拉丁文裡,diabetes 是多尿的意思,與「糖」無關。1675 年威利斯(Thomas Willis)因病人尿中具甜味而加 mellitus(拉丁文意「甜」),稱為 diabetes mellitus;但現在均只簡稱為 diabetes。
在中國,西元前 200 年左右的醫學書《黃帝內經》中也載有頻尿、多渴、及身體虛弱的疾病,稱為「消渴」。西元 600 年左右,隋唐甄立言所著之《外台祕要》中謂「消渴小便至甜」應是中國有關糖尿病的最早記載。
儘管有如此淵源長久的歷史,但人類卻遲至 1920 年代才偶然地發現糖尿病的病因是胰臟內分泌胰島素不足所致;其醫治方法則只是不停地注射胰島素。當時胰島素的來源是豬、牛的胰臟。1970 年代初,生物科技技術「重組 DNA」(recombinant DNA)開始在大學裡萌芽之際,一位即將失業的麻省理工學院畢業生竟然看到了商機。他説服了「象牙塔」裡的一位教授,合組了世界第一家基因工程公司,在短短兩年內發展出了「人造」人類胰島素,率先敲響了到 2015 年已達 1330 億美元的生物科技產業革命之鐘!
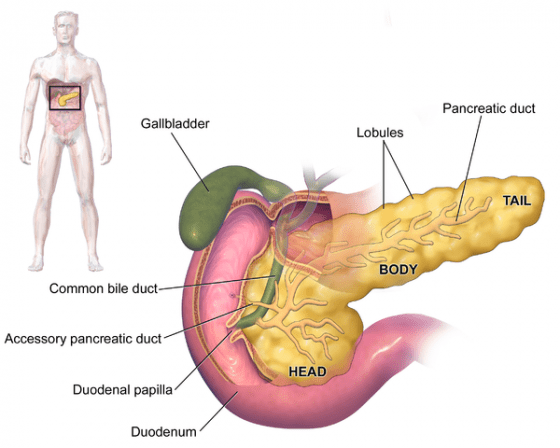
胰臟位於胃後,長約 15 公分,為一消化與內分泌系統。內有由三百萬細胞組成的許多呈星卵圓形蘭氏小島,按照染色的性質不同可分為四種細胞:
(1)α 細胞:分泌升糖素(glucagon)
(2)β 細胞:分泌胰島素(insulin)
(3)γ 細胞:分泌胰多肽(Pancreatic polypeptide, PP)
(4)δ 細胞:分泌生長抑制素(somatostatin)
患糖尿病者,診斷上以血糖升高及尿中含糖為特徵,一般分為二種:
(1)第一類糖尿病:胰島素分泌不足
(2)第二類糖尿病:不能充分利用胰島素;50% 的患者之 β 細胞在 5~10 年內均慢慢失去其功能
據世界衛生組織(WTO)2016 年 11 月的報導:
(1)全世界糖尿病病人數從 1980 年的 1.08 億增加到 2014 年的 4.22 億;
(2)全世界 18 歲以上成人糖尿病患病率從 1980 年的 4.7% 增加到 2014 年的 8.5%;
(3)糖尿病是失明、腎衰竭、心臟病發作、中風和下肢截肢的主要病因。
胰島素的發現雖然不能根治糖尿病,但卻讓患者能過著幾乎完全與正常人一樣的生活;「人造」人類胰島素的發明,開創了製造藥物的新紀元:生長激素、溶血栓蛋白質、B 型肝炎疫苗、紅血球生成素等生物科技產物不斷地相繼出現……希望讀者能與筆者一起在此分享這一段可歌、但不可泣的「胰島素與生技產業誕生」的醫學故事吧!
從胰臟的蘭氏小島說起
1869 年 2 月,德國柏林病理學學院的一位博士班學生蘭格漢(Paul Langerhans)提出一篇題為〈胰臟顯微解剖學的新知〉(Contributions to the Microscopic Anatomy of Pancreases)的論文,說明他在胃下面的脆弱葉狀器官胰臟內,發現許多不同於周邊之細胞小島,這些細胞群後來被稱為「蘭氏小島」(islets of Langerhans)。只是此時他雖然注意到了看起來像是神經的細胞,廣佈在這些細胞群內,但卻完全不清楚它們的功能。
1889 年,為了瞭解胰臟的功能,法國兩位外科手術醫生梅倫(Joseph von Mering)及明考斯基(Oskar Minkowski)將狗的胰臟割除,發現這隻可憐狗整天口渴及隨地小便。數日後,一位助手覺得實驗室內的蒼蠅好像突然多了起來,尤其是在狗小便過的地板。分析狗尿及其血液後,梅倫及明考斯基很驚奇地發現裡面充滿了糖份!顯然地,胰臟具調解體內糖份代謝的功能,它一旦受損將導致糖尿病。就這樣,梅倫及明考斯基無意中發現了「困擾」人類三千多年之糖尿病的病源(不過人們真正因糖尿病造成「困擾」可能是在 21 世紀吧)。
1895 年,沙佩-沙爾(Edward Albert Sharpey-Schafer)爵士提出糖尿病是因缺少一種由胰臟之「蘭氏小島」所製造出來的物質所致。他後來建議稱這一物質為 insuline,後改稱為 insulin(此字源自拉丁文 insula,意為小島),中文譯為「胰島素」,指胰臟小島分泌出來的激素。
胰島素的發現
可是這「胰島素」物質到底是什麼呢?由於胰臟也分泌蛋白質分解酶,可破壞胰島素,因此想從絞碎之胰臟中分離出胰島素的實驗,幾十年都沒什麼大進展。
1921 年初,加拿大多倫多大學講師班廷(Frederick Banting)醫生從巴倫(Moses Barron)文章中發現結紮胰臟管可悶死分泌蛋白分解酶的細跑,因此想到了一個可能分離出此物質的方法。但當時加拿大研究糖尿病的大師麥克勞德(John Macleod)教授卻不以為然,因此只答應給他一個實驗室、一些基本設備、十隻狗、及一位剛大學畢業的助理貝斯特(Charles Best)。同年 5 月 17 日,他們正式捲起袖子,在麥克勞德的「指導下」工作起來。7 月 30 日,他們將新方法所分離出來的物質注射到被割掉胰臟之狗的身體後,發現這些狗的血糖均大量下降!

麥克勞德終於有點相信了,因此建議進行更廣泛的實驗。這一來班廷及貝斯特當然不能再以「殺狗取胰」為業了,因之只好求助於附近的屠宰場:沒想到竟然「因禍得福」,他們發現豬、牛的「胰島素」不但具相同的功能,且根本不須先經胰臟結紮,新鮮冷凍的胰臟即可直接用來萃取胰島素(低溫顯然遲緩了蛋白質的分解)!
為了希望能早日進行人體試驗,班廷甚至以自己當試驗品,將萃取物注射到自己體內:班廷只感覺疲倦及頭暈,但未「生病」。到了 12 月,馬克里歐特已深信無疑,再請訪問教授生化學家柯立普(James B. Collip)加入團隊,負責純化萃取物的工作,以便進行人體試驗。
1922 年元月 11 日,他們將萃取物注射到患糖尿病、臨近死亡邊緣之 14 歲多倫多男孩湯姆生(J.Thompson)身上,很失望地發現竟然沒什麼改進。但他們並未灰心:在柯立普教授日以繼夜的純化工作下,12 天後他們再次將萃取物注射到該男孩身上時,不但發現他迅速恢復體力,食慾大幅提升、血液及尿中糖份恢復正常,一些糖尿病的症狀似乎也消失得無影無蹤!在此一發現之前,患了糖尿病等於判了死刑,是無藥可救的,只能靠飲食及運動來控制,一般大概都只能拖個一年左右而已。湯姆生靠著萃取物,一直活到 37 歲才因肺炎而病逝。此一成功的例子迅速地傳開,許多的自願者人體試驗也一樣有效,因此班廷不久就在多倫多開了一家專治糖尿病的診所。
諾貝爾醫學獎的爭議

這麼重大的發現當然躲不過諾貝爾獎委員們的耳目:他們很快地決定將 1923 年的諾貝爾醫學獎頒發給「因發現胰島素」的班廷及麥克勞德。才出道就得諾貝爾醫學獎,32 歲的班廷應該很高興才對(到 2016 年為止,他還是最年輕的醫學獎得主),沒想到他聽到諾貝爾獎委員的決定時,竟然火大地謂:怎麼不是他及貝斯特,而是他及麥克勞德?顯然又是一個有爭議性的諾貝爾獎[註 1]!為了聊以表達貝斯特的貢獻,他決定將他所得的現金與貝斯特平分;麥克勞德也因如果不是柯立普的純化技術,人體實驗是不可能成功的,而決定將他所得的現金與柯立波分享!
「貨惡其棄於地也,不必藏於己」,有這麼可賺大錢的發現,班廷的團隊卻在取得胰島素萃取的專利後,將其使用權完全免費地轉給加拿大多倫多大學[註 2]。1922 年,多倫多大學與製藥公司禮來(Eli Lilly)合作,在後者研發改進製程後,1923 年年底時,已能大量生產足夠供應整個北美洲所需、純度相當高的胰島素。胰島素是禮來歷史上最重要的藥物:禮來因它而成為世界主要製藥大廠之一!
解密胰島素的化學構造
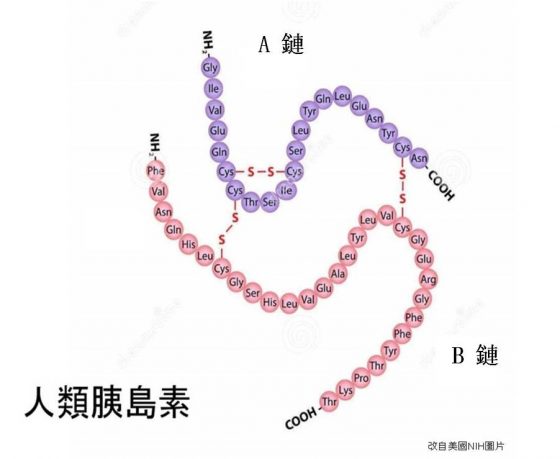
桑格(Frederick Sanger)於 1936 年進入英國劍橋大學的聖約翰學院,準備攻讀自然科學。但因不善物理及數學,一年後即將物理改為生理,以第一名畢業於剛成立不久之生物化學系;1943 年以「動物體內之離胺基酸(Lysine)的新陳代謝」取得博士學位後,即加入奇布諾爾(Albert Chibnall)團隊工作。奇布諾爾早就在研究胰島素的胺基酸成份,因此當了系主任後建議桑格繼續其未完成的工作。胰島素是當時已知之非常少數的純化蛋白質,在一般藥店即可買到。桑格果然不失所望,於 1951 年及 1952 年分別確定了牛胰島素中 A、B 兩鏈的胺基酸序列定序(類似下圖的人類胰島素胺基酸序列)!
以今日之技術來看,這或許不是什麼大成就,但不要忘了當時大部分的生化學家均認為蛋白質是一無定形或組成的物質!
事實上是桑格這一發現——蛋白質有固定的化學構造——以及他一系列的演講,使發現 DNA 雙螺旋結構的克里克(Francis Crick)於 1958 年提出了現今已為大眾所接受之理論:遺傳基因物質(DNA 或 RNA)的核酸序列(遺傳碼)決定了其「指導」合成之蛋白質的組成(胺基酸序列);而蛋白質的組成進而決定其立體結構及性質。反過來説,如果我們知道蛋白質的組成,我們也可推算出決定此蛋白質之基因的核酸序列[註 3]。
單獨的 A、B 兩鏈沒有胰島素的功能;在桑格團隊的不懈工作下,他們終於在 1955 年成功地確定了歷史上第一個蛋白質「胰島素」的化學構造:由 21 個胺基酸組成的 A 鏈與由 30 個胺基酸組成的 B 鏈是靠兩個雙硫鍵連在一起,而短的 A 鏈中間又靠另一雙硫鍵聯結彎曲。桑格也因此於 1958 年藉由「蛋白質(尤其是胰島素)的構造研究」,得了他的第一個諾貝爾化學獎。
德國化學家梅爾荷費(J. Meierhofer)等人於 1963 年首次在實驗室中(化學)合成人類胰島素。1966 年時在中國及美國也有人工合成胰島素的報導。1974 年 Ciba‑Geigy 製藥公司[註 4]曾嘗試以合成法製造人類胰島素,但因太複雜、產量太低等經濟因素而作罷。因此儘管 2,000 公斤的豬胰臟大約只能萃取 30 公克的胰島素,人造胰島素一直無法與萃取的動物胰島素抗衡!豬的胰島素與人類的胰島素最相近,只差一個胺基酸而已;而牛的胰島素則具三個異於人類的胺基酸。顯然在脊椎動物的進化過程中,胰島素尚未分岔太遠:我們的防禦系統竟不掀旗反抗外來的動物胰島素!
(繼續接著看:〈人造胰島素開啟生技產業——胰島素與生技產業的誕生(下)〉)
註解:
- 1. 賴昭正,〈諾貝爾獎的爭議性〉,《科學月刊》,2016 年 12 月號。
- 2. 多麼高尚的情操。反觀國內,士林地檢署偵辦「浩鼎案」,元月 9 日偵結,認定前中研院院長翁啟惠及浩鼎董事長張念慈(在技轉)涉期約收受賄賂及行賄罪嫌,決定起訴。
- 3. 賴昭正,〈左旋還是右旋?化學對稱跟你我的身體有關!〉,泛科學,2015/9/25。
- 4. 於 1996 年與 Sandoz 合併成今日之瑞士的國際大藥廠 Novartis。