- 作者/照護線上編輯部
- 本文轉載自 Care Online 照護線上《健保給付肝癌晚期一線治療新利器:免疫治療合併抗血管新生標靶 五大關鍵解析》,歡迎喜歡這篇文章的朋友訂閱支持 Care Online 喔
- 加入照護線上 LINE 官方帳號,健康資訊不漏接

肝癌晚期一直以來面臨低存活率的挑戰。隨著醫學進展,免疫治療加上抗血管新生標靶藥物的出現,才讓肝癌晚期有新的希望。為了讓大家了解肝癌晚期治療的最新發展,照護線上邀請台灣大學醫學院內科臨床副教授暨台大癌醫中心醫院腫瘤內科部的林宗哲醫師,來解答 5 個關鍵問題。
第 1 問:肝癌晚期在傳統治療上面臨的困境為何?大多數患者是否沒機會進行根除性手術?
肝癌是台灣常見的癌症之一,由於早期沒有症狀,直到出現黃疸、腹脹等症狀時,已進展為肝癌晚期。此時,因腫瘤較大,甚至侵犯血管或轉移至其他器官,大多數患者診斷時已無法進行手術根除腫瘤。林宗哲醫師表示,早年晚期肝癌的治療選擇有限,治療成效也不甚理想。雖然十多年前開始有口服標靶藥物的出現,稍微改善了患者的存活期,但其腫瘤反應率仍不到 10%,並未大幅改變治療結果。
第 2 問:肝癌晚期第一線治療有漸漸轉變為免疫治療合抗血管新生標靶的趨勢嗎?這樣的組合治療效果如何?
林宗哲醫師表示,在缺乏有效標靶或免疫治療藥物的年代,晚期肝癌患者的存活期僅有 3 到 4 個月。之後開始使用單一標靶藥物治療,存活期雖然可達到 6 個月至 1 年,但是整體療效進展仍然比較不顯著。而如今,免疫治療合併抗血管新生標靶的出現,讓晚期肝癌患者的存活期達到近 20 個月,而且死亡風險下降了約 30% 到 35%,對於肝癌晚期的臨床治療來說,是突破性的發展。
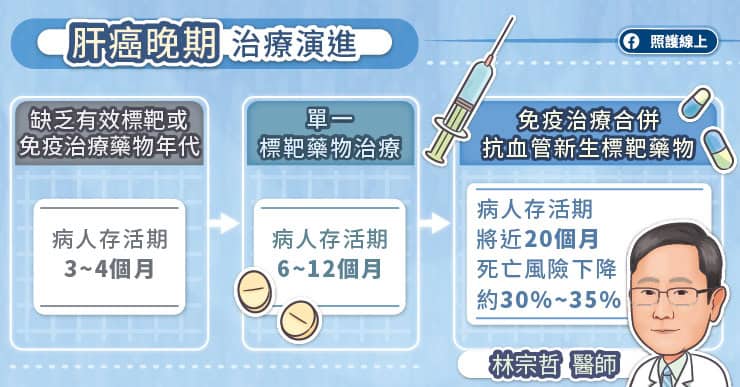
隨著大規模臨床試驗發現,免疫治療加上抗血管新生標靶藥物能顯著提升治療反應率達 30%。林宗哲醫師指出,目前國際上已有共識,國際權威 NCCN 肝癌治療指引也建議將免疫合併標靶治療納入肝癌晚期的第一線治療。
第 3 問:免疫治療合併抗血管新生標靶的機轉為何?為何能大幅提升反應率?
免疫藥物為免疫檢查點抑制劑(PD-L1 抑制劑)。林宗哲醫師解釋,人體的免疫系統中,T 細胞可辨識並殺死癌細胞。然而,當肝癌細胞表面的 PD-L1 與 T 細胞表面的 PD-1 接合時,就像給 T 細胞踩了剎車,使 T 細胞受到抑制無法辨認且攻擊癌細胞。PD-L1 抑制劑可以阻斷 T 細胞與癌細胞接合,喚醒 T 細胞活性,得以再度辨識並殺死癌細胞。
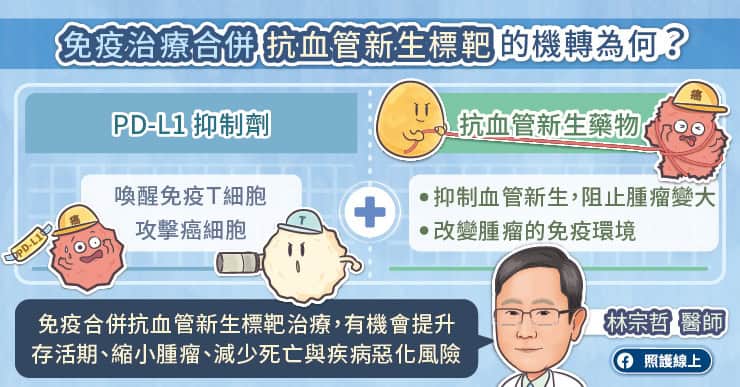
研究顯示,PD-L1 抑制劑結合抗血管新生標靶藥物後,治療效果大幅提升。林宗哲醫師推測,這可能是因為抗血管新生標靶藥物,除了抑制血管新生,阻止腫瘤變大,還能改變腫瘤周圍的免疫環境,大幅增加腫瘤微環境被活化的T細胞數量,從而增強對肝癌細胞的殺傷效果。
第4問:免疫治療合併抗血管新生標靶對肝癌晚期患者帶來的優勢為何?
肝癌晚期治療需要權衡療效與副作用。免疫治療合併抗血管新生標靶可以提高反應率、縮小腫瘤,進而延長患者的整體存活時間和腫瘤無進展存活時間,並降低死亡風險與疾病惡化風險。林宗哲醫師說,如果腫瘤縮小到可以開刀的程度,便有機會接受手術,甚至有痊癒的可能。

相比傳統化療,免疫治療合併抗血管新生標靶的副作用較少,且患者更易承受,治療期間生活品質也較佳。
第 5 問:免疫合併抗血管新生標靶有納入健保給付了嗎?第一線肝癌晚期患者就能申請嗎?
免疫合併抗血管新生標靶治療已於 2023 年 8 月納入肝癌晚期第一線治療的健保給付範圍,病患可主動與醫師討論是否符合申請條件。林宗哲醫師說,適用條件為未曾接受過全身性治療的轉移性或無法手術切除且不適合局部治療或局部治療失敗的 Child-Pugh A class 晚期肝癌患者。
林宗哲醫師分享了肝癌晚期的案例,三年前,一位中年男性患者在健保尚未給付的情況下,接受免疫合併抗血管新生標靶治療。經過一年的治療,腫瘤顯著縮小,達到可以手術切除的程度。手術後保持電腦斷層和核磁共振檢查不到腫瘤,持續接受治療一年才停止治療並持續追蹤。停藥後已保持超過一年以上無疾病復發。
林宗哲醫師最後提醒,免疫治療合併抗血管新生標靶讓肝癌晚期的治療成效大幅提升,而且健保也有給付,減少治療所需的經濟負擔,患者應與醫師詳細討論與密切配合,爭取最佳的治療效果和存活預後。
- 本文轉載自 Care Online 照護線上《健保給付肝癌晚期一線治療新利器:免疫治療合併抗血管新生標靶 五大關鍵解析》,歡迎喜歡這篇文章的朋友訂閱支持 Care Online 喔
- 加入照護線上 LINE 官方帳號,健康資訊不漏接