
在這深一千米,連陽光發出的紅色波長都無法
科學家觀察章魚(Japetella
翻譯:陸子堯
資料來源:ScienceShot:Blue Light Turns an Octopus Red[10 November 2011]

在這深一千米,連陽光發出的紅色波長都無法
科學家觀察章魚(Japetella
翻譯:陸子堯
資料來源:ScienceShot:Blue Light Turns an Octopus Red[10 November 2011]
本文與 PAMO車禍線上律師 合作,泛科學企劃執行
走在台灣的街頭,你是否發現馬路變得越來越「急躁」?滿街穿梭的外送員、分秒必爭的多元計程車,為了拚單量與獎金,每個人都在跟時間賽跑 。與此同時,拜經濟發展所賜,路上的豪車也變多了 。
這場關於速度與金錢的博弈,讓車禍不再只是一場意外,更是一場複雜的經濟算計。PAMO 車禍線上律師施尚宏律師在接受《思想實驗室 video podcast》訪談時指出,我們正處於一個交通生態的轉折點,當「把車當生財工具」的職業駕駛,撞上了「將車視為珍貴資產」的豪車車主,傳統的理賠邏輯往往會失靈 。
在「停工即停薪」(有跑才有錢,沒跑就沒收入)的零工經濟時代,如果運氣不好遇上車禍,我們該如何證明自己的時間價值?又該如何在保險無法覆蓋的灰色地帶中全身而退?

過去處理車禍理賠,邏輯相對單純:拿出公司的薪資單或扣繳憑單,計算這幾個月的平均薪資,就能算出因傷停工的「薪資損失」。
但在零工經濟時代,這套邏輯卡關了!施尚宏律師指出,許多外送員、自由接案者或是工地打工者,他們的收入往往是領現金,或者分散在多個不同的 App 平台中 。更麻煩的是,零工經濟的特性是「高度變動」,上個月可能拚了 7 萬,這個月休息可能只有 0 元,導致「平均收入」難以定義 。
這時候,律師的角色就不只是法條的背誦者,更像是一名「翻譯」。
施律師解釋「PAMO車禍線上律師的工作是把外送員口中零散的『跑單損失』,轉譯成法官或保險公司聽得懂的法律語言。」 這包括將不同平台(如 Uber、台灣大車隊)的流水帳整合,或是找出過往的接單紀錄來證明當事人的「勞動能力」。即使當下沒有收入(例如學生開學期間),只要能證明過往的接單能力與紀錄,在談判桌上就有籌碼要求合理的「勞動力減損賠償 」。

根據警政署統計,台灣交通違規的第一名常年是「違規停車」,一年可以開出約 300 萬張罰單 。這龐大的數字背後,藏著兩個台灣駕駛人最容易誤判的「直覺陷阱」。
陷阱 A:我在紅線違停,人還在車上,沒撞到也要負責? 許多人認為:「我人就在車上,車子也沒動,甚至是熄火狀態。結果一台機車為了閃避我,自己操作不當摔倒了,這關我什麼事?」
施律師警告,這是一個致命的陷阱。「人在車上」或「車子沒動」在法律上並不是免死金牌 。法律看重的是「因果關係」。只要你的違停行為阻礙了視線或壓縮了車道,導致後方車輛必須閃避而發生事故,你就可能必須背負民事賠償責任,甚至揹上「過失傷害」的刑責 。
數據會說話: 台灣每年約有 700 件車禍是直接因違規停車導致的 。這 300 萬張罰單背後的僥倖心態,其巨大的代價可能是人命。
陷阱 B:變換車道沒擦撞,對方自己嚇到摔車也算我的? 另一個常年霸榜的肇事原因是「變換車道不當」 。如果你切換車道時,後方騎士因為嚇到而摔車,但你感覺車身「沒震動、沒碰撞」,能不能直接開走?
答案是:絕對不行。
施律師強調,車禍不以「碰撞」為前提 。只要你的駕駛行為與對方的事故有因果關係,你若直接離開現場,在法律上就構成了「肇事逃逸」。這是一條公訴罪,後果遠比你想像的嚴重。正確的做法永遠是:停下來報警,釐清責任,並保留行車記錄器自保 。

另一個現代駕駛的惡夢,是撞到豪車。這不僅是因為修車費貴,更因為衍生出的「代步費用」驚人。
施律師舉例,過去撞到車,只要把車修好就沒事。但現在如果撞到一台 BMW 320,車主可能會主張修車的 8 天期間,他需要租一台同等級的 BMW 320 來代步 。以一天租金 4000 元計算,光是代步費就多了 3 萬多塊 。這時候,一般人會發現「全險」竟然不夠用。為什麼?
因為保險公司承擔的是「合理的賠償責任」,他們有內部的數據庫,只願意賠償一般行情的修車費或代步費 。但對方車主可能不這麼想,為了拿到這筆額外的錢,對方可能會採取「以刑逼民」的策略:提告過失傷害,利用刑事訴訟的壓力(背上前科的恐懼),迫使你自掏腰包補足保險公司不願賠償的差額 。
這就是為什麼在全險之外,駕駛人仍需要懂得談判策略,或考慮尋求律師協助,在保險公司與對方的漫天喊價之間,找到一個停損點 。
除了有單據的財損,車禍中最難談判的往往是「精神慰撫金」。施律師直言,這在法律上沒有公式,甚至有點像「開獎」,高度依賴法官的自由心證 。
雖然保險公司內部有一套簡單的算法(例如醫療費用的 2 到 5 倍),但到了法院,法官會考量雙方的社會地位、傷勢嚴重程度 。在缺乏標準公式的情況下,正確的「態度」能幫您起到加分效果。
施律師建議,在談判桌上最好的姿態是「溫柔而堅定」。有些人會試圖「扮窮」或「裝兇」,這通常會有反效果。特別是面對看過無數案件的保險理賠員,裝兇只會讓對方心裡想著:「進了法院我保證你一毛都拿不到,準備看你笑話」。
相反地,如果你能客氣地溝通,但手中握有完整的接單紀錄、醫療單據,清楚知道自己的底線與權益,這種「堅定」反而能讓談判對手買單,甚至在證明不足的情況下(如外送員的開學期間收入),更願意採信你的主張 。
在這個交通環境日益複雜的時代,無論你是為了生計奔波的職業駕駛,還是天天上路的通勤族,光靠保險或許已經不夠。大部分的車禍其實都是小案子,可能只是賠償 2000 元的輕微擦撞,或是責任不明的糾紛。為了這點錢,要花幾萬塊請律師打官司絕對「不划算」。但當事人往往會因為資訊落差,恐懼於「會不會被告肇逃?」、「會不會留案底?」、「賠償多少才合理?」而整夜睡不著覺 。
PAMO看準了這個「焦慮商機」, 推出了一種顛覆傳統的解決方案——「年費 1200 元的訂閱制法律服務 」。
這就像是「法律界的 Netflix」或「汽車強制險」的概念。PAMO 的核心邏輯不是「代打」,而是「賦能」。不同於傳統律師收費高昂,PAMO 提倡的是「大腦武裝」,當車禍發生時,線上律師團提供策略,教你怎麼做筆錄、怎麼蒐證、怎麼判斷對方開價合不合理等。
施律師表示,他們的目標是讓客戶在面對不確定的風險時,背後有個軍師,能安心地睡個好覺 。平時保留好收入證明、發生事故時懂得不亂說話、與各方談判時掌握對應策略 。

從違停的陷阱到訂閱制的解方,我們正處於交通與法律的轉型期。未來,挑戰將更加嚴峻。
當 AI 與自駕車(Level 4/5)真正上路,一旦發生事故,責任主體將從「駕駛人」轉向「車廠」或「演算法系統」 。屆時,誰該負責?怎麼舉證?
但在那天來臨之前,面對馬路上的豪車、零工騎士與法律陷阱,你選擇相信運氣,還是相信策略? 先「武裝好自己的大腦」,或許才是現代駕駛人最明智的保險。
PAMO車禍線上律師官網:https://pse.is/8juv6k
討論功能關閉中。
唉!好曬呀!前兩集,一些觀眾發現我曬黑了。
在臺灣,一向不缺陽光。市面上,美白、防曬廣告亦隨處可見,不過,為什麼我們會被陽光曬傷呢?卻又好像沒聽過被日光燈曬傷的事情?
事實上,這也跟量子力學有關,而且和我們今天的主題密切連結。
之前我們討論到量子概念在歷史上的起點,接下來,我們會進一步說明,量子概念是如何被發揚光大,以及那個男人的故事。
在量子力學發展過程中,光電效應的研究是非常重要的轉捩點。
光電效應指的是,當一定頻率以上的光或電磁波照射在特定材料上,會使得材料發射出電子的現象。
在 19 世紀後期,科學家就已經發現某個奇特的現象:使用光(尤其是紫外線)照射帶負電的金屬板,會使金屬板的負電消失。但當時他們並不清楚背後原理,只猜測周遭氣體可能在紫外線的照射下,輔助帶負電的粒子從金屬板離開。
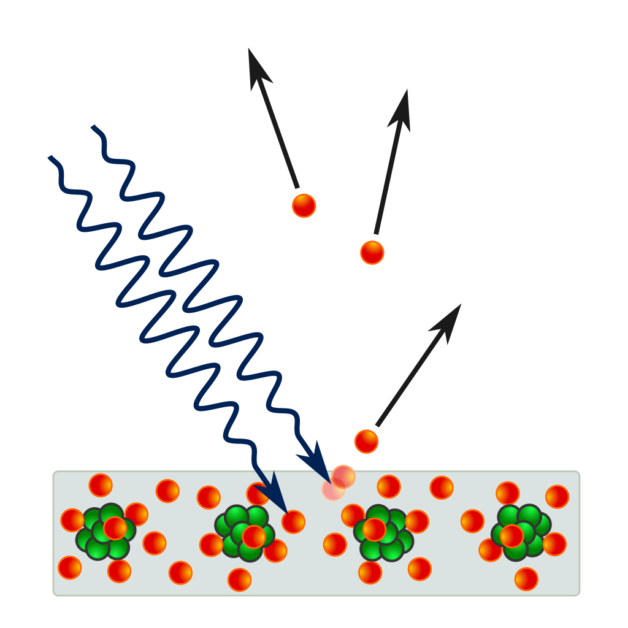
於是 1899 年,知名的英國物理學家 J. J. 湯姆森將鋅板放置在低壓汞氣之中,並照射紫外線,來研究汞氣如何幫助鋅板釋放負電荷,卻察覺這些電荷的性質,跟他在兩年前(1897 年)從放射線研究中發現的粒子很像。
它們是比氫原子要輕約一千倍、帶負電的微小粒子,也就是我們現在稱呼的電子。
1902 年,德國物理學家萊納德發現,即使是在抽真空的玻璃管內,只要照射一定頻率以上的光,兩極之間便會有電流通過,電流大小跟光的強度成正比,而將光線移除之後,電流也瞬間消失。
到此,我們所熟知的光電效應概念才算完整成型。
這邊聽起來好像沒什麼問題?然而,若不用現在的量子理論,只依靠當時的物理知識,很難完美解釋光電效應。因為根據傳統理論,光的能量多寡應該和光的強度有關,而不是光的頻率。
如果是光線把能量傳給電子,讓電子脫離金屬板,那為什麼需要一定頻率以上的光線才有用呢?比如我們拿同樣強度的紫外線跟紅外線去照射,會發現只有照射紫外線的金屬板才會產生電流。而且,當紫外線的頻率越高,電子的能量就越大。
另一方面,若我們拿很高強度的紅外線去照射金屬板,會發現無論如何都不會產生電流。但如果是紫外線的話,就算強度很低,還是會瞬間就產生電流。
這樣難以理解的光電效應,使得愛因斯坦於 1905 年一舉顛覆了整個物理學界,並建立了量子力學的基礎。
為了解釋光電效應,愛因斯坦假設,電磁波攜帶的能量是以一個個帶有能量的「光量子」的形式輻射出去。並參考先前普朗克的研究成果,認為光量子的能量 E 和該電磁波的頻率 ν 成正比,寫成 E=hν,h 是比例常數,也是我們介紹過的普朗克常數。
在愛因斯坦的詮釋下,電磁波的頻率越高,光子能量就越大,所以只要頻率高到一定程度,就能讓電子獲得足以逃脫金屬板的能量,形成電流;反過來說,如果電磁波的頻率不夠高,電子無法獲得足夠能量,就無法離開金屬板。
這就像是巨石強森一拳 punch 能把我打昏,但如果有個弱雞用巨石強森百分之一的力道打我一百拳,就算加起來總力道一樣,我是不會被打昏,大概也綿綿癢癢的,不覺得受到什麼傷害一樣。
而當電磁波的強度越強,代表光子的數目越多,於是脫離金屬板的電子自然變多,電流就越大。就如同我們挨了巨石強森很多拳,受傷自然比只挨一拳要來得重。
雖然愛因斯坦對光電效應的解釋看似完美,但是光量子的觀點實在太過激進,難以被當時的科學家接受,就連普朗克本人對此都不太高興。
對普朗克來說,基本單位能量 hν,是由虛擬的「振子」發出的;但就愛因斯坦而言,電磁波本身的能量就是一個個光量子,或現在所謂的「光子」。
然而,電磁波屬於波動,直觀來說,波是綿延不絕地擴散到空間中,怎麼會是一個個攜帶最小基本單位能量的能量包呢?
美國物理學家密立根就堅信愛因斯坦的理論是錯的,並花費多年時間進行光電效應的實驗研究。
到了 1914 年,密立根發表了世界首次的普朗克常數實驗值,跟現在公認的標準數值 h=6.626×10-34 Js(焦耳乘秒)相距不遠。
在論文中,密立根更捶心肝(tuî-sim-kuann)表示,實驗結果令人驚訝地與愛因斯坦那九年前早就被人拋棄的量子理論吻合得相當好。
這下子,就算學界不願相信愛因斯坦也不行了。愛因斯坦也因為在光電效應的貢獻,獲得 1921 年的諾貝爾物理獎。

在現代,光電效應的用途廣泛。我們日常生活中常見的太陽能發電板,利用的就是光電效應的一種,稱為光生伏打效應,材料內部的電子在吸收了光子的能量後,不是放射到周遭空間,而是在材料內部移動,形成正負兩極,產生電流。
而會不會曬傷也跟光子的能量有關。
曬傷是皮膚受到頻率夠高的太陽光,也就是紫外線裡的 UVB 輻射造成的損傷。這些光子打到皮膚,會讓 DNA 分子裡構成鍵結的電子逃逸,引起皮膚細胞中 DNA 的異常變化,導致細胞損傷和免疫反應,這就是為什麼曬傷後皮膚會出現紅腫、疼痛和發炎的原因。
而頻率較低的光線,因為光子能量偏低,所以就不太會造成傷害,這也是為什麼我們沒聽過被日光燈曬傷這種事。
從 17 世紀後半,惠更斯和牛頓各自提出光的波動說和微粒說開始,人們就聚焦於光到底是波動還是粒子的大哉問;19 世紀初,湯瑪士.楊用雙狹縫干涉實驗顯示了光的波動性,而到 19 世紀中後期,光屬於電磁波的結論終於被馬克士威和赫茲分別從理論和實驗兩方面確立。
經過約莫兩百年的研究發展,世人才明白,光是一種波動。
怎知,沒過幾年,愛因斯坦就跳出來主張光的能量由一個個的光量子攜帶,還通過實驗的檢驗——光又成為粒子了。
物理學家不得不承認,光具有波動和粒子兩種性質,而會呈現哪一種特性則依情況而定,稱為光的波粒二象性。
愛因斯坦於 1905 年提出的光量子概念,顛覆了傳統認為波動和粒子截然二分的觀點,將光能量量子化的詮釋也被實驗印證,在那之後,除了光的能量之外,還有其他物理量被發現是「量子化」的,像是電荷。
我們現在知道,電荷也有個基本單位,就是單一電子攜帶的電荷大小。
儘管之後又發現組成原子核的夸克,具有 -1/3 和 +2/3 單位的基本電荷,但並沒有改變電荷大小是不連續的這件事,並不是要多少的電量都可以。
如果你覺得很奇怪,不妨想想,我們用肉眼看會覺得身體的每一個部位都是連續的,但其實在微觀尺度,身體也是由一個個很小的原子和分子組成,只是我們根本看不出來,才覺得是連續的。
光子的能量和電荷的大小,其實也是像這樣子,細分下去就會發現具有最基本的單位,不是連續的。
事實上,量子力學在誕生之後,一直不斷地為人們帶來驚喜,簡直就是物理學界突然闖進一隻捉摸不定的貓。我們下一個故事,就要來聊量子力學發展過程中,打破世間常識的某個破天荒假說,而假說的提出者,是大學原本主修歷史和法律,擁有歷史學士學位,但後來改念物理,並憑藉博士論文用 5 年時間就拿到諾貝爾物理學獎的德布羅意。
歡迎訂閱 Pansci Youtube 頻道 獲取更多深入淺出的科學知識!
討論功能關閉中。
雖然章魚通常不和同類打交道,和其他種類動物之間的關係,除了獵捕和被吃之外,也幾乎都不清楚。如果要在家飼養頭足類動物,專家的建議是不要把牠們和其他水族養在同一個水槽中,因為章魚可能會吃掉牠們。
不過章魚對於同槽水族也並非都處在敵對狀態。溫哥華水族館的館員丹尼.肯特(Danny Kent)發現在卑詩省水域展區中,「有些章魚能夠和許多石斑魚一起生活多年,不會吃牠們,但是有些章魚就會迫不及待的把同水槽中的其他動物吃掉。」
在這座水族館容量高達六萬五千加侖( 25 萬公升)的「喬治亞海峽」(Strait of Georgia)展示槽中,有一條章魚喜歡爬到接近水面的岩石上,把一條腕伸到流下的水柱中。肯特發現這條章魚把腕當成釣魚線,等著鯡魚撞到腕,就把鯡魚抓來吃。
同槽水族之間的關係也可能非常複雜。2000 年,西雅圖水族館做了一個很冒險的決定:把一條北太平洋巨型章魚放到四萬加侖(15 萬公升)的水槽中,裡面有數條一公尺多長的白斑角鯊(dogfish shark,Squalus acanthias),他們覺得章魚如果受到鯊魚的威脅時,會好好躲著。但是他們錯了。
他們非常驚訝章魚非但沒有受到威脅,反而有計畫地逐一殺死了那些白斑角鯊(重現這個意外的影片在 2007 年放上網路後便瘋傳,有 290 萬人看過這個影片,也都非常驚訝)。研究人員發現鯊魚沒有消失,但是死亡了,沒有被吃掉。章魚沒有獵食牠們,也沒有因為直接威脅而馬上逃走。
根據最原始的新聞報導和影片的字幕,在鯊魚進行瘋狂殺戮之前,章魚就先發制人,進行攻擊。在鯊魚還沒有機會造成威脅之前,章魚就先把有可能掠食自己的動物殺死了。
在科蘇美,我親眼目睹了另一個不同的跨物種互動,我從來沒有看到有人報告過這樣的景象。
在這趟旅程中最後一次潛水時,我們前往的礁岩樸實無華,沒有幾個大朵的珊瑚頭,也沒有許多突出的長礁與岩石。在潛水半個小時後,我們下潛到約十公尺深,這時看到在突出岩塊下的白沙子上,有一條加勒比礁章魚(Caribbean reef octopus,Octopus briareus)。
我靠近到兩公尺,發現在章魚前面幾公分的位置,大約有十幾隻活螃蟹聚集,有紅的也有黑的,身體的殼約五、六公分大。這些螃蟹看起來非常平靜,想到這些螃蟹所處的狀況,我極為驚訝。有些螃蟹慢慢爬著,如果有一隻螃蟹想要遠離章魚,章魚便伸出腕,把螃蟹(我認為非常溫柔地)撥回來。
這個狀況非常詭異。章魚的周圍是牠最喜歡的食物,但是牠並沒有因為興奮而變成紅色。牠的皮膚是白色的,夾雜了些明亮的藍色。章魚並沒有用吸盤把溜走的螃蟹抓回來,而是用腕把螃蟹掃到自己面前。螃蟹沒有急忙逃脫,這也很奇怪。
另外,我在旁邊沒有看到有螃蟹殼和其他殘骸,章魚巢穴外面通常會有這些東西。不過這裡可能不是那條章魚的巢穴。不論如何,這裡的螃蟹也太多了,牠們或許是站在以前同伴留下的外骨骼上,但是我也沒有看到。章魚看了我一眼,就回去專心看顧那些螃蟹了。就算我近到只有一公尺,牠也沒有退避。
我想在這裡待久一點,但是海流強勁,我們是在放流潛水中,停不住。後來我問水族館中的朋友:那些螃蟹在幹什麼?為什麼不逃走?那條章魚在打什麼注意?章魚為什麼要看顧這群螃蟹?我半開玩笑地拋出一個點子:那條章魚是不是用墨汁對那些螃蟹下藥了?
美國海洋動物學家馬吉尼蒂夫婦(G. E. and Nettie MacGinitie)有次把一條熱帶海鰻放到有泥灘章魚(mudflat octopus)的水槽中。熱帶海鰻開始尋找章魚,章魚在牠靠得太近的時候,便對牠噴墨汁。熱帶海鰻會繼續狩獵,但是不會攻擊章魚。就算熱帶海鰻真的觸碰到章魚,也不會想要攻擊章魚或是吃掉章魚。每次都這樣。
章魚的墨汁中含有黑色素(melanin),以及其他有重要生物功能的成分,其中一種是酪胺酸酶(tyrosinase),這種酵素能刺激眼睛,並堵住鰓。不過它可能還有其他效果。
1962 年,《英國藥理學期刊》(British Journal of Pharmacology)上有一篇論文指出,這種酵素能夠阻礙催產素(「擁抱激素」)與血管升壓素(vasopressin)1這兩種激素的活性。鳥類、爬行動物、無脊椎動物(包括章魚)等,都有個別的催產素和增壓素,哺乳動物的催產素曾經試驗用在魚身上,結果改變了魚的社會性行為。
如果這種激素正常的濃度受到影響,那麼像螃蟹這樣獨居的動物,可能會變得特別平靜,還能聚集在一起,面對主要掠食動物時也依然如此。
——本書摘自《章魚的內心世界》,2019 年 9 月,馬可孛羅。

在這深一千米,連陽光發出的紅色波長都無法
科學家觀察章魚(Japetella
翻譯:陸子堯
資料來源:ScienceShot:Blue Light Turns an Octopus Red[10 November 2011]