人腦的神經運作向來難倒大批科學家,因為人腦擁有一千億個神經元,百億條以上的神經連結。如此錯綜複雜,就像打結成一團的毛線球,究竟該從哪邊開始解?這時,就要使出研究學者通用的訣竅——化繁為簡,越複雜的問題,就用越簡單的雛型為思考出發點。
因此,一群學者發現了一個「極簡風」的研究雛型——水母,那透明小巧的身軀,再結合特殊工具,讓牠們每條神經都發光。在我們的視野下,水母的神經「坦誠相見」,接著發現了很多有趣的現象……欲知詳情,就繼續給他看下去!
為何水母是絕佳的實驗對象?
一般研究人類疾病的實驗室採用的實驗動物(也稱模式生物)無非是小鼠、黑猩猩、豬,因為這些動物與人類的親緣關係較近,生理機制也較為雷同。然而,為何研究神經系統,要拿與人類親緣關係一點都不近的水母來研究呢?研究學者對此給出解釋:一部分的學者認為所有生物的神經系統可能共享同一個神經科學原理,因此為了深入調查這個「共享通則」,相較於其他生物,水母小巧好操作,軀體透明好觀察。
- 延伸閱讀:協助人類健康的大功臣「模式生物」
最重要的是,牠體內的神經分布不像人腦如毛線球般集中在身體的某個部位,而是像一張漁網一樣「分散式」地遍佈全身,而這樣的神經系統優勢就在於即便將牠身體的一小部分獨立分離出來,這一部分仍能正常運行,例如網路火紅的迷因「歸剛欸」水母(影片一),即便水母的嘴被分離了,但這張「獨立的」嘴還是可以正常進食的呦!
相形之下,人類神經細胞一旦離開人體就非常脆弱,在培養皿中一定要有足夠的營養才能支撐它存活(相信養過人類神經細胞的朋朋們一定懂當中辛酸)。因此,綜合操作難易度、觀察便利性、神經細胞的生存韌性,水母可說是作為研究神經系統模式生物的不二人選。另外,還有一個有趣的點即是水母沒有大腦、心、肺,那它究竟是如何進食的呢?以下揭曉答案!
如何研究水母的神經?
早期為了研究水母的神經,通常採用單一神經元電生理紀錄(single-unit electrophysiological recordings),透過一個微小細尖的微電極靠在細胞膜附近,以記錄神經元產生的動作電位變化,但是這個方法只能看到單一神經元的狀態,而當水母在做出反應、活動時,都是由好幾個神經細胞們一同作用產生的,所以這個方法可說是見樹不見林,缺乏整體系統性的觀察。
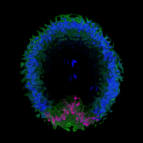
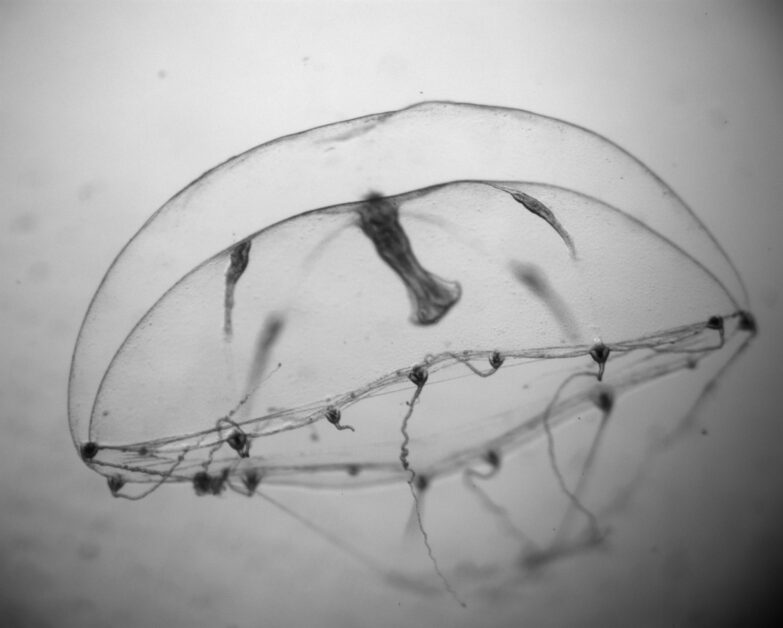
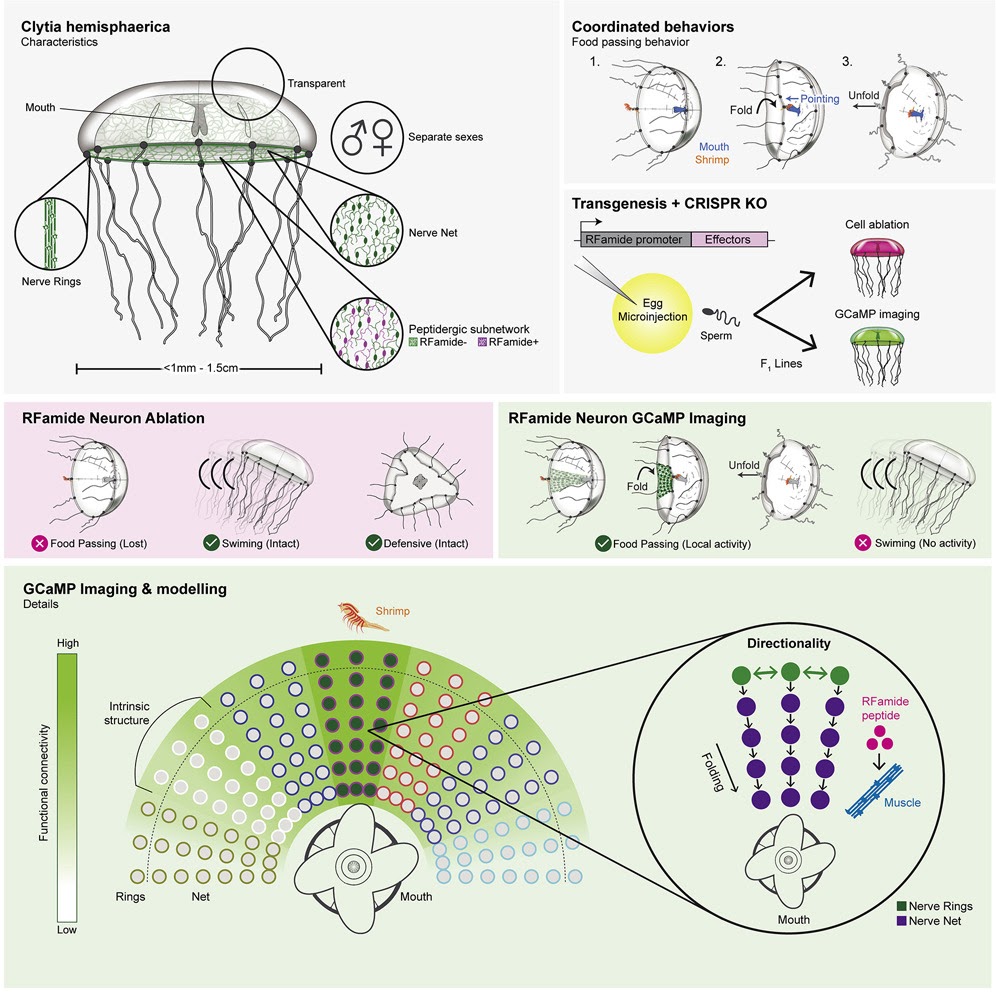
因此科學家們又發明出了一個新方法——基因轉殖水母,要施展這個方法的第一步就是尋覓合適的研究主角,因此他們找到一種名為 Clytia hemisphaerica (圖一)的水螅綱水母,牠擁有嬌小體積(直徑約 1 釐米),且生命週期短,也擁有完整的基因定序,在實驗室操作的便利性極高,可謂是命定首選。
其中, Clytia hemisphaerica 還有更吸引人的一點,即是在進食時,其特定神經元會釋放一種特別的肽 RFamide(RFa)。為了追蹤這種肽如何影響水母的神經活動,一群學者決定將能發出紅螢光的 mCherry 基因質體(plasmid)與 Tol2 轉位酶(Tol2 transposase)[1]顯微注射入大量的水母受精卵當中,以便追蹤身體每一處細胞的位置,並挑選能夠強烈表現出紅螢光基因的受精卵,進而將牠們培養成成體(初代,F0)。這些成體會再跟牠們的親代進行雜交,透過遺傳的方式產生穩定表現轉殖基因的子代(F1),並讓這些子代維持無性繁殖,以維持基因表現的穩定性。
除了在質體上裝載能讓細胞發紅光的 mCherry,學者也會在質體中放入特定基因,讓子代水母表現此種基因,並觀察此基因對水母進食行為帶來的影響。另外,若要探討神經動作電位,鈣離子的流動狀態一定是不可或缺的電位傳導指標,因此學者也會在質體中加入 GCaMP 這類鈣離子指示劑(calcium indicator)的基因[2],以追蹤後續水母在進行任何反應時神經細胞內鈣離子的濃度。當研究對象、研究工具都準備好了,就是學者大展身手的時刻啦!
水母進食的神經迴路
水母的神經細胞並非每個都會釋放 RFamide,而是在特定的神經才會產生 RFamide (以下稱這些神經元為 RFa⁺ neuron),而這些 RFa⁺ neuron 分布在水母的神經網(nerve net)、嘴、神經環(nerve rings)及觸手,尤其在神經網的所有神經中約 80% 都是 RFa⁺ neuron,神經網也是 RFa⁺ neuron 最多的地方。學者透過免疫螢光染色發現 RFa⁺ neuron 會與連接放射狀肌纖維神經軸突結節(varicosities)相連而跟著形成放射狀。相較之下,不會產生 RFamide 的 RFa⁻ neuron 則是較為害羞的傢伙,神經元較小,缺乏明確的放射方向。由此可明顯看出,掌握水母行為的主導權主要落在 RFa⁺ neuron 身上,所以學者準備玩轉(殖)這個 RFa⁺ neuron,並進行以下兩種操作:
- 消除水母體內的 RFa⁺ neuron
學者為了消除水母體內的 RFa⁺ neuron ,特地在水母的 RFa⁺ 神經細胞中轉殖了硝基還原酶(nitroreductase, NTR)基因,硝基還原酶就像是遙控炸彈,當把這些轉殖基因水母浸泡在甲硝唑(metronidazole, MTZ)溶液(炸彈引爆器)中,便會使帶有硝基還原酶基因的 RFa⁺ 神經細胞產生細胞毒性而死亡,而 RFa⁻ neuron 不會受到影響。
當學者「炸」掉了水母的 RFa⁺ 神經細胞後,發現牠們捕捉獵物和進食能力變差了,不管是食物誘導或是用蝦提取物的化學誘導,水母的觸手完全無法抓取獵物,也無法摺疊身體將食物餵進其口腔內,但周遭肌肉功能正常,且水母仍能正常游泳和蜷縮。然而再將此類水母的下傘面(subumbrella)局部肌肉注入 RFamide,則會使局部肌肉收縮及邊緣傘面折疊。由此可知,水母的獵捕和進食能力主要還是得靠 RFamide 的力量。

- 水母神經電位偵測器
為了追蹤水母體內的 RFa⁺ neuron 活動,學者另外也將一群水母的 RFa⁺ neuron 轉殖入鈣離子指示劑 GCaMP6s 基因及紅螢光 mCherry 基因,並將這群水母放入一個小空間,讓他們自然游動,或是將牠們包埋在瓊脂糖凝膠(agarose)中,並攤開牠們的傘狀結構,以便捕捉稍縱即逝的電傳導訊號。
學者將獵物蝦子放在水母身體周遭,發現水母起初最靠近蝦子的一側觸手會先產生電訊號,而這個電訊號會從水母身體邊界傳導至嘴巴,而且整個電訊號路徑會呈現扇形區域(如圖三),接著 RFamide 便會使這個扇形區域的肌肉收縮,讓觸手直接被向內折疊到嘴巴的位置,然後把蝦子吃掉。
揭露水母的進食行為:「肽」重要了
以上操作,讓科學家們更了解沒有大腦的水母們究竟是如何進食,也發現 RFamide 對水母們來說「肽」重要了!水母在地球上存在了 5 億多年,卻可以透過如此單一的神經傳導機制生存至今,不過……揪斗!或許,這個發現也可能只是冰山一角;或許,透過水母的神經研究的成果能帶給學者更多對於人腦神經運作的發想,就讓學者邁向這條偉大的航道,去挖掘神經科學中更多的奧秘吧!
註釋
- 通常注射入細胞中的質體上也帶有 Tol2 轉位酶基因,而一起被送入細胞的 Tol2 轉位酶(transposase)蛋白會催化此外送質體,並將 Tol2 轉位子活化且同時將外來的基因嵌入受體生物之基因組中,所送入的 Tol2 轉位子會持續跳躍和插入外來基因,直到 Tol2 轉位酶的活性消失或其 mRNA 完全降解為止。此方法常用於基因轉殖生物,主要特色便是外送基因傳承至子代幾乎沒有發生基因默化(gene silencing)的情況,具有高度穩定性,而且脊椎動物也通用此方法。
- GCaMP 鈣指示劑是綠螢光蛋白(GFP)、鈣調蛋白(calmodulin,CaM,又稱攜鈣素)及肌球蛋白輕鏈激酶 M13 的合成物。當與鈣離子(Ca²⁺)結合時,GCaMP 便會發出綠螢光信號,而螢光信號會隨著鈣離子濃度的變化而增長或消散。
參考文獻
- How to read a jellyfish’s mind
- A genetically tractable jellyfish model for systems and evolutionary neuroscience
- A primer on reinforcement learning in the brain : Psychological, computational, and neural perspectives | Semantic Scholar
- Extracellular Single-Unit Recording and Neuropharmacological Methods – Oxford Medicine
- The genome of the jellyfish Clytia hemisphaerica and the evolution of the cnidarian life-cycle | Nature Ecology & Evolution
- 紐時摘譯:水母沒有脊椎不表示沒有大腦
- 前沿顯微成像技術專題之鈣離子成像
- 魚類Tol2轉位子在基因轉殖上之應用