- 文/蝦喵@熊熊冷知識
關於光遺傳學 (Optogenetic)這個技術,得從約十年多前的史丹佛大學(Stanford University)開始講起。1在1999年到2000年間還分別是 PhD 研究生和 MD-PhD 研究生的 Ed Boyden 和 Karl Deisseroth 常常在 Richard Tsien’s lab 腦力激盪想問題到深夜。其中一個困擾他們的重要問題便是——
如何活化單一神經元卻不影響到周遭的神經元呢?

當時能做到的是利用電壓和電流的改變來改變神經膜電位,進而活化或抑制神經。而儘管是現行技術,電的刺激仍無法只刺激單一神經元。你也許會問,這個問題很重要嗎?刺激單一神經元或許對於研究可愛的魚類的神經生物學家來說,可能不是太嚴重的問題;但對於研究哺乳類,乃至於希望將研究應用到人身上的研究,就是一個亟待解決的問題了。
因為簡單的魚類,一個神經核中往往只有一種神經細胞;但哺乳動物的腦部神經核中,大多含有不只一種細胞種類,而且常常混雜著多種傳遞不同神經傳導物質的神經元,如富含血清素(Serotonin)的中腦中縫背核(Dorsal Raphe Nucleus)中,除了含有大量傳遞血清素的神經元,仍夾著傳遞 γ胺基丁酸(GABA; gamma-aminobutyric acid)的神經元。
而合理推斷帶有不同傳導物質的神經元,應該扮演著不同的功能和角色。所以如果能夠單獨刺激單一種類的神經元,無論是在研究上,或甚至未來在疾病治療上,都有很大的意義。

利用光通道蛋白改變神經元活性
關於激活單一神經元,Ed Boyden 和 Karl Deisseroth曾想過許多方法,包括讓特定神經細胞表現受張力調控的通道蛋白;或將磁珠附在通道上,利用磁場調控離子通道等等;2000 年的晚春,Boyden 開始對受光通道蛋白產生興趣。
光通道蛋白是一種受特定波長的光刺激會打開的離子通道。當時人們已經分別在一種綠藻萊茵衣藻 (Chlamydomonas reinhardtii )2和一種古細菌上 (Natronomonas pharaonis )3發現這種蛋白,並研究出讓在這種蛋白在一般細胞生長環境也能良好表現的方法。3(註:這種古細菌原本生長在高鹽度的環境。)
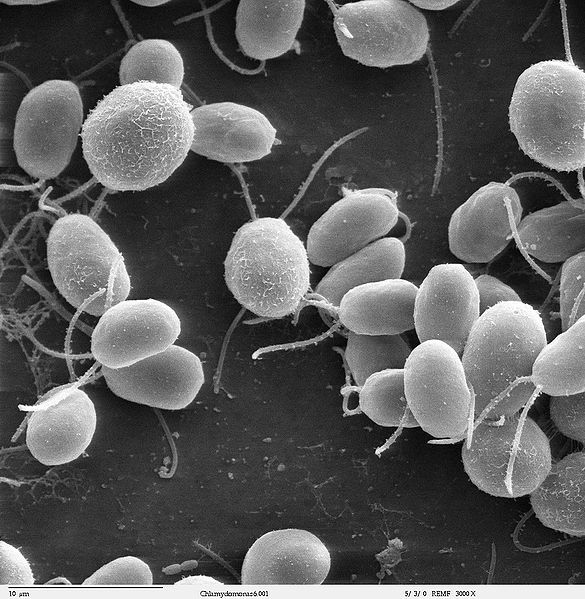
Boyden 想,如果能將這種光通道蛋白利用基因工程的方式表現在特定神經元上,就能利用光照改變特定神經元的活性。
活化:光 → 特定神經元上的正離子通道打開 → 膜電位改變 (上升)→ 神經元產生動作電位
抑制:光 → 特定神經元上的氯離子通道打開 → 膜電位改變 (下降) → 神經元活性被抑制
講到這裡,你是否好奇為什麼 Boyden 會想到用磁場和光刺激呢?原因是細胞或神經元的尺度很小 (約幾十微米),而離子通道(約幾十奈米) 更小,要用接觸力控制,就必須把機械做到奈米尺度,這樣困難度相當高。但如果我們能用光、聲音、或電磁場等方式控制的話,就沒有刺激範圍大小的限制。因為我們只需要把我們想刺激的細胞「訂做」成會對特定刺激(如:光、聲音或電磁場)有反應就可以了。
這樣雖然大家都被光照到了,卻只有某些會對光反應的細胞會產生反應(在這個情況下是因為光通道蛋白的打開,特定離子流入神經元,神經元的膜電位改變,因此活性跟著受到改變)。
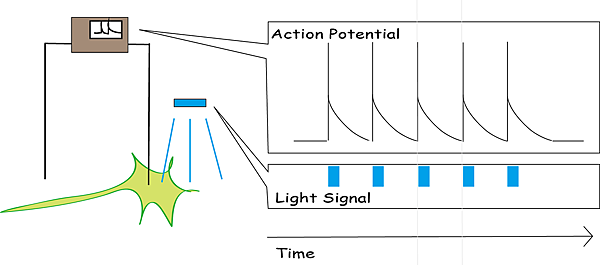
在 2004 年 8 月 4 日的深夜,Boyden 在基因工程嵌入光敏感通道-2(Channelrhopsin-2,一種受光調控的正離子通道)的神經細胞上紀錄到了第一個跟著光波律動的神經訊號。4 這種能刺激特定神經種類的方法,打開了研究神經迴路的新紀元。從此我們不只能夠研究某一神經核的功能,更能研究神經核中不同種類神經元 (如多巴胺神經元和血清素神經元)所分別扮演的角色。
常應用於光遺傳學的通道蛋白
常用的光通道蛋白可以分成兩種,一種是從綠藻分離出的光敏感通道蛋白(Channelrhodopsin;ChR),另一種是從古細菌分離出的嗜鹽視紫紅質(Halorhodopsin;HR)。ChR 是一種陽離子通道,在藍光 (波長約470nm) 照射下打開,可以讓所有帶正電的離子通過,綜合不同陽離子進進出出產生的電位變化,總體來說會造成細胞膜去極化,產生動作電位。
因為 ChR 產生的變化非常明顯 (產生動作電位進而有明顯下游反應),所以 ChR 是目前最常被使用的光通道蛋白。相反的,HR 是一種受光控制的氯離子通道,受黃光 (波長約590nm) 激發打開,氯離子因為濃度差的吸引力大於膜內負電位的斥力,所以會傾向流入細胞,造成細胞過極化。於是有HR的細胞受了光照後就會較難以產生動作電位 (因為膜電位距離閾值更遠了),形同活性被抑制。
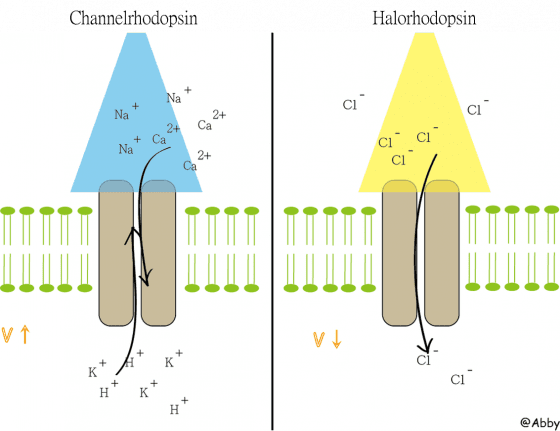
其實,兩種光通道蛋白在研究上都是很重要的。我們可以利用 ChR 使特定神經興奮,看動物的反應 (譬如開始唱歌、翻滾)。另一方面,我們也可以利用HR抑制特定神經,去看動物的行為是否會因此而改變。
讓果蠅幼蟲隨光線點頭動作
接下來我們來看看生物學家怎麼利用光通道蛋白表現在特定的神經上,讓特定的神經產生反應的方式,來控制控制果蠅寶寶吧!
首先,科學家利用了基因工程的方法把 ChR 特定表現在果蠅幼蟲的動作神經上。當藍光照射時,動作神經興奮,在神經和肌肉間的突觸釋放出傳導物質,使肌肉收縮。
- (攝影:蝦喵;感謝課程老師 Bruce R. Johnson、組員Hench Wu)
在影片中,上方是基因改造過帶有ChR的果蠅,而下方是一般野生的果蠅。可以看到帶有ChR的果蠅在藍光照射下不停的點頭,而野生的果蠅則在一旁依然故我。
光遺傳學獲選 Nature 2010 年度重要技術
最後,想給大家看在目前的研究上,科學家是如何應用這種技術在各領域研究上。下面是光遺傳學被《Nature》期刊 2010年選為年度關鍵技術, 《Nature》所製作的介紹短片《Nature Method of the Year 2010》。
前面是這個技術的介紹。從 2:56 的地方開始是一些例子,第一個是利用 HR 抑制動作神經,讓蟲蟲無法游泳;3:11 開始則是利用光控制心肌細胞 (推測應該是 ChR,因為用藍光),使其隨光控制跳動;3:35 則是很酷的讓皮膚細胞可以往雷射的地方移動!
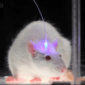
最後 3:45 是一張很有名的圖,講神經科學家如何利用這種方法研究大腦,在老鼠自由活動的情況下。他們把光纖 (傳導光訊號) 和量測的電極做成一個小小的可以上下移動的裝置,將之置入老鼠的大腦上,觀察老鼠在不同行為的時候不同神經細胞的活性變化,並觀察改變不同神經的活性對老鼠行為的影響。
從前為了量測或刺激特定細胞只能量測被麻醉的老鼠的腦或是腦的切片的神經活動。但不同狀態下(譬如被麻醉)的神經活性可能非常不同,所以我們得到的結果僅能說是在特定狀況下 (如被麻醉時) 神經活動情況。這種裝置和技術,使科學家可以研究活蹦亂跳的老鼠的腦部活動,研究結果將能更貼近正常狀態下的神經表現。
參考資料:
- [1] Boyden, E. S.(2011). A history of optogenetics: the development of tools for controlling brain circuits with light. F1000 Biol Reports2011, 3:11.
- [2] Nagel G, Szellas T, Huhn W, Kateriya S, Adeishvili N, Berthold P, Ollig D, Hegemann P, Bamberg E:Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proc Natl Acad Sci U S A. 2003, 100:13940–5.
- [3] Okuno D, Asaumi M, Muneyuki E: Chloride concentration dependency of the electrogenic activity of halorhodopsin. Biochemistry. 1999, 38:5422–29.
- [4] Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., & Deisseroth, K. (2005). Millisecond-timescale, genetically targeted optical control of neural activity.Nature neuroscience, 8(9), 1263-1268.
- Fenno, L., Yizhar, O., & Deisseroth, K. (2011). The development and application of optogenetics. Annual review of neuroscience, 34, 389-412.
本文原刊登於《熊熊冷知識》原文為《調控大腦的新方法──光遺傳學的發現》、《光遺傳學續集:光通道蛋白及相關實驗》,此處將上下集整理為一篇文章內容。