臺灣食品藥物管理署(以下簡稱食藥署)於 6 月10 日發佈國產 COVID-19 疫苗緊急使用授權審查基準,此項緊急使用授權(EUA, emergency use authorization)裡面採用了哪些方法評估疫苗的保護力?又有那些地方值得討論呢?
任何決策,都是建立在「取捨、利大於弊」的概念下,現實中沒有「唯一、最好」的選項,只有「當下」判斷、潛在成本和收益都可以接受的策略。
在 2020 年尚無任何 COVID-19 疫苗時,研發的藥廠要尋找到願意配合三期試驗的國家,並不會遇到太大的困難。但疫情發展至現在,已有六款世界衛生組織(WHO, World Health Organization)緊急許可的疫苗,各國已不太可能允許他國藥廠,將無效安慰劑注射在本國人民體內。
因此現實上,步伐稍慢的疫苗,想進行雙盲安慰劑的三期試驗,日趨困難 [1]。然而,各國疫情不曾停歇、且每個人都需接種疫苗的壓力,迫在眉睫。
因此不久的未來,各國、各藥廠極可能透過比較接種者的免疫反應,也就是所謂的「免疫橋接研究」以預測、判斷候選疫苗的效果。
例如法國 Valneva 藥廠,已在四月展開免疫橋接的三期臨床試驗,對照組是 AZ 牛津疫苗,試圖比較兩支疫苗間的抗體和T細胞反應。
目前尚無任何國家以免疫橋接研究,審查通過 COVID-19 疫苗的緊急使用授權。但在現實壓力下,食藥署願意將此議題浮上檯面,讓社會、科學界討論,仍是值得嘉許之舉。

現行食藥署 EUA 裡可能有所忽略的地方
透明開放細節不足
可惜的是,儘管食藥署以新聞稿+製圖說明,但未詳述實驗方法、技術細節、對照組族群樣貌,甚至也未提供參考文獻、他國政府文件等等,使民眾無法更了解政府作法。
反觀美國,為了讓人民更相信疫苗,創新的開放態度令人驚嘆。目前通過的3支 COVID-19 疫苗在緊急使用授權的評估過程中,其專家會議討論與投票皆全程直播,相關資料更在會議前2天上網供全球下載瀏覽。
高度的開放文化,讓相信或不相信政府的美國人民,都能憑藉科學討論。

抗體中和病毒效價,不一定等同疫苗真實保護力
食藥署 EUA 的標準,以評估比較兩支疫苗的「抗體中和病毒效價」為主;換言之,食藥署認為抗體中和效價一定程度反應了疫苗的「真實保護力」(此部分數據以往由三期臨床取得)。
日前期刊《Nature Medicine》有一篇研究,就是透過研究輝瑞、AZ 等疫苗的中和病毒效價,和三期保護力數據,建構出預測模型,其趨勢的確一定程度支持:
抗體中和效價,可換算真實保護力 [1]。
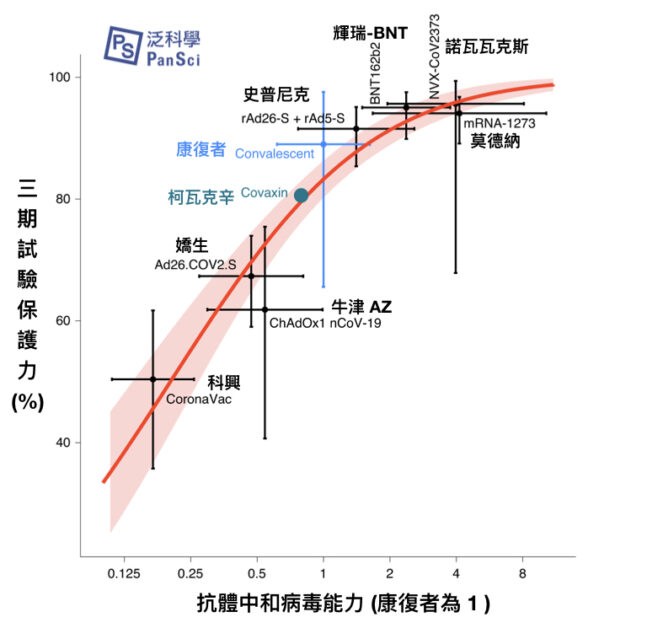
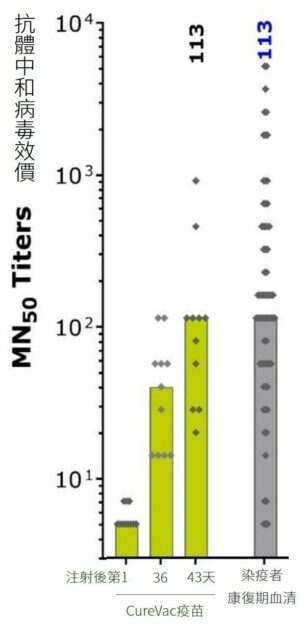
但是最近也出現反例,德國 CureVac 藥廠,近日公布 mRNA 疫苗(CVnCoV 12 µg)三期試驗數據,其保護力僅47%,未達預設的50%最低標準。
但回顧其疫苗的抗體中和病毒效價,數值和康復者血清相當,皆為 113(如下圖);若以《Nature Medicine》的研究而言,CureVac 的疫苗保護力應該要高於AZ疫苗、甚至應有八成以上,但三期試驗的結果卻僅有47%。
換言之,CureVac 藥廠的研究結果,為抗體中和效價可換算真實保護力的可能,帶來了一個鮮明的反例。
現有的標準忽略了T細胞的角色
食藥署 EUA 的標準中,僅提及「抗體」;然而,可能忽略了T細胞的重要性(也可能是較難評估)。
我們人體的免疫力分為兩個系統,分別承擔不同面向的防禦 [3]:
- 「抗體」為主的體液免疫(humoral immunity)
- 「T細胞」為主的細胞免疫(cellular immunity),又分為
- 「殺手T細胞」:可搜尋被病毒感染的細胞並將之殲滅。
- 「輔助T細胞」:可活化、誘導其他淋巴系統,如:即時反應、分泌抗體的漿細胞(plasma cell)、記憶型B細胞(memory B cell),其中記憶型B細胞可長期存活,即使血清裡沒有抗體,當它遭遇病毒,也能即刻反應、產生抗體擊退來敵。 [4, 5]
「抗體」能辨認、咬住尚在體液的病毒,阻止它侵入細胞;然而,當細胞被病毒感染、變成殭屍細胞,不斷地誕生病毒子代後,負責控制災區、清除殭屍細胞,就是殺手T細胞的工作了。
而輔助T細胞更是帶領整個免疫團隊全面反擊病毒,並且負責後續長期免疫力(記憶型B細胞)的關鍵 [4, 5]。
換言之,抗體可以避免感染,而T細胞也許是主導長期免疫、阻止疾病惡化、預防重症的關鍵。
因此,食藥署 EUA 的標準裡,未納入T細胞的考量,是「難以評估」,還是「無須評估」?此部分尚待食藥署提出科學證據向民眾說明 [註1]。
而面臨 COVID-19 持續出現變異株的情況,更有研究逐漸顯示出,相較於抗體,T細胞可能才是對抗變異株病毒的強大幫手。
「臉盲」的抗體認不出變異病毒,但T細胞記得
我們常聽到「XX變異株的抗體效力下降6倍」等新聞,而擔心疫苗就此無效。但好消息是,科學家發現「就算抗體認不出變異病毒,但T細胞會記得」。
荷蘭科學家招募 98 名不曾感染 COVID-19 且接種過 輝瑞-BNT 疫苗的自願者,檢測其抗體和T細胞對冠狀病毒的反應 [6]。
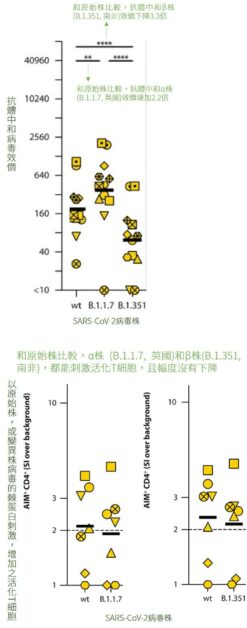
在抗體方面,若將原始株的中和效價定為1,則 β 變異株(B.1.351, 俗稱南非變種病毒)的中和效價下降 3.3 倍,α 株(B.1.1.7, 俗稱英國變種病毒)效價增加 2.2 倍。
顯示棘蛋白的突變,影響了抗體辨認病毒的能力。
但T細胞似乎沒有「臉盲」的問題。不管是用原始株,或變異株棘蛋白刺激,T細胞都能被活化,且幅度不因病毒突變而減弱。
顯示疫苗訓練的T細胞,辨認病毒的能力,不受突變而影響。
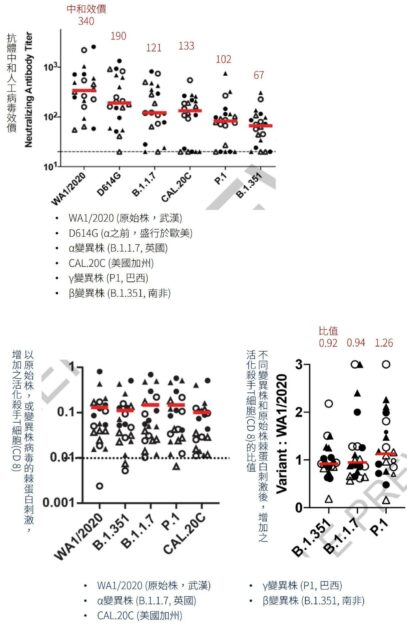
而腺病毒載體疫苗也有類似的情況,20 名嬌生疫苗接種者的研究裡,面對原始病毒抗體中和效價為 340,但針對各變異株時,抗體開始出現「臉盲」、中和效價皆下降。α 變異株效價為 121,而 β 變異株更僅為 67 [7]。
而嬌生疫苗活化的T細胞,也沒有「臉盲」的毛病。用原始株,和變異株的棘蛋白刺激殺手T細胞後,其活化的程度、效果都接近,不因病毒突變而減弱。
顯示嬌生疫苗訓練的T細胞,和 輝瑞-BNT 疫苗相同,攻擊變異株病毒的能力,不因突變而降低 [註2]。因此,變異株病毒的威脅日趨嚴重的現在,以疫苗誘發T細胞的評估,也許應該更加被重視。
過往的理論已告訴我們,抗體和淋巴細胞分別保護人體的不同面向。
首條防線是抗體,目的是阻絕病毒感染細胞;若病毒已侵入細胞,就控制感染、清除殭屍細胞的工作,可能就得落在殺手T細胞的肩膀上;而帶領整體免疫大軍反攻、長期免疫的關鍵,可能就是輔助T細胞 [3]。
而去年初科學家也發現,降低 COVID-19 重症的關鍵,應該是輔助T細胞和殺手T細胞。54 名 COVID-19 感染者的資料顯示,病人的T細胞越活躍,疾病程度越輕微 [3]。同理可推論,若疫苗誘發的T細胞越活躍,預防重症的能力就可能越高。
作者個人意見
有鑒於未來國際間,必然會以免疫橋接方式審核 COVID-19 疫苗;食藥署率先認真研究此方法值得嘉許。
但希望能學習美國政府取信於民的精神,詳細說明抗體中和病毒之實驗方法、基礎資料,並向民眾說明選用抗體中和病毒效價之優劣,以及忽略T細胞可能的風險等。
也希望政府能在 EUA 會議之前,提前公布會議資料(直播就不強求了),讓民眾能更相信國產疫苗。
最後,若國產疫苗有幸通過 EUA,請務必讓民眾有選擇的權力。同時收集、追蹤,並研究首批接種者的各項數據。用科學,做國產疫苗最好的靠山。
保持冷靜,繼續前進。Keep Calm and Carry On.
- 本文感謝 Tsai-Yi Lu 協助
註解
- 註1:疫苗誘發的保護力中,尚有「非中和性抗體+細胞清除」等免疫反應,可協助清除病毒 [5]。目前食藥署EUA標準裡,皆忽略之。
- 註2:輔助T細胞的結果類似殺手T細胞,可詳閱參考文獻6。
參考文獻
- 蔣維倫 (2021) 落後的COVID-19疫苗難進行三期臨床試驗,該怎麼辦?科技報導
- Peter Kremsner, Philipp Mann. et. al. (2020) Phase 1 Assessment of the Safety and Immunogenicity of an mRNA- Lipid Nanoparticle Vaccine Candidate Against SARS-CoV-2 in Human Volunteers. medRxiv. DOI: https://doi.org/10.1101/2020.11.09.20228551
- Carolyn Rydyznski Moderbacher, Sydney I. Ramirez. et. al. (2020) Antigen-Specific Adaptive Immunity to SARS-CoV-2 in Acute COVID-19 and Associations with Age and Disease Severity. Cell. https://doi.org/10.1016/j.cell.2020.09.038
- Isaak Quast and David Tarlinton (2021) B cell memory: understanding COVID-19. Immunity. DOI: 10.1016/j.immuni.2021.01.014
- Heidi Ledford (2021) Could mixing COVID vaccines boost immune response? Nature. DOI: https://doi.org/10.1038/d41586-021-00315-5
- Daryl Geers, Marc C. Shamier. et. al. (2021) SARS-CoV-2 variants of concern partially escape humoral but not T-cell responses in COVID-19 convalescent donors and vaccinees. Science Immunology. DOI: 10.1126/sciimmunol.abj1750
Galit Alter, Jingyou Yu. et. al. (2021) Immunogenicity of Ad26.COV2.S vaccine against SARS-CoV-2 variants in humans. Nature. DOI: https://doi.org/10.1038/s41586-021-03681-2