隨著 COVID-19(武漢肺炎、新冠肺炎)在台灣肆虐,死亡率的問題引起重視。死亡率的計算,直覺想來就是「死掉人數/感染人數」這麼簡單,但是在不同族群的感染者死亡人數差異很大的疾病裡,事情沒有這麼單純。

同一個狀況,三種死亡率:感染、確診、全體死亡率
通常我們希望得知的死亡率,叫作「感染死亡率(infection fatality rate)」,也就是死亡人數占所有感染者的比例。例如 10 萬人感染,1 萬死亡,感染死亡率為 10%。
但是感染者未必都能確診,因此實際上得知的是「確診死亡率(case fatality rate)」。10 萬人感染,1 萬人死亡之下,如果只有 5 萬人確診,帳面上確診死亡率便是 20%。
不論多高比例的感染者確診,都不影響死亡人數,因此死亡數占整體人群的比例,亦即「全體死亡率(crude mortality rate)」將不受影響。全體 100 萬人,死亡 1 萬人,不論 10 萬或 5 萬人確診,全體死亡率都是 1%。
非常明顯,感染過卻沒有計入感染人數,會高估真實的死亡率。而死亡數如果沒有被計算到,則會低估死亡率。另外,進行中的傳染病,感染與死亡人數仍不斷變化,死亡率也會持續變動。
- 延伸閱讀:武漢肺炎有多致命?認識3種死亡率
人、醫療、病毒,都會影響死亡率
上述是死亡率的通則,導致 COVID-19 的 SARS 二世冠狀病毒(SARS-CoV-2)更加複雜。感染這種病毒後不同人差異很大,未成年人死亡率極低,但高齡卻高風險;不同組成的族群直接比較,意義不大。
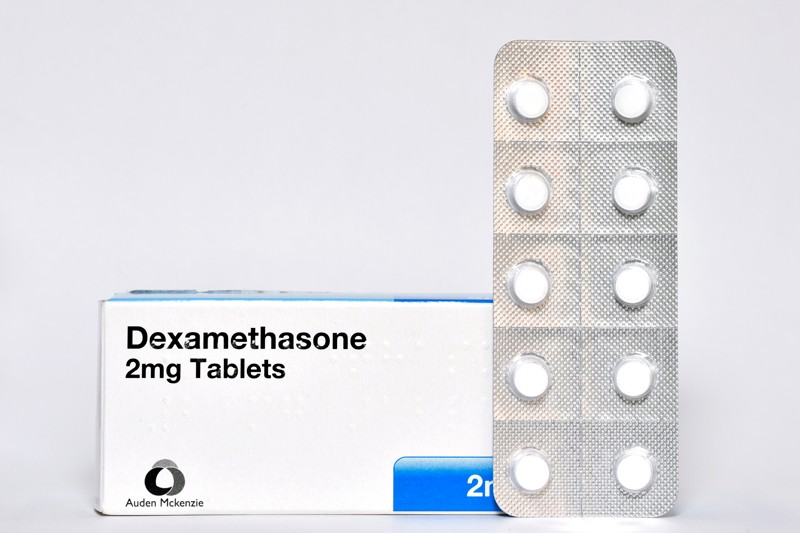
人的風險高低之外,治療與病毒本身也會造成影響。
治療有兩方面可以影響死亡率:一方面,短期內重症患者太多,超過當時的醫療負荷,無法妥善治療患者,死亡率便會增加;另一方面,找到合適的療法則能降低死亡率——如臨床試驗發現,類固醇 Dexamethasone 能降低重症者的死亡率。
病毒本身,殺傷力也有強弱之別。而即使拿到同一份病毒導致的死亡數據,不同人計算的死亡率也可能不同。
例如目前在台灣廣傳,源自英國的 B.1.1.7 新型病毒(WHO 稱為 Alpha),和近親相比配備許多變異,可謂迅速累積突變的總加速師。公認它的傳染力增加,但是不同研究估計的死亡率不一樣,有些認為更高,也有人不以為然。
一部分原因是因為,每次取樣的感染族群不一致。而死亡率本來就會因族群而異,因此需要經過校正;而校正的設定不同,算出來的死亡率也就會不一樣。
了解上述死亡率的各種考慮,再來檢視台灣的數據,能看出哪些端倪?
低風險群重症率增加,是真的嗎?
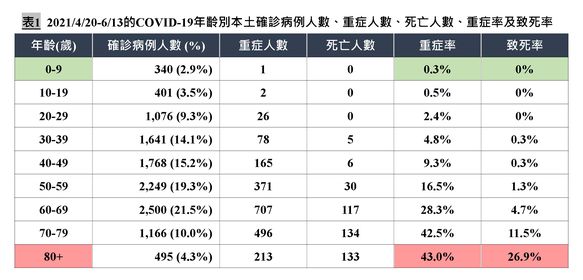
台灣在 2021 年 5 月初開始爆發社區感染,累積確診超過一萬人。陳建仁臉書 6 月 16 日早上列出各年齡層的確診、重症、死亡數。這些悲傷的數字後面,可以發掘許多線索。
4 月 20 日以前,台灣只有非常少量的 77 位本土病例,之後累積 11636 人確診,所幸趨勢正在下降中。新一波社區傳播尚未結束,至今感染者狀況沒有意外:
重症率、死亡率都和年齡正相關,愈老的人機率愈高,又在超過 60 歲後大增。
不過新一波疫情的帳面數字和過去比較,至少有兩項值得注意的觀察:第一,未滿 50 歲組的重症率上升。第二,50 到 69 歲組、70 歲以上組的死亡率大幅下降。
根據各國經驗,因 SARS 二世冠狀病毒死亡的患者主要有兩群:一群會住院很久,重症後死亡;另一群根本來不及住院,甚至沒什麼明顯的症狀就猝死,非常難以預防。
出於疾病性質,有些不在醫院去世的感染者會被統計遺漏,因而低估死亡率;相比之下,重症者必需長期住院,幾乎不可能被忽視。有些時候用重症率來估計疫情規模,也許比確診死亡率更合適,至少也能提供另一個視角。
所以未滿 50 歲組,4 月 20 日之前的重症率 2.3%,這波增加為 5.2% 是怎麼回事?我想至少有 4 個因素可能產生影響:
- 第一,取樣因素。這波社區感染規模較大,相對也有較多潛在感染者沒有被納入分母,所以高估重症率。
- 第二,機率因素。之前樣本數小,隨機誤差大,才顯得數字比較低(不過也可能更高)。
- 第三,病毒因素。英國總加速師的殺傷力比較強,增加重症率。
- 第四,醫療因素。住院人數大增,醫療品質降低,增加重症率。

新一波疫情檢驗不足,高估重症比例?
這 4 個因素中,醫療品質降低非常不可能,因為若是如此,更高齡組也應該有一樣的改變,可是他們的死亡率反而降低。
病毒的殺傷力有沒有增加不清楚,但是更高齡組的重症率、死亡率沒有增加這件事,也不支持病毒本身的影響有多大。
機率因素的背景是,「樣本愈大,受到隨機影響愈小,愈符合實際的風貌」。之前未滿 50 歲,多數為低風險群的本土感染人數非常少,44 人的隨機誤差會比 5000 多人更大。不過 2.3% 要誤差到超過 5.2% ,機率也不是那麼大;這波的重症率,似乎真的變高一些。
這麼一來,就是「取樣」的影響最大。
不論檢驗多發達,實際上的感染人數,一定超過已知的確診數,也就是本文開頭提及,感染死亡率與確診死亡率的落差。愈多感染者未知,確診者的重症率、死亡率也會愈高。
與之前零星的本土感染相比,這波社區傳播的規模是很多多多倍,輕微症狀者被遺漏的相對比例多半更高,使得重症率受到高估。至於高估多少,很難判斷,影響因素實在太多。此一問題只能由事後的血液抗體檢驗回答。
常理來說,年紀愈大的族群也許高估愈少,因為風險愈高的族群,症狀明顯的機率更大,容易接受檢驗而確診,比較不容易被忽略。

高風險群的重症率、死亡率降低?
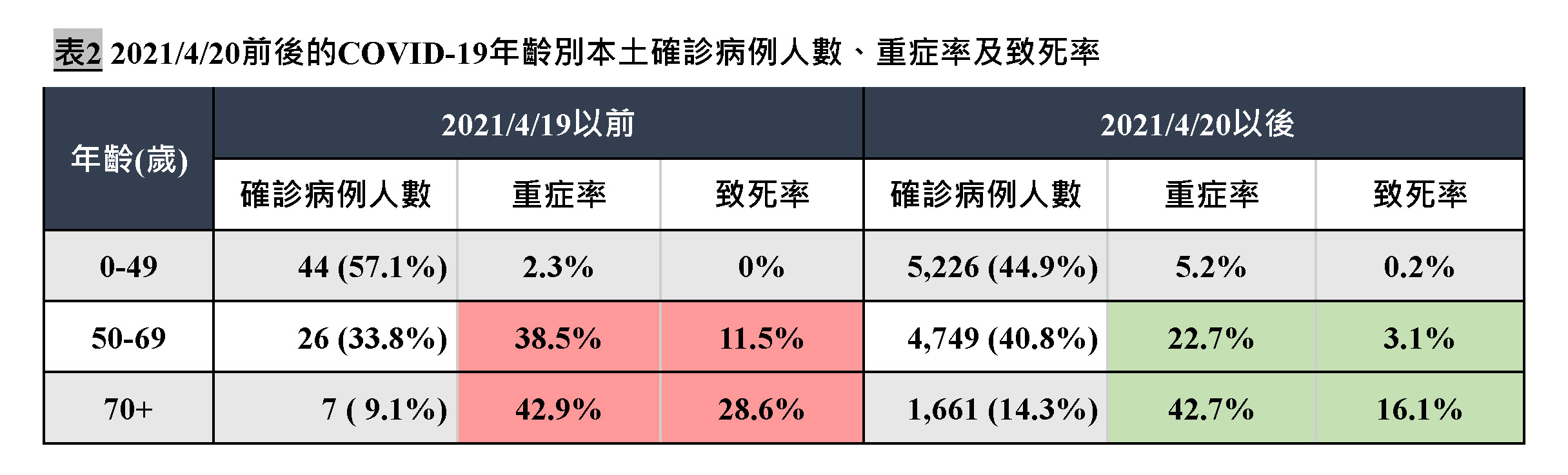
順著上述假設推論,4 月 20 日前後的數字都有高估,只是之前高估較少,之後高估較多。這樣再來看「50 到 69 歲組、70 歲以上組的死亡率大幅下降」該如何解釋?
這兒比較以前要先注意,4 月 20 日之前的確診人數很少,死亡數更少,差一個人就會影響很大。50 到 69 歲組 26 人,重症率 38.5%(10 人),死亡率 11.5%(3 人)。70 歲以上組只有 7 人,重症率 42.9%(3 人),死亡率 28.6%(2 人)。
這波社區感染的樣本數大得多,50 到 69 歲組 4749 人,重症率 22.7%,死亡率 3.1%。70 歲以上組 1661 人,重症率 42.7%,死亡率 16.1%。
一個解釋是,樣本小的時候誤差大,4 月 20 日以前的重症率、死亡率其實沒有那麼高。
不過如果把兩組合併,稍微加大一點樣本,比較 50 歲以上確診者的重症率(39% vs 27.88%)和死亡率(15% vs 6.46%),再考慮到新一波感染的比例被高估,實際上更低,那麼似乎能推論:
這次的感染規模大很多倍,重症與死亡的機率卻都降低。
我想至少有 2 個可能,第一,這波疫情仍在進行中,有些重症的感染者尚未死亡,目前的死亡率仍為低估。第二,和過去相比,台灣的治療能力明顯提升,從而降低重症與死亡的機率。
台灣醫療表現比你以為的更好
不可否認,疫情尚未結束以前,死亡人數仍會增加。比較符合真實狀況的數字,至少等到確診後一個月才比較清楚。但是假如上述思考方向正確,
這波大規模社區感染之下,台灣不但沒有醫療崩潰,重症率、死亡率反而還比前一年醫療充裕時更低,至少能夠斷定,這次住院患者的醫療品質,不會比以前更差。
台灣和之前相比,不但重症率、死亡率都有減少,重症者死亡的機率也有降低,我認為應該不可能完全是運氣,無關治療能力的提升。
另外也不要忘記,目前廣傳的英國總加速師病毒,有些分析認為殺傷力有所提升,尤其是高齡族群(也有人認為不變,反正沒有下降)。若真是如此,即使只是維持原本的重症率、死亡率,也是成功抵銷病毒增加的殺傷力,可謂醫療的進步。
台灣這波社區感染,有些人認為死亡率偏高,懷疑是否治療能力不足。可是根據已知資訊,真實狀況搞不好完全顛倒,台灣的醫療表現比乍看更加優秀。
這波社區感染照著目前趨勢下去,死亡率或許會再高一些,但是和其他地區相比,台灣並沒有比較差,可能還比之前的自己進步。過去一年來,台灣大部分醫療人員缺乏直接對付 SARS 二世冠狀病毒的經驗,不過實際面對大量病患的考驗時,表現可謂出色。
延伸閱讀
- COVID-19 有多致命?認識3種死亡率
- COVID-19 殺死的人比帳面數字更多,但是究竟多少?
- 英國、南非、巴西……武漢肺炎進入總加速師新階段?
- 反正都是確診,為什麼還要定序病毒基因組?
- 新加坡和台灣都見識過,WARS殺傷力減弱的∆382突變?
- 「抗體檢驗」是什麼?面臨那些限制?偽陽性、抽樣與群體免疫
- 誰是COVID-19的重症高風險群?部分需注意干擾素缺陷
- 源自尼安德塔人的DNA,讓WARS嚴重機率增加?
- 源自尼安德塔人的基因,讓WARS重症機率降低
參考資料
- 陳建仁臉書 〈【COVID-19本土確診病例的重症率與致死率】〉
- Coronavirus (COVID-19) Mortality Rate
- Increased mortality in community-tested cases of SARS-CoV-2 lineage B.1.1.7
- An estimation of undetected COVID cases in France
本文亦刊載於作者部落格《盲眼的尼安德塔石匠》暨其 facebook 同名專頁。