編按:2021/7/19 高端疫苗於今日通過衛生福利部食品藥物管理署核准通過通過緊急使用授權(EUA),相關數據如下:
1.高端疫苗組與AZ疫苗組之原型株活病毒中和抗體幾何平均效價比值(geometric mean titer ratio, GMTR)的95%信賴區間下限為3.4倍,遠大於標準要求0.67倍。
2.高端疫苗組的血清反應比率(sero-response rate)的95%信賴區間下限為95.5%,遠大於標準要求50%。
編按:2021/6/10 高端疫苗開設二期解盲記者會,提供相關臨床數據。為讓讀者能有更全面的資訊,在此將內容補充至文章當中。
安全性:
1) 安全與耐受性良好
2) 不良反應,安慰劑組:疫苗組發燒 0.4% : 0.7%
疲勞 29.7% : 36%
肌肉痛 16.6% : 27.6%
頭痛 20% : 22.2%
腹瀉 12.6% : 15.1%
注射處疼痛 23.3% : 71.2%
注射處紅斑 0% : 4.9%
注射處腫 0% : 10.5%
不良反應的情況,顯示和 Novavax 疫苗接近的狀態,相較於 mRNA、腺病毒疫苗相比,發燒比率極低。注射部位疼痛較明顯。有效性:
3) 不區分年齡,施打疫苗後,產生血清的人,比率約99.8%
4) 中壯年 (20-64歲),施打疫苗後,產生血清的人,比率約99.9%
5) 不區分年齡,施打疫苗後,血清的中和抗體校價 (GMT titer)為662
6) 中壯年 (20-64歲),施打疫苗後,血清的中和抗體校價 (GMT titer)為733
顯示高端疫苗可誘發針對抗原的抗體,而且幾乎每個人都可以產生抗體。但中和抗體校價等,因為不知道實驗條件,暫無法得知其效益。
國內的高端疫苗於 3/30 宣布,二期試驗受試者可在 4 月底接種第二劑,最快可在 6 月初向食品藥物管理署申請專案許可。本文介紹高端疫苗的設計原理、優劣,和挑戰。

蛋白質類型疫苗的優勢
上世紀 80 年代以前,疫苗的來源就只有活著和死掉的病毒兩種;但以整顆病毒做為疫苗,有其風險和障礙:
- 安全面:
活病毒類型疫苗而言,雖然內容物是低毒性的改良病毒株,也可能會在人體內突變回高毒性的野生株病毒,並因此得病(如:小兒麻痺沙賓疫苗,約 270 萬劑裡,會出現 1 例因疫苗而導致小兒麻痺[1])。
死病毒類型疫苗來說,曾發生藥廠不夠嚴謹、政府監管倉促的「卡特事件(Cutter incident)」。藥廠未能完全殺死病毒,導致疫苗裡仍有高毒性的小兒麻痺活病毒;導致4萬名兒童因接種疫苗而染病、近兩百人終身癱瘓、10 人死亡[2]。
面對高致死、致殘性的疾病,以整顆病毒做為抗原,相當冒險。
- 製程面:
部分病毒難以在實驗室大量生產,如:B 型肝炎病毒、HPV 病毒,故此類疾病無法用傳統疫苗技術開發。
借助上世紀中期、基因工程的高速發展,人類終於在 1986 年開發出首個基因重組的蛋白質類型疫苗(B 型肝炎)[註1]。此類疫苗僅含病毒蛋白,和增強免疫的佐劑(adjuvant)。換言之,人類只需找到能關鍵的病毒蛋白,就能開發出該疾病的疫苗了。
在新型冠狀病毒疾病(COVID-19)疫情中,採蛋白質疫苗策略的有:台灣高端疫苗、聯亞疫苗、美國 Novavax 疫苗、古巴主權(Soberana)疫苗等。在此疫苗大戰裡,這類疫苗的優勢為:
- 儲存 / 運輸:
相較於 mRNA 疫苗必須冷凍保存(約 -20℃),蛋白質類型疫苗僅需冷藏(約 4℃),較為友善。 - 接種經驗:
相較於 mRNA、腺病毒載體疫苗未曾在歷史上大規模施打的履歷,蛋白質類型疫苗從發明以來,以透過 B 型肝炎疫苗、HPV 疫苗的千萬人接種,證明該類型疫苗有良好的安全和效力。 - 血栓併血小板低下
(VITT, vaccine-induced immune thrombotic thrombocytopenia)之疫苗副作用:經大規模施打,牛津、嬌生疫苗皆疑似出現極罕見的瀰漫性血栓合併血小板低下副作用,可能是疫苗內未被包裹住帶負電的 DNA 所致,現已多國停止施打。而蛋白質類型疫苗內容沒有病毒載體或帶負電的核酸,較無此罕見副作用疑慮。
高端疫苗的 COVID-19 疫苗的優勢
如前所述,蛋白質類型疫苗有兩個關鍵:「抗原」與「佐劑」。
1. 抗原
早在 2002 年爆發 SARS 後,科學界認知,新興傳染病將越趨常見,因此逐漸投入各種基礎的病毒研究,如:結構、生活史、廣譜型藥物等,並冀望能幫助未來的人類對抗未知的世紀瘟疫。
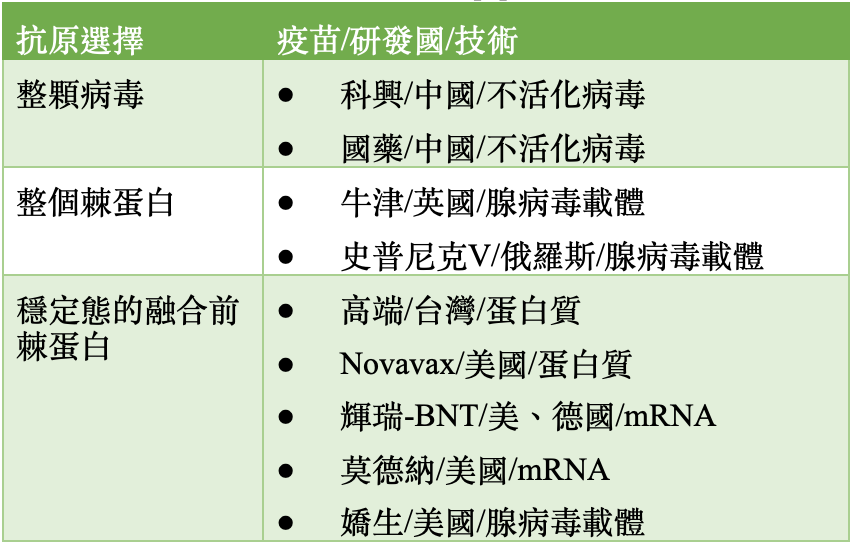
以冠狀病毒疫苗而言,最佳的抗原選擇是棘蛋白(spike protein)。它分布在病毒表面,同時也是結合人體細胞的關鍵蛋白。若能訓練白血球認得棘蛋白、產出抗體,將可做為阻止感染、預防重症的最佳策略。
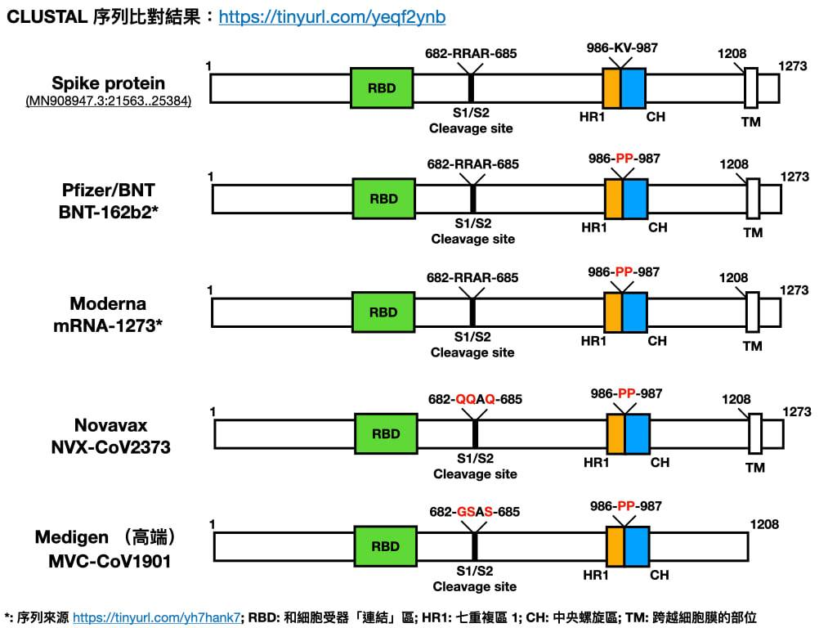
而長年的研究,科學家發現冠狀病毒們(如:SARS-CoV,MERS-CoV 和 HKU1-CoV),棘蛋白和細胞表面受器結合後,會改變蛋白質結構;後續細胞和病毒、兩者的膜會融合、注入病毒 RNA。再經實驗發現,相較於膜融合後的棘蛋白結構,融合前的蛋白質結構(prefusion conformation),能誘發更高的抗體[3],因此融合前的棘蛋白,是最佳的疫苗抗原的選擇。
但有個問題是,單獨存在的棘蛋白,結構並不穩定,極易自然形變、分解。因此美國國家過敏和傳染病研究所(National Institute of Allergy and Infectious Diseases, NIAID)透過修飾、調整胺基酸,使棘蛋白能保持穩定的融合前結構[3],以期達到誘發抗原的最大化。針對 COVID-19,高端疫苗的抗原選用穩定態的融合前棘蛋白,採用美國 NIAID 策略,將棘蛋白胺基酸-K986 和 V987 改成脯氨酸(P / Proline)、維持融合前結構,也針對易被分解的位置、改造了胺基酸( 682-RRAR-685改成 682-GSAS-685),賦予棘蛋白抵抗分解的特性[4]。讓高端疫苗內含的棘蛋白,維持誘發高度抗體的融合前結構。採取類似優化策略的還有美國 Novavax 等。
2. 佐劑
蛋白質類型疫苗,由於缺乏「感染人體細胞」的步驟,能誘發的免疫反應通常較弱,因此會加佐劑強化疫苗。佐劑依原理分為三類:讓局部組織發炎(damage-associated molecular patterns-type adjuvants)、模仿病原體入侵訊號 (pathogen-associated molecular patterns-type adjuvants),和讓白血球更有效捕獲疫苗(particulate adjuvants)等類型[7]。
佐劑能強化人體對疫苗的反應,進而降低疫苗裡抗原蛋白的用量、減輕製程壓力、加速疫苗生產。而部分族群(如:嬰幼兒、老年)的免疫系統尚未成熟,或老化,故對疫苗的反應較弱。透過添加佐劑,能安全地提高疫苗對她們免疫系統的反應。
高端疫苗同時混合兩種佐劑-CpG 的 DNA 序列和鋁鹽[6]。鋁鹽等能引起局部發炎,吸引樹突、巨噬細胞聚集,進而活化後天免疫系統、產生抗體和記憶型免疫細胞。現已商用的 HPV 疫苗(保蓓 / Cervarix,葛蘭素史克)、B 型肝炎疫苗(安在時 / Engerix-B,葛蘭素史克)都使用鋁鹽佐劑。而 CpG 的 DNA 序列可做為佐劑的原理,是而動物細胞遇到 DNA 時,可透過細微的差異,判定該 DNA 是否為細菌入侵者。由於高端疫苗中的 CpG 的 DNA 序列,缺乏甲基化(methylation)修飾,能模仿原核生物的 DNA 特徵,活化免疫細胞的第九型類鐸受體(Toll-like receptors / TLRs),導致發炎反應、讓細胞拉起假警報。目前已在商用的 B 型肝炎疫苗(Heplisav-B)裡,即採用 CpG 的 DNA 做為佐劑。
高端疫苗的動物實驗、一期人體試驗
疫苗的臨床試驗,在動物實驗成功後,會進行三階段的臨床試驗:
- 安全性、劑量與濃度。通常數十人。找健康人。
- 免疫反應(通常指血清的抗體濃度)。通常數百至千人。找健康人。
- 有效性(指「避免被感染」或「防止感染後惡化成重症」)、安全性(常見和少見的不良反應)。通常數千至數萬人。找健康人,在有疫情肆虐的區域,讓疫苗接受真實世界的考驗。
高端疫苗已擁有動物試驗和一期臨床試驗結果;二期已在 2021 年 3 月展開。
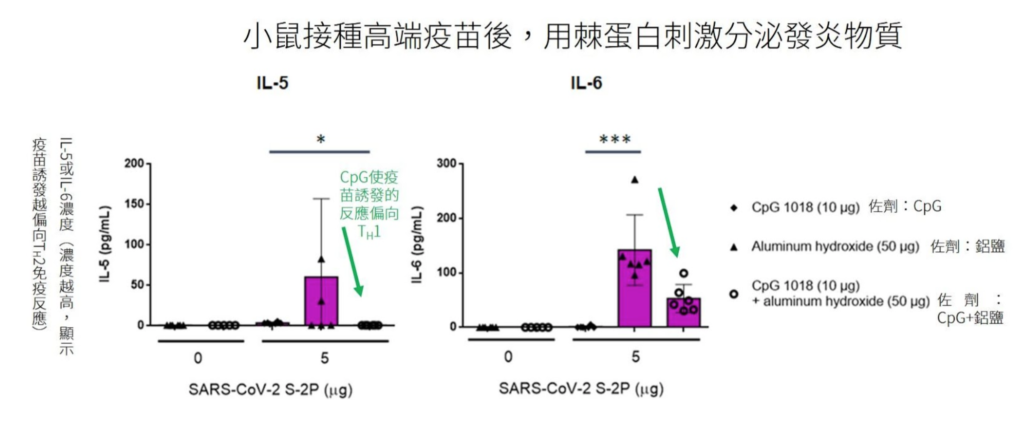
良好的佐劑,在開發呼吸道疾病疫苗時,可提高誘發 TH1 免疫反應、降低 TH2 免疫反應。TH2 免疫反應會增加 IL-5 等發炎物質、活化嗜酸性白血球(eosinophil)。若疫苗誘發的免疫反應偏向 TH2 免疫反應,當野生病毒侵入人體,過度的 TH2 免疫反應反而會讓肺部出現嚴重的發炎反應、大量的白血球浸潤於肺臟,導致急性的肺損傷[8, 9]。
從高端疫苗的動物實驗發現,用不同佐劑組合刺激後,小鼠所誘發的血清抗體強度,CpG+ 鋁鹽組合的抗體濃度最高。
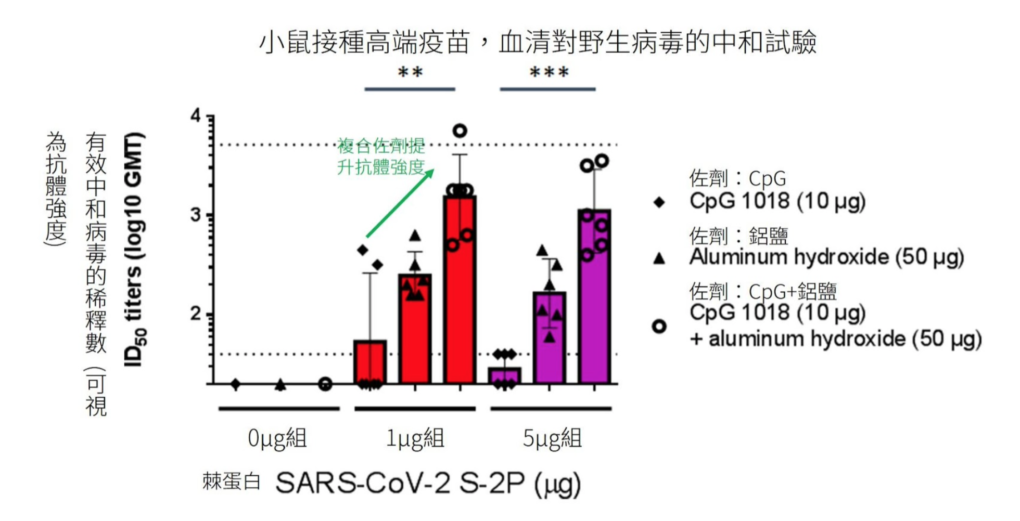
而更重要的是,若僅用鋁鹽做為佐劑,疫苗誘發較多、較危險的 TH2 免疫反應,而高端疫苗加入 CpG 為佐劑,有效地將疫苗誘發的免疫力轉向 TH1 路徑、減少疫苗潛在的風險。動物實驗證實,選擇 CpG+ 鋁鹽為佐劑,能誘發更強、更安全的免疫反應。
高端疫苗的臨床一期試驗裡,自願者分為三組(各 15 人),注射了5μg、15μg 和25μg 三種劑量。可發現,抗體強度隨劑量增強,且多數接種者產生可以中和病毒的抗體,且抗體強度和康復者接近、或更強[6][註2]。
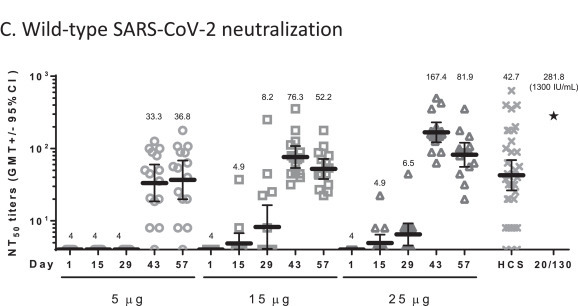
高端疫苗的挑戰
高端疫苗已在今年 3 月展開二期試驗,但可能在未完成三期試驗的情況下,就和食藥署申請專案許可,此規畫令人擔憂。目前歐美核准之疫苗,如:輝瑞、Moderna、嬌生、牛津疫苗等,皆皆在疫區進行三期試驗,並在執行中看到一定效力、安全性數據,和真實的病毒對抗、展現保護力後,才向國家提交使用許可。倘若高端疫苗僅以二期試驗的抗體數據,延伸解讀為疫苗在真實世界的保護力,是冒險的做法。
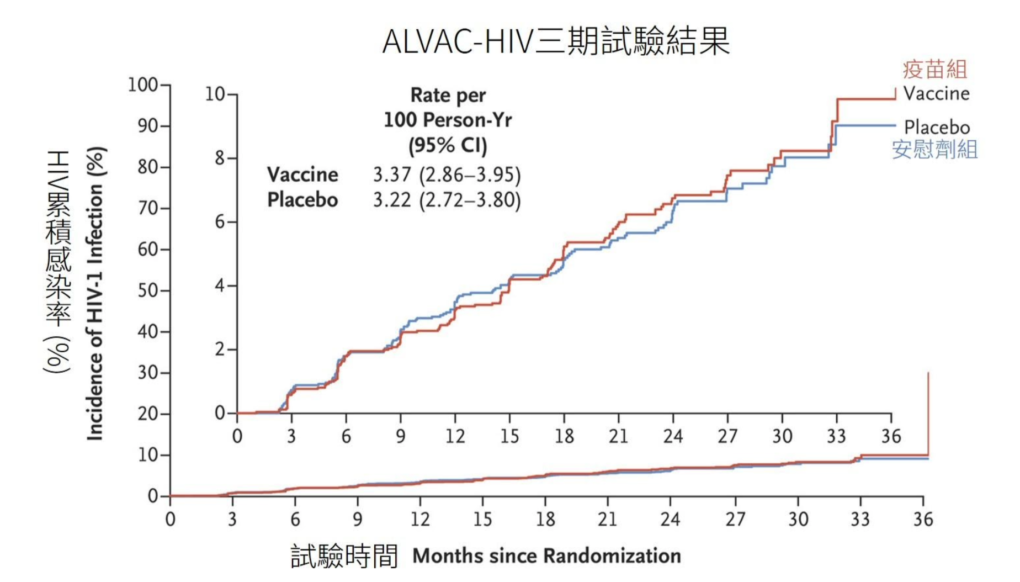
二期試驗數據 ≠ 三期試驗數據 ≠ 疫苗真實保護力,最近的例子是 HIV(愛滋病疫苗)[註3]。今年3月的《新英格蘭醫學期刊/The New England Journal of Medicine》刊出,葛蘭素史克贊助的 ALVAC-HIV 疫苗三期臨床試驗失敗[10]。儘管該疫苗在二期試驗裡表現優秀、多數受試者產生愛滋病毒蛋白的抗體[11]。但在真實世界的考驗下,發現疫苗幾乎沒有保護力;兩年的追蹤下,疫苗組 138 人感染愛滋病毒、安慰劑組 133 人感染(疫苗:安慰劑人數約 1:1),達到提前終止的無效標準 [10]。
因此可以了解,二期試驗數據 ≠ 疫苗在真實世界的保護力。儘管國產疫苗進度落後於歐美大廠,仍希望高端、聯亞等企業能完成三期試驗、在科學上證實國產疫苗的保護力,才能協助台灣人民抵禦病毒、保護健康。
保持冷靜,繼續前進。Keep Calm and Carry On.
註 1:第一個蛋白質類型疫苗是透過收集、純化 B 型肝炎患者血液內的病毒蛋白質而成,於 1981 年推出。後因成本、安全性等因素,被基因改造酵母菌產出病毒蛋白的製程所取代。
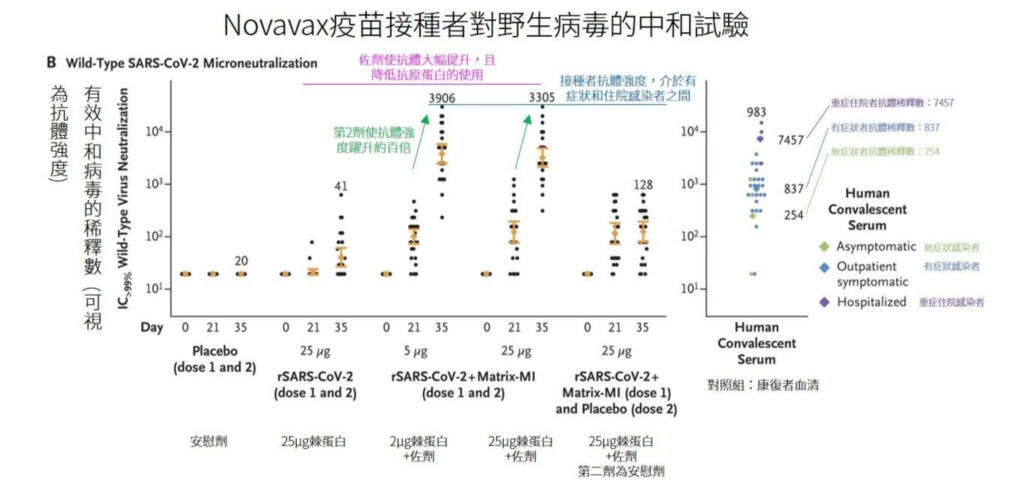
註 2:可惜的是,該報告沒有區分康復者血清(如:區分為重、中、輕症感染者)。若能區分康復者病況,就能進一步判斷疫苗免疫力強度的優劣。以 Novavax 的一期試驗報告為例,該報告細分不同病情的康復者血清,因此判斷 Novavax 疫苗,能誘發比有症狀感染者更強的抗體。
註 3:引發愛滋病的病毒的名稱是人類免疫缺陷病毒(HIV),因此愛滋病是患者病況惡化後的名稱,而非病毒的稱呼。但在中文的使用者習慣中,似乎會將兩者混用。為符合多數中文讀者的閱讀習慣,本文暫不區分。
參考文獻
- Vaccine-associated paralytic polio (VAPP) and vaccine-derived poliovirus (VDPV). WHO
- Paul-Henri Lambert (2006) A successful vaccine that missed its target. Nature Medicine. DOI: https://doi.org/10.1038/nm0806-879
- Prefusion Coronavirus Spike Proteins and Their Use. US National Institutes of Health/NIH
- Tsun-Yung Kuo, Meei-Yun Lin, Robert L. Coffman, John D. Campbell, Paula Traquina, Yi-Jiun Lin, Luke Tzu-Chi Liu, Jinyi Cheng, Yu-Chi Wu, Chung-Chin Wu, Wei-Hsuan Tang, Chung-Guei Huang, Kuo-Chien Tsao & Charles Chen (2020) Development of CpG-adjuvanted stable prefusion SARS-CoV-2 spike antigen as a subunit vaccine against COVID-19. Scientific Reports. DOI: https://doi.org/10.1038/s41598-020-77077-z
- Lianpan Dai & George F. Gao (2021) Viral targets for vaccines against COVID-19. Nature Reviews Immunology. DOI: https://doi.org/10.1038/s41577-020-00480-0
- Szu-Min Hsieh, Wang-Da Liu, Yu-Shan Huang, Yi-Jiun Lin, Erh-Fang Hsieh, Wei-Cheng Lian, et al. (2021) Safety and immunogenicity of a Recombinant Stabilized Prefusion SARS-CoV-2 Spike Protein Vaccine (MVCCOV1901) Adjuvanted with CpG 1018 and Aluminum Hydroxide in healthy adults: A Phase 1, dose-escalation study. EClinicalMedicine.DOI: https://doi.org/10.1016/j.eclinm.2021.100989
- Ian R. Tizard (2021) Adjuvants and adjuvanticity. Vaccines for Veterinarians. DOI: 10.1016/B978-0-323-68299-2.00016-2
- Shan Su, Lanying Du & Shibo Jiang (2021) Learning from the past: development of safe and effective COVID-19 vaccines. Nature Reviews Microbiology. DOI: https://doi.org/10.1038/s41579-020-00462-y
- Andrew W. Lindsley MD, PhD, Justin T. Schwartz MD, PhD, Marc E.Rothenberg MD, PhD (2020) Eosinophil responses during COVID-19 infections and coronavirus vaccination. Journal of Allergy and Clinical Immunology. https://doi.org/10.1016/j.jaci.2020.04.021
- Glenda E. Gray, M.B., B.Ch., Linda-Gail Bekker, M.B., Ch.B., Ph.D., Fatima Laher, M.B., B.Ch., Mookho Malahleha, M.B., Ch.B., M.P.H., Mary Allen, B.S.N., M.S., Zoe Moodie, Ph.D., Nicole Grunenberg, M.D., Yunda Huang, Ph.D., Doug Grove, M.S., Brittany Prigmore, M.S., Jia J. Kee, M.S., David Benkeser, Ph.D., et al., for the HVTN 702 Study Team (2021) Vaccine Efficacy of ALVAC-HIV and Bivalent Subtype C gp120–MF59 in Adults. The New England Journal of Medicine. DOI: 10.1056/NEJMoa2031499
- Fatima Laher, Zoe Moodie, Kristen W Cohen, Nicole Grunenberg, Linda-Gail Bekker, Mary Allen, Nicole Frahm, Nicole L Yates, Lynn Morris, Mookho Malahleha, Kathryn Mngadi, Brodie Daniels, Craig Innes, Kevin Saunders, Shannon Grant, Chenchen Yu, Peter B Gilbert, Sanjay Phogat, Carlos A DiazGranados, Marguerite Koutsoukos, Olivier Van Der Meeren, Carter Bentley, Nonhlanhla N Mkhize, Michael N Pensiero, Vijay L Mehra, James G Kublin, Lawrence Corey, David C Montefiori, Glenda E Gray, M Juliana McElrath, Georgia D Tomaras (2020) Safety and immune responses after a 12-month booster in healthy HIV-uninfected adults in HVTN 100 in South Africa: A randomized double-blind placebo-controlled trial of ALVAC-HIV (vCP2438) and bivalent subtype C gp120/MF59 vaccines. PLoS Medicine. https://doi.org/10.1371/journal.pmed.1003038