- 作者/李威震醫師
- 本文轉載自 Care Online 照護線上《肝臟移植重點講解,換肝專家圖文說明》,歡迎喜歡這篇文章的朋友訂閱支持 Care Online 喔!

談到肝,大家腦海都會冒出「肝不好,人生是黑白的」這句深植人心的廣告詞。肝臟是全身最大的內臟器官,負責多種生理功能,包括肝臟會製造膽汁來幫助脂肪、膽固醇、以及脂溶性維生素的吸收;多種的營養素、藥物進到體內後,需要肝臟處理、代謝;肝臟能幫助分解血液中的有毒物質;肝臟可製作多種凝血因子、合成蛋白質、並能調節免疫反應。身負重任的肝臟若是功能衰竭,身體機能就會受到嚴重影響。
肝臟移植權威、林口長庚紀念醫院外科部部主任李威震教授指出,很多原因都可能導致肝臟衰竭,例如慢性病毒性肝炎、酒精性肝炎、膽道疾病、脂肪肝等,皆會使肝臟慢性發炎,漸漸進入肝硬化,甚至肝癌。當肝臟機能嚴重受損,目前沒有替代方案能夠取代肝臟功能,因此,「肝臟移植」是患者需要考慮的重要治療選擇。林口長庚紀念醫院有經驗豐富的肝臟移植團隊,幫助患者重獲健康新生活。
李威震教授帶領的移植團隊多次創下台灣肝臟移植的紀錄,於 2003 年完成國內首例分肝手術,並獨創的「李氏公式」成功將一個肝臟移植給兩位患者;2006 年完成國內首例血型不相容患者的活體移植;2019 年完成國內首例、全世界第二例的孕期肝臟移植手術,再次立下台灣移植醫療史的里程碑。
除舊植新:肝臟移植手術如何進行?
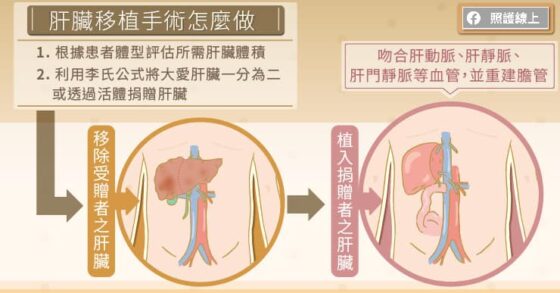
李威震教授表示,肝臟移植手術相當複雜,首先要從捐贈者身上取下健康的肝臟,並要移除受贈者身上原本受損的肝臟,再植入捐贈者的健康肝臟。在取下肝臟與植入肝臟的過程中,醫師需要截斷或吻合肝動脈、肝靜脈、肝門靜脈等多條血管,還要重建膽管,讓膽汁能順利流入腸道。
「捐贈者的身分可能是大愛捐贈的腦死患者,或是患者五等親內的活體捐贈。」李威震醫師道:「我們還可以把從大愛捐贈的肝臟分成兩半,分別移植給兩位的受贈者。」
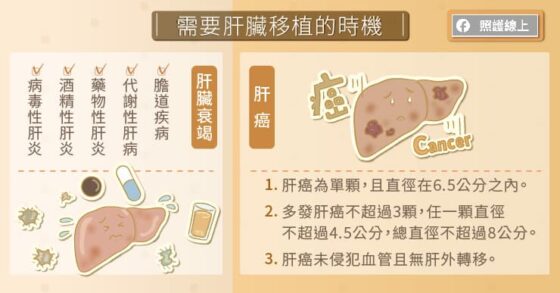
由於受贈者的肝臟功能已經受損,凝血功能很差,而肝臟內含非常大量的動脈、靜脈,是個具有大量血管的器官,因此比起一般手術,患者在肝臟移植手術過程中大量失血的可能性更大。
醫師會打開患者腹腔,確定腹內沒有腫瘤轉移後,逐步分離出重要的血管並取下受損的肝臟,這過程可能就得耗費四到五個小時;之後再將捐贈者的肝臟植入於受贈者體內。若患者的身體狀況不佳,困難程度還會提升。
肝臟移植手術過程複雜,可說是最困難的手術之一,時間可能長達十個小時。不過,李威震醫師卻曾經率領移植團隊創下紀錄,一天內完成四台肝臟移植手術。
捐肝會不會影響健康?肝臟移植術前計畫很重要!
目前肝臟移植的來源有兩種,一種是大愛捐贈的腦死患者,另一種是患者五等親內的活體捐贈。或許大家會覺得很奇怪:「肝臟只有一個,如何能將肝臟活體捐贈給親屬呢?」
李威震教授指出,擬定移植計畫時,要先評估受贈者的體型,了解需要多大體積的肝臟才能滿足生理需求。肝臟移植手術前,會根據捐贈者腹部電腦斷層掃描的結果,經過複雜的微積分計算,確立捐贈肝的份量。而且絕對要以不傷害捐贈者的健康為前提,也就是手術後捐贈者剩下的肝臟體積不能少於原本肝臟的三成。
台灣肝臟移植以親屬捐贈的活體移植為主,肝臟有強大的再生能力,且台灣技術與歐美及亞洲先進國家並駕齊驅,捐贈者的健康大多不會受到影響,術後只要在家好好休養,不需服用藥物,肝臟就會漸漸恢復到原本體積的八至九成,肝功能也可恢復至與一般人無異。
至於,大愛捐贈的肝臟要如何分成兩半,捐給不同的受贈者呢?分肝手術並不容易,利用李威震教授創立的「李氏公式」,能夠更精準且快速地達成目標。
「正常的肝臟血流有75%來自於門靜脈,門靜脈的分叉可以分成左右兩邊,或變成三叉狀,」李威震醫師道:「肝臟的體積大小與血流量成正比,因此我們透過計算肝臟分支血管的截面積,就能了解不同部分的體積比例。」
李式公式曾被發表於國際知名醫學雜誌,由於操作簡便快速,在臨床運用上值得信賴,目前國內外許多醫學中心也都採用李氏公式來執行分肝手術,讓大愛捐贈的肝臟幫助更多的人。
血型不相容、孕期肝衰竭:突破肝臟移植手術的困境
過去台灣開放的活體移植手術捐肝者條件是患者的三等親,後來卻常因為「血型不相容」而找不到捐贈者,現在已開放到五等親可以捐贈。
台灣第一例打破血型不相容困境的就是李威震醫師率領的移植團隊,從 2006 年起做了第一例血型不相容的肝臟移植手術後,也將經驗分享給其他移植團隊,讓更多有意願的捐贈者能達成幫助罹病親屬的夢想,對於小家庭的罹病者來說,更是一大福音。
「我們現在已駕輕就熟,」李威震醫師笑著說:「在經過適當的處理後,血型不相容已經不會影響肝臟移植患者的存活率。」
李威震醫師的另一項創舉是替孕婦做肝臟移植。部分孕婦可能在懷孕期間,突然 B 型肝炎發作,導致急性肝衰竭。原本這是一個令人束手無策的難題,因為進行肝臟移植,麻醉與手術會對孕婦造成很大的影響,而術後的免疫抑制藥物則可能影響胎兒。
執行孕婦肝臟移植除了需要精湛手術技巧外,也需要醫師對胚胎學及婦產科等知識有足夠了解,目前全世界曾完成孕婦肝臟移植的案例僅約五例,其中成功生產的有三例,而李威震醫師就完成其中一例。
不抽菸喝酒、穩定使用免疫抑制劑,提升肝臟移植術後照護存活率
影響移植術後存活率的重大關鍵是穩定使用免疫抑制劑,患者術後須透過免疫抑制劑來抑制免疫系統,降低對新器官的排斥反應,延長新器官存活時間,提高存活率。
「持續穩定服用免疫抑制劑十分重要,」李威震教授提醒道:「如果移植後患者沒有乖乖服藥,身體會對新的肝臟產生排斥反應。
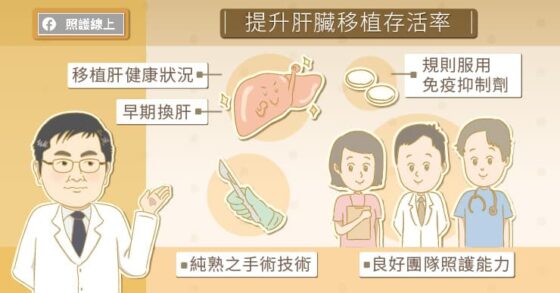
這時便需增加抗排斥藥的劑量才能控制免疫反應,但也會增加患者感染的機會,還可能傷害腎功能、增加癌症發生的機會,肝臟也會反覆受傷。」所以,若受贈者於服用藥物期間感到任何不適,都應儘快回診與醫師討論,或與個案管理師、協調師聯絡,千萬不能自行停藥或減藥。
接受一個新的肝臟,就像是獲得重生,「希望患者好好珍惜照顧自己的身體,」李威震醫師殷切地交待:「不抽菸、不喝酒、不嚼檳榔,務必改掉各種不良生活習慣,記得按時服藥,並與醫療團隊密切合作!」
- 本文轉載自 Care Online 照護線上《肝臟移植重點講解,換肝專家圖文說明》,歡迎喜歡這篇文章的朋友訂閱支持 Care Online 喔!
- 加入照護線上 LINE 官方帳號,健康資訊不漏接!