- 文/王子維│臺北醫學大學醫學系二年級,SLEK 創辦人
面對千奇百怪的病原,我們的身體並不會輕易就範,且總會為我們的生存拚盡全力一戰,其中一個例子,就是發燒。
無論如何,你一定有發燒的經驗。你可能也和我一樣,在感受眼底快被灼傷的同時,只能無助地問上天:「我們到底為什麼要發燒? 」
「發燒是為了燒死你身體內的病毒喔!」這個說法,你一定聽過,但它其實並不完全正確。究竟發燒是怎麼發生的呢?
在高中我們學過,下視丘是體溫調節中樞。下視丘是中樞神經系統的一部份,但我們不會等到病毒或細菌本身「入駐」中樞神經系統的當下才開始發燒——相對地,那只是我們的免疫系統正在奮勇應戰,順便發個支援訊號給我們的神經系統的結果罷了。
那麼,發燒是怎麼開始的?這關鍵的生理反應都與免疫系統中的「信號彈」──細胞激素有關。
在本篇文章中將說明身體如何「炮製可發動全面警戒的信號彈」的——要完整解讀這句話,你就必須知道細胞激素的定義、我們發燒的機轉、退燒藥的機制,以及這些細胞激素到底怎麼體現「星星之火,可以燎原」的真締。
警告:閱讀此篇將解開存在你心中的萬年疑惑,並讓你再次嘆服人體的奧秘,請小心服用。
免疫系統的「信號彈」:細胞激素
「我們體內的免疫細胞是如何溝通的?」
你的體內,共有約 7.5*109 個嗜中性球在血液中隨時巡邏著 1, 註1 。而你知道,你的免疫系統中絕不只有嗜中性球在工作,還有諸如巨噬細胞、自然殺手細胞等細胞也正在高喊著「はたらく!」註2。
那麼萬一你的手指被劃傷,這些負責免疫功能的細胞如何感知並迅速聚集,以防止在傷口外面的各式病原趁虛而入?就是靠細胞激素。

細胞激素之於免疫系統,就如信號彈之於軍隊,可以快速、大範圍地通知或召集其他免疫細胞,以產生身體此時所需的免疫反應。說到訊號傳遞,你或許會想到動作電位。對於以動作電位傳遞訊息的神經,不同訊號傳遞的重點在於動作電位的頻率改變,而不在其強度或離子種類。
不過細胞激素就不是這麼一回事了——光是著名的大學免疫學課本《 Janeway’s Immunobiology 》的附錄中,就描述了 64 種細胞激素的大小、來源以及其受器、功能等。每種細胞激素就如五顏六色的信號彈,每種信號彈都有其目標、功能以及意義,有時甚至不同的組合還會產生不同的高階功能!
雖然細胞激素十分複雜,但對於理解發燒機轉不需要灰心喪志,請放心,我今天只有要提到三種與發燒最相關的關鍵細胞激素:
- 介白素-1β(Interleukin-1β):主由巨噬細胞、上皮細胞分泌,以下簡稱 IL-1β
- 介白素-6(Interleukin-6):由淋巴球、巨噬細胞、上皮細胞分泌,以下簡稱 IL-6
- 腫瘤壞死因子(Tumor Necrosis Factor-α):由巨噬細胞、自然殺手細胞、T細胞 分泌,以下簡稱 TNF-α
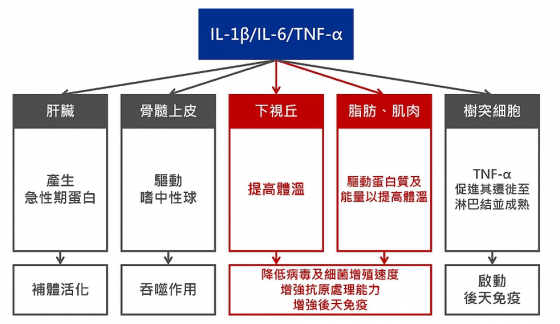
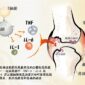
IL-1β、IL-6 及 TNF-α 到底是何方神聖?請見下圖。他們的功能令人眼花撩亂,但最重要的是:他們與發燒脫不了關係。
細胞激素如何引發身體「全面警戒」而發燒?
「我們是如何發燒的?」要了解我們是如何達到「發燒」的狀態,那麼就要先了解我們的身體是如何感知並維持現在的體溫。
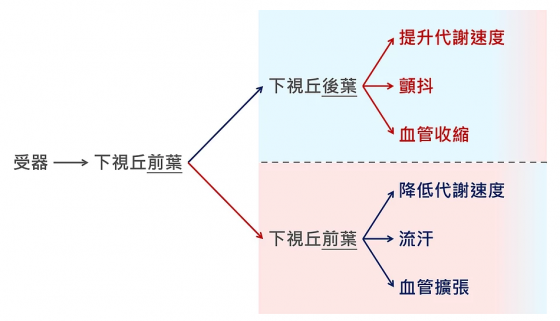
首先,皮膚裡、下視丘中的溫度受器「讀取」周遭的溫度後,將訊息傳遞至下視丘前葉。下視丘前葉就像握有考試答案的老師一樣,時刻比對著現在的體溫是否如標準答案所寫的一樣。
如果量測到的體溫比設定值來得低,那麼下視丘後葉則會以提高代謝速度、顫抖、血管收縮等方式使體溫上升;相對地,若下視丘前葉量測到的體溫比設定值高,那麼諸如流汗、血管擴張等等的散熱機制,由下視丘前葉負責活化。
對,我沒有寫錯,降低體溫的指令一樣由下視丘前葉送達各動器。
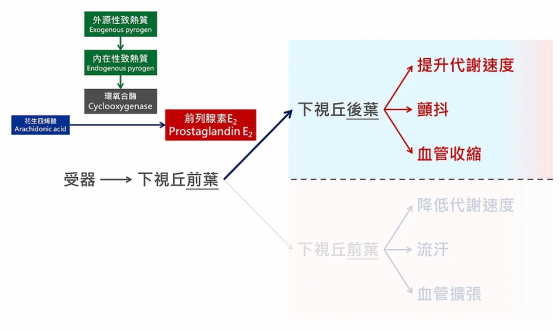
至於發燒的起點,就不得不提到前列腺素 E2(Prostaglandin E2)這種激素了,而前列腺素 E2 是由花生四烯酸(Arachidonic acid)透過環氧合酶(Cyclooxygenase,COX)合成的。環氧合酶又可分成較常被表現的 COX-1 ,和較易被物質(如細胞激素)誘導產生的 COX-22 。
剛剛提到下視丘前葉是決定是否調整體溫的中樞,而前列腺素 E2 的功能就是提高「標準溫度」,促進身體產熱。我們於第一段提到的三種細胞激素,都屬於「內在性致熱質」(Endogenous pyrogens),因為是由我們身體自己產生的,並且會促進下視丘前葉產生前列腺素 E2 ,讓後葉負責提高體溫。
既然有「內在性致熱質」,那自然有「外源性致熱質」(Exogenous pyrogens)啦,革蘭氏陰性菌獨有的脂多醣(Lipopolysaccharide,LPS)就是其中一種。外源性致熱質可促使內在性致熱質的產生,也可以直接促進環氧合酶的產生,進而製造更多前列腺素 E2 ,殊途同歸,讓你發燒。
發燒通常對你是有利的,因為大部分的病原適合在較低溫的環境生存,而且後天免疫反應在高溫下會更加強大。在溫度升高的同時, TNF-α 則負責保護你的細胞免受高溫的傷害。
不過,就如免疫系統有可能被過度激發而導致過敏(詳情可見由水過敏淺談過敏機制與症狀(上)),當這些強而有力的信號彈被外源性致熱質過度點燃時,我們的生理機能就會開始產生紊亂。而這,就稱為細胞激素風暴(Cytokine storm)。
除了剛剛提到的革蘭氏陰性菌的脂多醣,近期流行的 2019-nCoV 也屬於能點燃細胞激素風暴的外源性致熱質。在感染 2019 新型冠狀病毒的重症患者血液中,能檢驗出大量促進發炎的細胞激素(例如IL-1β)3;而感染 SARS-CoV 和 MERS-CoV 的患者,血液中也都檢測出了異常大量促進發炎的細胞激素4,5。
細胞激素如何解開封印發大招?「炮製」信號彈的起點
「免疫細胞如何決定何時釋放細胞激素呢?」
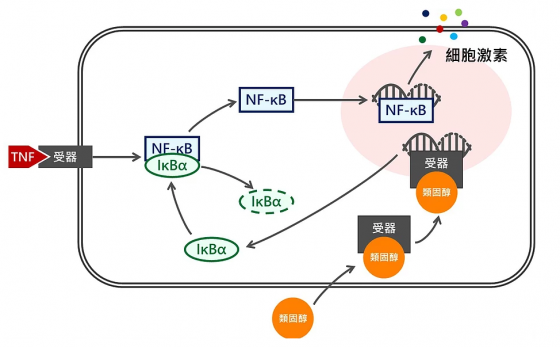
首先可以想像的是,我們絕對不會允許自己的身體無緣無故生成一堆信號彈(尤其它們還這麼危險),應該要在再三確認需要啟動信號彈後,由上級機關發下「製造信號彈」的命令。在我們的體內,這張命令就稱為 NF-κB 。
但是,這張命令理所當然地會被包在一個有彌封的信封袋裡(畢竟沒人希望這麼重要的機密被大家一覽無遺),於是要執行這個命令前,還需先拆除這個彌封,這個「彌封」在我們體內稱為 IκBα 。

在正常狀況下, NF-κB 與 IκBα 這兩個蛋白會鍵結在一起,而當起啟動免疫反應的細胞激素(例如剛剛提到的 TNF-α)與細胞膜上的受器結合,就會讓彌封被打開—— IκBα 改變形狀,使其脫離 NF-κB 。這個變化使身為命令的 NF-κB 可以進入宛如「兵工廠」的細胞核,啟動一段特定基因序列的轉錄轉譯,製造細胞激素。
這些細胞激素,可說是命裡注定捲入一場永無止盡的紛爭——除了製造細胞激素時 NF-κB 與 IκBα 的互相牽制,就連製造出細胞激素後促進發炎與抑制發炎的細胞激素也會相互拮抗,以免任何一方的勢力大到一去不復返。
各種消炎止痛藥,如何「封印」細胞激素
你一定聽過類固醇類藥物可以消炎止痛。其實它們的作用原理很簡單:這些藥物和細胞膜上的受器結合後,會一同進入細胞核,並啟動 IκBα 的生成。隨著「彌封」愈來愈多,被細胞核宣讀的命令數量就會減少,進而抑制細胞激素的產生。
固醇類藥物之所以會惡名昭彰,是因為長期使用可能會造成的副作用。也因為這類副作用較多,非類固醇消炎藥(Non-Steroidal Anti-Inflammatory Drug,縮寫作 NSAID)的需求也就應運而生。
那麼非類固醇消炎藥的作用機轉,也跟前面的發燒機制有關係。
剛剛提到環氧合酶可分成 COX-1 和 COX-2,都會生成造成發燒的前列腺素 E2 。傳統消炎藥(Traditional Non-Steroidal Anti-Inflammatory Drug,縮寫作 tNSAID)的作用機轉是同時抑制 COX-1和 COX-2 的活性,進而降低前列腺素 E2 的生成。而普拿疼這款非常特別的止痛藥,其有效成分乙醯胺酚(Acetaminophen)也會同時抑制 COX-1 和 COX-2 的活性,但其效用較弱,無法對抗發炎,只能止痛、退燒6,7,8。
不過由於 COX-1 同時負責了許多的正常生理機能(例如維持黏膜組織的完整性)9,現今的研究方向偏向可專門抑制 COX-2 的活性的消炎藥,但目前此類藥物仍有許多副作用,例如嚴重的心血管疾病10。

讀到這裡,你若感到「人生很難」,那就對了——我的意思是人活著就是件很不容易的事,而你的免疫系統能在大部分的狀況完成其被賦予的神聖使命,都要拜這些對你來說可能無法完全理解的細胞激素們所賜。
事實上,你的身體時刻都在執行著比這還要複雜萬倍的各種生理機能,使用著如細胞激素、荷爾蒙、神經遞質等的各種訊息傳遞物,密切地和別處的自己溝通。所以,在為發燒感到人生很難時,不妨思考一下自己的身體正在為了你進行怎樣的戰爭,對你的細胞們說聲「頑張って」註三!
註釋
- 本數據計算方式為:體中 65 公斤成年人約有 5 公升血液,根據參考資料1 ,平均嗜中性球密度為 1.5 × 109/L。此數值僅供參考,其實際數量隨血量、性別等因素會有所變化。
- 《はたらく細胞》,中譯《工作細胞》,日本漫畫家清水茜所著的日本漫畫作品,後被改編成動漫。主要講述經擬人化後人體內各種細胞於人體內的日常工作。
- 頑張って,中文諧音「甘吧爹」,意近「加油吧!」。
參考資料
- Haddy, T. B., Rana, S. R., & Castro, O. (1999). Benign ethnic neutropenia: what is a normal absolute neutrophil count?. Journal of Laboratory and Clinical Medicine, 133(1), 15-22.
- Smyth, E. M., Grosser, T., Wang, M., Yu, Y., & FitzGerald, G. A. (2009). Prostanoids in health and disease. Journal of lipid research, 50(Supplement), S423-S428.
- Huang, C., Wang, Y., Li, X., Ren, L., Zhao, J., Hu, Y., … & Cheng, Z. (2020). Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. The Lancet.
- Wong, C. K., Lam, C. W. K., Wu, A. K. L., Ip, W. K., Lee, N. L. S., Chan, I. H. S., … & Sung, J. J. Y. (2004). Plasma inflammatory cytokines and chemokines in severe acute respiratory syndrome. Clinical & Experimental Immunology, 136(1), 95-103.
- Mahallawi, W. H., Khabour, O. F., Zhang, Q., Makhdoum, H. M., & Suliman, B. A. (2018). MERS-CoV infection in humans is associated with a pro-inflammatory Th1 and Th17 cytokine profile. Cytokine, 104, 8-13.
- Graham, G. G., Davies, M. J., Day, R. O., Mohamudally, A., & Scott, K. F. (2013). The modern pharmacology of paracetamol: therapeutic actions, mechanism of action, metabolism, toxicity and recent pharmacological findings. Inflammopharmacology, 21(3), 201-232.
- Boutaud, O., Aronoff, D. M., Richardson, J. H., Marnett, L. J., & Oates, J. A. (2002). Determinants of the cellular specificity of acetaminophen as an inhibitor of prostaglandin H2 synthases. Proceedings of the National Academy of sciences, 99(10), 7130-7135.
- Aronoff, D. M., Oates, J. A., & Boutaud, O. (2006). New insights into the mechanism of action of acetaminophen: its clinical pharmacologic characteristics reflect its inhibition of the two prostaglandin H 2 synthases.
- Brzozowski, T., Konturek, P. C., Konturek, S. J., Sliwowski, Z., Pajdo, R., Drozdowicz, D., … & Hahn, E. G. (2001). Classic NSAID and selective cyclooxygenase (COX)‐1 and COX‐2 inhibitors in healing of chronic gastric ulcers. Microscopy research and technique, 53(5), 343-353.
- Grosser, T. (2006). The pharmacology of selective inhibition of COX-2. Thrombosis and haemostasis, 96(10), 393-400.
本文轉載自 SLEK,原文標題〈星星之火,可以燎原——淺談發燒機轉〉