本文由《唐獎教育基金會》委託,泛科學企劃執行
- 作者/Jaffer Yang
2020 年,唐獎生技醫藥獎頒發給三位對細胞激素 (cytokine) 有卓越貢獻的研究者:查爾斯·迪納雷羅 (Charles Dinarello) 教授、馬克·費爾德曼 (Marc Feldmann) 教授及岸本忠三 (Tadamitsu Kishimoto) 教授。
他們分別發現了不同的細胞激素於發炎反應中的關鍵角色,對於許多與發炎反應有關之疾病的臨床治療,有著劃時代的影響。到底什麼是細胞激素?它們在人體內如何運作?從研究到實際運用於治療疾病又是一段怎樣的旅途?
在人體內呼風喚雨的細胞激素
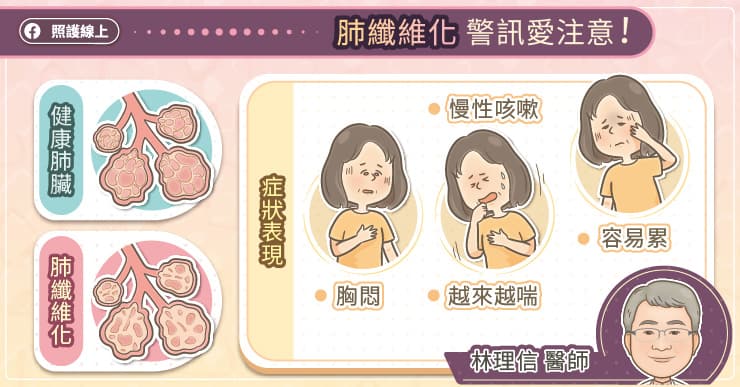
若把我們的身體想像成一棟大樓,那麼造成「紅、腫、熱、痛」這些症狀的發炎反應,好似大樓中的安全警報設備,警報響起時會引起連串後續反應;而發炎反應正是在病原體入侵身體或身體受損時,啟動的一系列防禦機制。「細胞激素」是啟動發炎反應的重要角色,做為啟動的前置訊號,若能了解其調控原理,便能藉此治療多種相關的疾病症狀,如自體免疫性疾病。
細胞激素是一類相對較小的蛋白質 (<40 kDa),可視為細胞彼此進行溝通的訊號傳遞分子,就像大樓警報響起會引來保全人員、或引發消防系統噴水,細胞素能在短時間內召喚大量白血球或啟動發炎反應。但若是這套系統失控,可能導致嚴重的後果:例如「細胞激素風暴」 (cytokine storm) 就是訊號錯亂引發的過度免疫反應,嚴重起來可能造成器官損傷或衰竭,甚至導致死亡。
另外,細胞激素還有兩大特性:「多效性」(pleiotropic) 和「重複性」(redundant)。多效性指的是一種細胞激素,可以作用在不止一個目標上,而發揮多重的生理功能;重複性則是指不同細胞激素,可能會有相似之功能或是功能重疊。細胞激素在身體內,形成了一個非常複雜且交纏的系統。
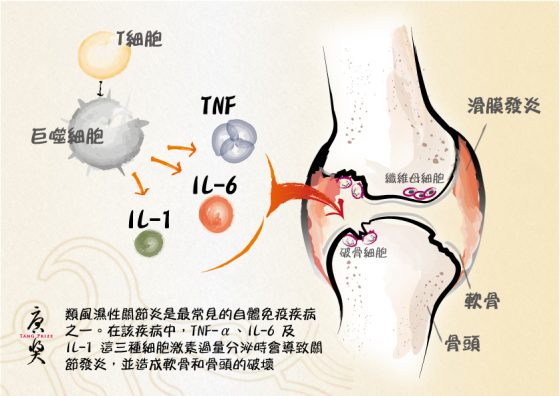
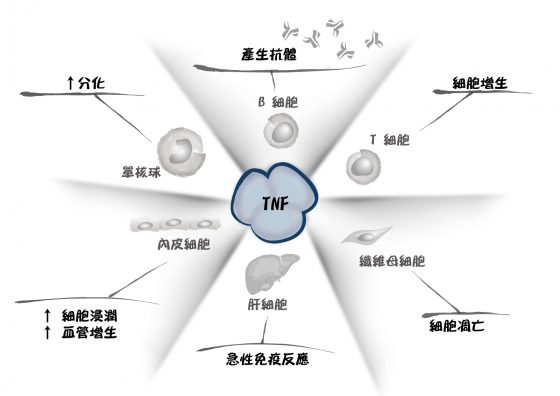
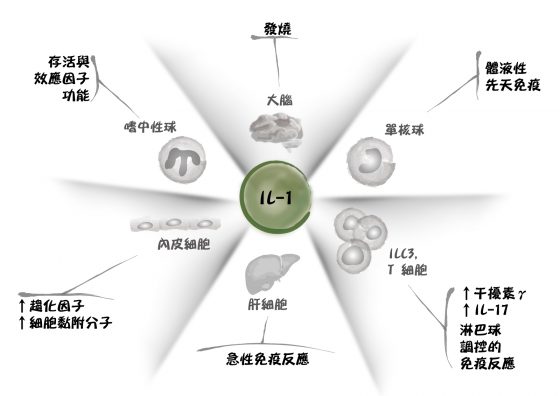
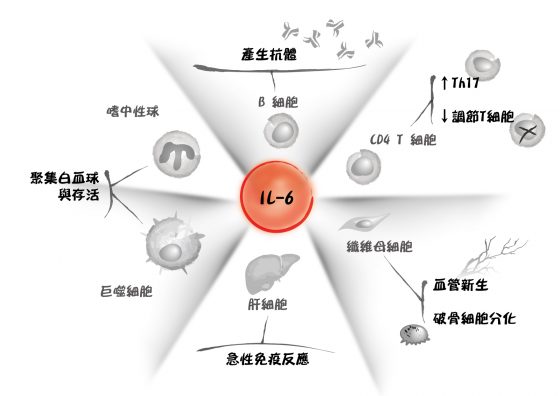
細胞激素的發現與應用,是眾多研究者的心血。而本次 2020 唐獎生技醫藥獎的三位得主,對於細胞激素的研究有承先啟後的重大意義。他們分別發現了腫瘤壞死因子 (TNF)、介白素-1 (IL-1) 及介白素-6 (IL-6) [註解] 在發炎反應中的關鍵性,並對相關疾病的臨床治療上貢獻卓著,像是過度發炎造成的發炎性疾病,或是免疫反應不分敵我、攻擊正常細胞的自體免疫疾病。
治療自體免疫疾病「類風濕性關節炎」的重大發現
現任英國牛津大學教授及牛津大學薩默維爾學院 (Somerville College) 資深研究員的馬克·費爾德曼 (Marc Feldmann),在 1980 年代時,就發表了關於自體免疫疾病誘導機制的假說,強調細胞激素的作用。
他從 1984 年開始研究類風濕性關節炎,並率先證明在患者的關節處出現異常多的促發炎細胞激素(以 TNF 為主)。接著他與同事合作,進一步研究造成類風濕性關節炎的疾病機制,提出抑制 TNF 即可治療關節炎的學說,從動物實驗的小鼠模型中亦獲得證據支持,只要利用特定抗體來抑制 TNF 就能減緩發炎症狀。
圖/唐獎提供
為了將實驗室內的發現轉換成有效的治療方法,費爾德曼教授與藥廠合作。後續人體臨床試驗的成果也不負眾望,能阻斷 TNF-α 訊號的單株抗體藥物 infliximab,成功獲得批准上市。
如今,抑制 TNF 已成為用於治療類風濕性關節炎、其他自體免疫及發炎性疾病的標準療法,陸續也有不同藥廠推出其他種抑制 TNF 的藥物。這讓苦於過往無效療法的患者,有了新的希望跟途徑以穩定控制疾病。費爾德曼教授一路從提出疾病機制學說、發現藥物,到實際臨床應用,讓自體免疫及發炎性疾病的治療向前大步邁進。
開創細胞激素領域研究的重要先驅
現任美國科羅拉多大學醫學教授的查爾斯·迪納雷羅 (Charles Dinarello),是細胞激素研究的開山鼻祖,他於 1974 年研究發現了史上第一個介白素 IL-1β,接著於 1977 年純化出 IL-1β,並開發了一種免疫測定法以確定其存在。
後來他與其他科學家合作,辨識出另一個相關的蛋白質 IL-1 受體拮抗因子 (IL-1 receptor antagonist, IL-1Ra),可以抑制 IL-1 的生物活性。IL-1Ra 的作用機制是占據 IL-1 的受體(細胞上的接收器),使 IL-1 無處施力,無法再活化更多的免疫細胞,因此能減緩發炎反應。IL-1Ra 也被開發成名為 anakinra 的藥物,用以治療類風濕性關節炎等自體免疫及發炎性疾病。
圖/唐獎提供
自 1984 年以來,已有三種藥物被批准用來減輕由 IL-1β 引起的發炎性疾病。近期,一項包括 10,000 多名患者的全球性臨床試驗研究結果顯示,針對 IL-1β 的中和性抗體 (neutralizing antibody) 可以降低癌症發病率和死亡率。臨床的發展使 IL-1 被確認是發燒及發炎性疾病中的關鍵調控者,甚至在癌症也扮演重要角色,進而催生各種以 IL-1 為標的之治療新方向,這些都印證了迪納雷羅教授對細胞激素生物學以及發炎性疾病病因的貢獻。
推動細胞激素研究及應用往前大躍進
現任日本大阪大學教授的岸本忠三 (Tadamitsu Kishimoto),發現 IL-6 是調節抗體產量的細胞激素,並證明 IL-6 和許多發炎性疾病的成因有關。
圖/唐獎提供
早在 1970 年代初期,他就發現 T 細胞培養的上清液(意指離心處理後不含細胞的上層培養液,含有细胞分泌出的各種蛋白質)具有誘導 B 細胞增殖、分化及產生抗體之活性,根據這些早期的研究基礎,他與其研究團隊進一步於 1980年代後期純化並選殖出 IL-6 及其受體。隨後也製備出 IL-6 受體的抗體,並協助藥廠執行大規模的臨床實驗,證明該抗體藥物 tocilizumab 對多種自體免疫疾病都有療效,包括類風濕性關節炎、幼年特發性關節炎及 Castleman 氏病等。
岸本忠三教授樹立了細胞激素生物學的研究典範,使細胞激素的研究跨進了現代的分子醫學領域,通過分析了解細胞間分子訊號的運作機制,利用此類知識來開發高效的療法,並證明對治療一系列自體免疫及發炎性疾病價值重大,造就許多臨床上的大幅躍進。
細胞激素後續的延伸應用:生物製劑的發展
可以作用於特定分子來治療疾病的蛋白質藥物或抗體藥物,醫學上稱為「生物製劑」。三位科學家對於細胞激素最大的貢獻之一,在於促成細胞激素成為疾病治療之作用標的,臨床上也發展出能反制這些發炎訊號的生物製劑。造福了成千上萬因自體免疫或發炎性疾病而受苦的患者,讓患者找回失去的生活品質。
回到一開始的比喻,細胞激素做為安全警報設備的啟動鈴聲,其功能除了已知在自體免疫及發炎性疾病的進程扮演關鍵角色,基於免疫系統識別和破壞癌細胞的能力,過去十幾年科學家也非常關注如何利用不同細胞激素來治療癌症。相信未來靠著科學家群策群力,一旦能解開更多細胞激素與疾病之間的關係和機制,就可更精準地研發出「對症下藥」的生物製劑。
但這仍只是複雜生命謎團的一部分,關於細胞激素仍有許多的研究正在進行中。在這漫長的接力賽中,讓我們一起感謝三位唐獎得主的貢獻,並期待後進科學家接力開創的未來吧!
註解
不同細胞激素有著不同的功能,可分為五大類,以下簡述其功能:
- 腫瘤壞死因子 (tumor necrosis factor, TNF):的主要功能是調節免疫細胞,可以影響白血球的活化與增生、活化細胞毒殺作用等等。當分泌量失調時也會導致像是發炎性疾病、自體免疫疾病以及癌症的發生。
- 介白素 (interleukin, IL):是調節免疫和發炎反應的細胞激素,具有影響白血球的生長和分化等功能。
- 干擾素 (interferon, IFN):調節先天性免疫,可抑制病毒在細胞內複製。
- 趨化因子 (chemokine):為發炎因子,利用濃度變化來趨化白血球的遷移。
- 群落刺激因子 (colony-stimulating factor, CSF):刺激造血幹細胞的分化與增生,可增加白血球的產生。
參考資料
- Hannoodee S, Nasuruddin DN. Acute Inflammatory Response. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 2020.
- Chousterman BG, Swirski FK, Weber GF. Cytokine storm and sepsis disease pathogenesis. Semin Immunopathol. 2017;39(5):517-528.
- Tisoncik JR, Korth MJ, Simmons CP, Farrar J, Martin TR, Katze MG. Into the eye of the cytokine storm. Microbiol Mol Biol Rev. 2012;76(1):16-32.
- 2020 唐獎生技醫藥獎
- Bottazzo GF, Pujol-Borrell R, Hanafusa T, Feldmann M. Role of aberrant HLA-DR expression and antigen presentation in induction of endocrine autoimmunity. Lancet. 1983;2(8359):1115-1119.
- Brennan FM, Chantry D, Jackson AM, Maini RN, Feldmann M. Cytokine production in culture by cells isolated from the synovial membrane. J Autoimmun. 1989;2 Suppl:177-186.
- Brennan FM, Chantry D, Jackson A, Maini R, Feldmann M. Inhibitory effect of TNF alpha antibodies on synovial cell interleukin-1 production in rheumatoid arthritis. Lancet. 1989;2(8657):244-247.
- Feldmann M, Maini RN. Anti-TNF therapy, from rationale to standard of care: what lessons has it taught us?. J Immunol. 2010;185(2):791-794.
- Dinarello CA, Goldin NP, Wolff SM. Demonstration and characterization of two distinct human leukocytic pyrogens. J Exp Med. 1974;139(6):1369-1381.
- Dinarello CA, Renfer L, Wolff SM. Human leukocytic pyrogen: purification and development of a radioimmunoassay. Proc Natl Acad Sci U S A. 1977;74(10):4624-4627.
- Dinarello CA. IL-1: discoveries, controversies and future directions. Eur J Immunol. 2010;40(3):599-606.
- Dinarello CA. An Interleukin-1 Signature in Breast Cancer Treated with Interleukin-1 Receptor Blockade: Implications for Treating Cytokine Release Syndrome of Checkpoint Inhibitors. Cancer Res. 2018;78(18):5200-5202.
- Dinarello CA. An Interleukin-1 Signature in Breast Cancer Treated with Interleukin-1 Receptor Blockade: Implications for Treating Cytokine Release Syndrome of Checkpoint Inhibitors. Cancer Res. 2018;78(18):5200-5202.
- University of Colorado. Charles Dinarello Awarded the 2020 Tang Prize in Biopharmaceutical Science.
- Kishimoto T, Ishizaka K. Regulation of antibody response in vitro. VII. Enhancing soluble factors for IgG and IgE antibody response. J Immunol. 1973;111(4):1194-1205.
- Hirano T, Yasukawa K, Harada H, et al. Complementary DNA for a novel human interleukin (BSF-2) that induces B lymphocytes to produce immunoglobulin. Nature. 1986;324(6092):73-76.
- Hibi M, Murakami M, Saito M, Hirano T, Taga T, Kishimoto T. Molecular cloning and expression of an IL-6 signal transducer, gp130. Cell. 1990;63(6):1149-1157.
- Kishimoto T. Interleukin-6: from basic science to medicine–40 years in immunology. Annu Rev Immunol. 2005;23:1-21.
- Conlon KC, Miljkovic MD, Waldmann TA. Cytokines in the Treatment of Cancer. J Interferon Cytokine Res. 2019;39(1):6-21.
本文由《唐獎教育基金會》委託,泛科學企劃執行