- 文/MgO

我們都知道團結合作的力量絕對勝過孤軍奮戰,單則易折、眾則難摧。然而,可怕的癌細胞也明白這個道理。
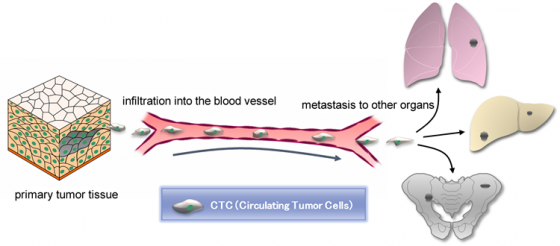
「癌症」(Cancer) 是一廣泛用詞,指細胞不正常且失控分裂增生所導致的疾病,可依變異細胞種類再細分為多種形態的癌症,像是乳房或乳腺細胞發生變異可稱為乳癌。其實,腫瘤本身不難處理,通常以外科手術切除即可,超過九成癌症患者最後是死於癌症的「轉移」 (Metastasis)1。
腫瘤轉移的起源:循環腫瘤細胞
癌細胞聚集增殖形成第一顆腫瘤 (即原位腫瘤) 的同時,少部分具有轉移能力的癌細胞會自原腫瘤處釋出到循環系統中「旅行」,這些癌細胞隨著血液的流動宛如漂泊的遊子四處尋找適合「定居」的器官組織後「下錨」(Anchor) 生長形成新的腫瘤2,3,透過這樣的方式癌細胞可蔓延全身。即使在醫術發達的現代,腫瘤形成前的癌細胞聚集仍是難以察覺,更遑論預防或治療了。
這類具有「轉移能力」的癌細胞稱為循環腫瘤細胞 (Circulating Tumor Cells, CTC),是由澳大利亞科學家 Thomas Ashworth 首先在癌轉移病人血中發現,直到 1976 年再由美國癌症專家 Peter C. Nowell 醫師將循環腫瘤細胞定義為「源自原發性腫瘤或轉移腫瘤,且具有離開基底膜與通過組織基質侵入血管能力的腫瘤細胞」4。
循環腫瘤細胞是癌症轉移的關鍵,但數量十分稀少,在每十萬至一百萬顆血球細胞中只能找到一顆,即使是在癌症末期的腫瘤轉移患者中每毫升血液也只能發現一至十顆的循環腫瘤細胞5,如此低的比例造成研究上的瓶頸。
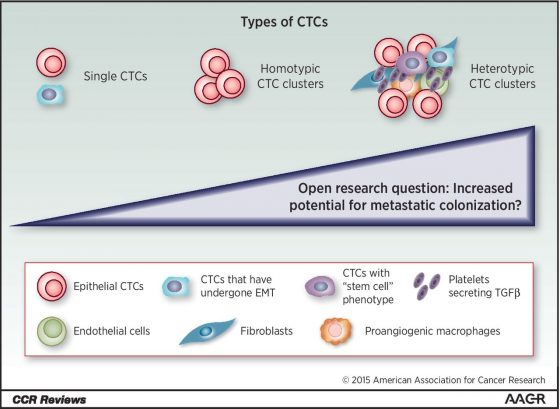
不過隨著科學研究的進步,巴塞爾大學 Nicola Aceto 教授在 2014 年首先證實導致乳癌轉移的關鍵並非是單一循環腫瘤細胞,而是循環腫瘤細胞聚集而成的細胞簇(Cluster),這些循環腫瘤細胞簇 (Circulating Tumor Cells Cluster) 比單顆循環腫瘤細胞具有更佳的轉移能力與細胞凋亡抵抗性6。
接著在 2019 年他們進一步比較單顆循環腫瘤細胞與循環腫瘤細胞簇的差異,發現循環腫瘤細胞簇 DNA 呈現較低程度的甲基化 (Methylation),而這些位置剛好是調控細胞幹性 (stemness) 及細胞增殖相關基因的 DNA 序列,因此循環腫瘤細胞簇比單顆循環腫瘤細胞具有更佳的細胞幹性、增殖能力及較強的轉移能力。此外,在乳癌患者身上也發現其循環腫瘤細胞簇的甲基化程度較低者疾病惡化存活率 (progression free survival) 也較低。
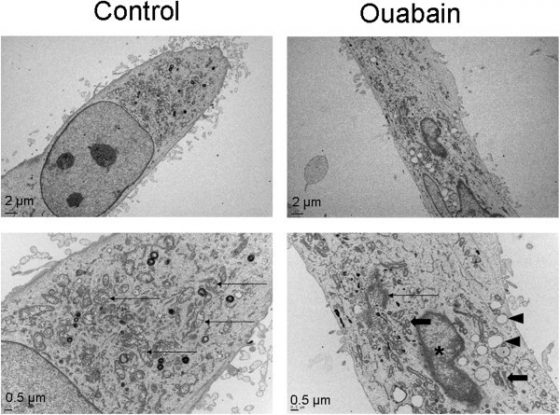
篩選出可降低循環腫瘤細胞簇的藥物?
在本項研究中,作者也針對美國食品藥物管理局 (Food and Drug Administration, FDA) 通過的 2,486 種化合物 (compound) 進行藥物篩選,並發現鈉/鉀離子三磷酸腺苷酶 (Na+/K+ ATPase) 的抑制劑──Ouabain 與 Digitoxin, 可有效降低小鼠血中循環腫瘤細胞簇比例與癌症的轉移7。
這的確是一項突破性的研究,釐清了循環腫瘤細胞簇的特徵與造成癌症轉移的原因,並篩選出可能的標的藥物。應用至臨床癌症檢驗,可依據患者循環腫瘤細胞簇比例、與甲基化程度,來評估疾病預後。但若是要將藥物應用到癌症的治療上,尚有瓶頸需突破。
Ouabain 與 Digitoxin 是強心用藥,低劑量時可治療心律不整、低血壓等心臟疾病;過量會造成心律不整或心搏下降的副作用,且對循環腫瘤細胞簇沒有專一性。若作為打散循環腫瘤細胞簇用藥,可能需增加劑量,容易造成嚴重的心臟副作用。再者,實驗中是將循環腫瘤細胞簇先以藥物處理後,再打入小鼠體內觀察腫瘤轉移的情形。意即應用於臨床,應以局部注射將藥物打到腫瘤細胞上的方式投藥,以抑制循環腫瘤細胞簇形成。這種給藥方式困難,且不確定是否可抑制「已離家」到血液中的循環腫瘤細胞簇。
儘管如此,循環腫瘤細胞簇目前已應用於多種癌症的診斷、轉移程度、疾病進程與傳統治療的評估上。如今更進一步揭開循環腫瘤細胞簇的神秘面紗,並發現鈉/鉀離子三磷酸腺苷酶抑制劑,具有打散循環腫瘤細胞簇的治療潛力,提供我們一個新的癌症治療方向。相信以循環腫瘤細胞簇為標的的癌症療法,會是未來癌症醫療的新趨勢。
參考文獻
- Fidler, I. J. The pathogenesis of cancer metastasis: the ‘seed and soil’ hypothesis revisited. Nature reviews. Cancer 3, 453-458, doi:10.1038/nrc1098 (2003).
- Massague, J. & Obenauf, A. C. Metastatic colonization by circulating tumour cells. Nature 529, 298-306, doi:10.1038/nature17038 (2016).
- Burz, C. et al. Circulating tumor cells in clinical research and monitoring patients with colorectal cancer. Oncotarget 9, 24561-24571, doi:10.18632/oncotarget.25337 (2018).
- Nowell, P. C. The clonal evolution of tumor cell populations. Science (New York, N.Y.) 194, 23-28 (1976).
- Ross, A. A. et al. Detection and viability of tumor cells in peripheral blood stem cell collections from breast cancer patients using immunocytochemical and clonogenic assay techniques. Blood 82, 2605-2610 (1993).
- Aceto, N. et al. Circulating tumor cell clusters are oligoclonal precursors of breast cancer metastasis. Cell 158, 1110-1122, doi:10.1016/j.cell.2014.07.013 (2014).
- Gkountela, S. et al. Circulating Tumor Cell Clustering Shapes DNA Methylation to Enable Metastasis Seeding. Cell 176, 98-112.e114, doi:10.1016/j.cell.2018.11.046 (2019).