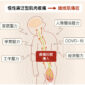
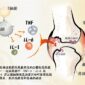
中研院基因體研究中心的謝世良特聘研究員與團隊研究發現,嗜中性白血球、巨噬細胞表面的 CLEC5A (C 型凝集素 5A)受器, 不僅能辨識入侵體內的病原體,也能調控發炎反應,維持免疫系統正常運作、清除病原體。未來有機會發展以「抑制發炎」取代直接對抗病毒細菌的療法。
反應太大啦!免疫系統過度反應,讓患者身陷險境
登革熱、禽流感等病毒疾病對人體殺傷力強大,它們的症狀不是由「病毒的複製」直接造成,而是「免疫系統的發炎反應」過於激烈,使得免疫系統尚未消滅病毒就嚴重傷害人體。此外,自體免疫疾病,例如紅斑性狼瘡、腸道炎症,也是由於免疫系統的反應過久、過強。
除了某些基因缺陷造成的症狀,幾乎所有人類疾病都是因為過度激烈的發炎。
人體發炎反應的啓動因素,是傳染性因子(Infectious Agent) 、外來抗原、自體抗原等分子,它們會結合並激發免疫細胞表面的先天免疫受體。若想建立更有效的治療策略,就必須更了解各種抗原分子與人體免疫系統的互動機制。
人體的免疫系統可以概略分為兩道防線,初步由專一性較低的先天性免疫(Innate Immunity)偵測並分解侵入的病原體,同時透過細胞素(Cytokine)等分子引起「發炎反應」、召集免疫細胞,集中火力清除外患。先天免疫相關的白血球包括:巨噬細胞、嗜中性白血球等等。
若這一道防線沒能達成目標,後天性免疫(Adaptive Immunity)便會被活化,以 T 細胞和 B 細胞族群合作,產生具針對性之抗體、以及具辨識能力的殺手細胞,更徹底地消滅特定敵人。

面對多數病源,這兩道免疫防線可提供人體良好的保護效果。不過,以「發炎反應」增強防禦時,人體也遭遇風險。
若無法有效消滅外來抗原,或是有內源性抗原(Endogenous Antigen)持續刺激免疫系統,會導致激烈發炎及炎症性疾病。
激烈發炎及炎症性疾病,令患者不僅痛苦,更可能留下不可恢復的傷害、甚至死亡。面對過度發炎引起的疾病,除了以疫苗預防,臨床上通常以藥物抑制發炎反應、並提供照護協助人體恢復。但藥物也可能干擾患者的免疫系統,甚至使病原產生抗藥性,因此患者與醫療人員經常陷於兩難。
謝世良團隊在患者「過度發炎」的難關中另闢蹊徑,找到了調控發炎反應的免疫細胞受器分子「CLEC5A (C-Lectin-5A,C 型凝集素 5A)」。團隊發現,剔除 CLEC5A 基因的小鼠,對病毒、細菌的過度發炎反應大幅減弱,未來可以針對此細胞受器發展療法,保護患者免於過度免疫反應。
自殺式攻擊「嗜中性球細胞外捕捉」

嗜中性白血球(Neutrophil),是免疫系統對抗細菌感染的第一道防線前鋒。
它們在感染情況嚴重,無法將細菌完全吞噬掉時,會膨脹自身染色體,從裂開的細胞膜將其釋出。嗜中性白血球自身會因此死亡。而被釋出的染色體,具有強大黏性並呈長條狀,猶如漁網將細菌捕獲,隨染色體釋出的免疫蛋白質也能直接殺死細菌、或抑制其生長。
上述機制稱為「嗜中性球細胞外捕捉(Neutrophil Extracellular Trap, NET)」,可透過下面三張圖分段來想像:
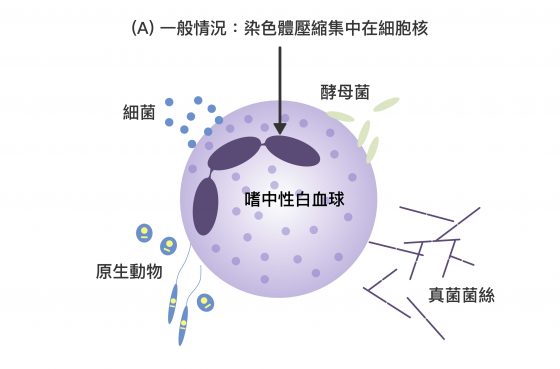
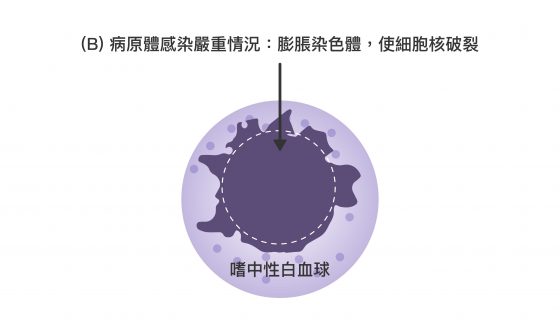
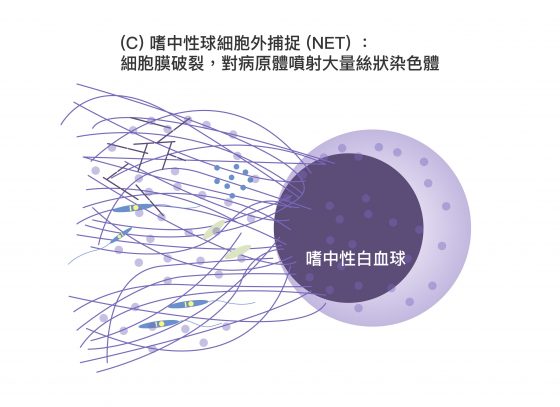
「嗜中性球細胞外捕捉(NET)」雖然可以清除病原,卻也產生大量干擾素,造成過度免疫反應。
例如紅斑性狼瘡(Systemic Lupus Erythematosus,SLE)因為免疫系統的失調,產生自體抗體,其中有些引起細胞損傷、有些形成免疫複合體,造成過度發炎反應。患者在發病前經常有發炎感染紀錄;而自體免疫症狀出現時,也可以檢測到患者體內的嗜中性白血球大量減少、干擾素濃度極高,表示此時有過量的「嗜中性球細胞外捕捉 」效果在影響人體。
嗜中性球細胞外捕捉機制,除了在紅斑性狼瘡患者體內會發生,當體內遇到格蘭氏陽性菌、登革病毒、禽流感病毒等病原入侵,也會啟動自體免疫反應。然而要避免過度免疫反應,謝世良團隊發現嗜中性白血球、巨噬細胞上的 CLEC5A 受器是重要的調控樞紐。
調控過度免疫反應的樞紐:CLEC5A 受器
謝世良團隊 2017 年的研究成果刊登在《Nature Communications》期刊,延續他多年來對「病毒引起發炎反應機制」的研究,證實 CLEC5A 不僅能結合登革熱、 H5N1 等病毒,在對格蘭氏陽性菌的免疫機制也佔據重要地位。
過往的免疫學理論普遍認為,格蘭氏陽性菌感染時,先天免疫細胞的 TLR-2(Toll-Like Receptor-2)是最關鍵的受器,但謝世良團隊根據臨床經驗與知識,做出不同於過往文獻的判斷,並針對 CLEC5A 進行實驗。
CLEC5A 受器,不僅會與過往最受重視 TLR-2 受器協同作用,而且是對抗病毒、細菌感染時更為重要的角色。
CLEC5A 和 TLR-2 的協同作用機制,可透過下面三張圖來想像:
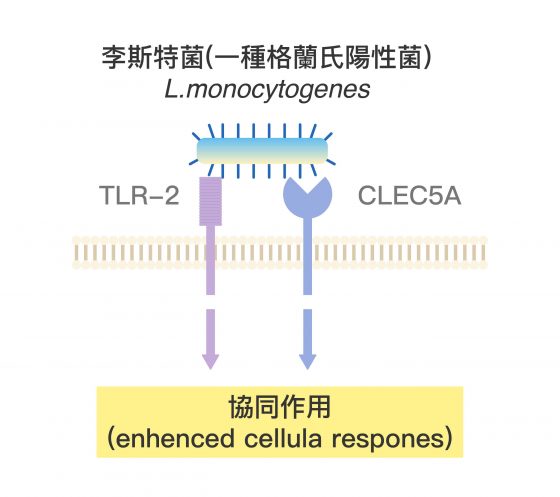
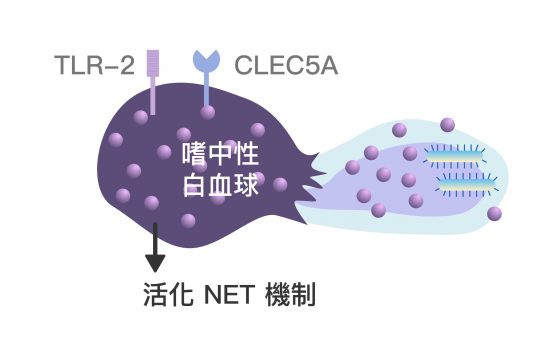
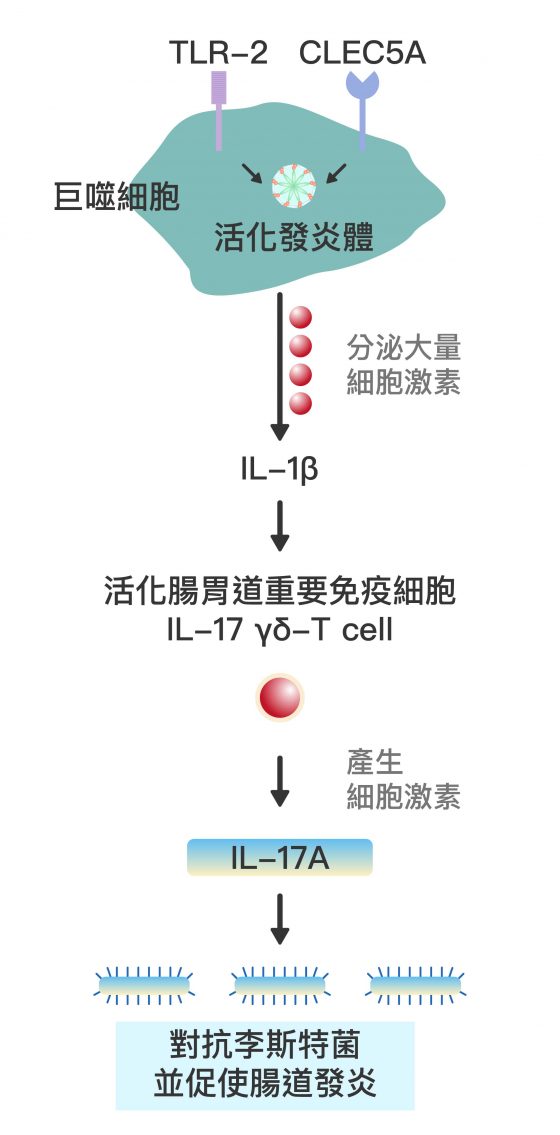
謝世良說明:「嗜中性球是對抗細菌入侵時最重要的第一防線,而我們發現 CLEC5A 在嗜中性球上的表現量甚至高於巨噬細胞,所以大膽假設── CLEC5A 與偵測格蘭氏陽性菌有關。」
於是謝世良團隊花費 1 年多進行實驗與培育,得到了剔除 CLEC5A 基因、剔除 TLR-2 基因、以及同時剔除兩者的珍貴實驗小鼠品系。
小鼠感染實驗的結果,不同於既有文獻理論,卻符合謝世良的預估:相較 TLR-2 基因剔除鼠,CLEC5A 基因剔除鼠對格蘭氏陽性菌感染更加敏感、致死率更高。而兩個基因皆剔除的小鼠,感染致死率又高於剔除單一基因的小鼠,顯示這兩個基因會協同進行免疫反應。
而被剔除 CLEC5A 的小鼠遭感染後,因為協同作用被阻斷,嗜中性白血球不會產生 NET 機制的各項指標,巨噬細胞也不會活化引起腸道發炎的免疫細胞「IL-17 γδ-T cell」。因此,謝世良認為:
CLEC5A 不僅能辨識病原體,若阻斷這個路徑,也能調控過度免疫反應,可望成為治療自體免疫疾病的新道路。
阻斷 CLEC5A 功能:SARS、登革熱、禽流感的可能新療法
除了格蘭氏陽性菌,謝世良對病毒引起發炎機制的好奇心,源於 2003 年 SARS 風暴,他說:「一個全新的病毒出現在世界上,居然可以被人體偵測、產生細胞素和強烈的發炎反應!這種現象非常奇特,我們實在忍不住要探究原因。」
當時的疾管局長蘇益仁詢問謝世良: SARS 病毒如何引起發炎反應?謝世良沒辦法馬上回答,同時也發現科學界對這個問題,其實沒有明確的答案與共識,因為對其病理機制了解有限。但是 SARS 風暴呼嘯而過,難以追蹤研究。於是謝世良在 2008 年著手研究登革病毒的發炎機制,逐漸揭露 CLEC5A 對免疫系統的重要性。
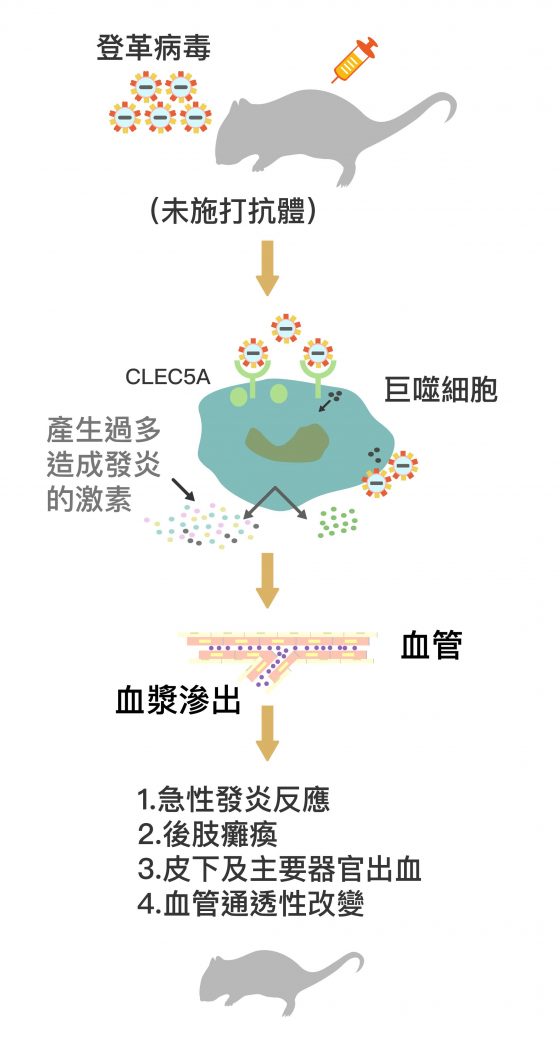
登革病毒每年造成全球兩萬人死亡,是因為患者重複感染不同型登革病毒,導致原先的抗體失去保護作用,反而結合病毒形成「病毒-抗體免疫複合體(Immune Complex)」,使病毒更容易以表面多醣分子(Glycans)結合巨噬細胞的 CLEC5A 受器,迅速進入巨噬細胞。當病毒感染量增加、巨噬細胞受到大量刺激,就產生更多細胞素促進發炎反應。
細胞素風暴(Cytokine Storm)就此展開:免疫系統連續受到錯亂的細胞素訊息刺激,促進發炎且召喚巨噬細胞聚集,讓巨噬細胞們更容易受到病毒感染、並加速分泌細胞素。
因此,免疫反應遭到細胞素過度刺激的循環,患者開始自發性出血、血壓下降、甚至休克,缺少良好醫療照護者可能致死。
謝世良團隊在 2008 年,嘗試用 CLEC5A 的拮抗性抗體(Antagonistic Antibody)及阻擾性 RNA(shRNA),阻斷小鼠的免疫細胞 CLEC5A 受器與登革病毒結合,預防發炎反應。發現此種抗體可以大幅減輕登革熱症狀,且能維持小鼠正常免疫功能,大多數小鼠在此種療法下皆有效清除病毒。
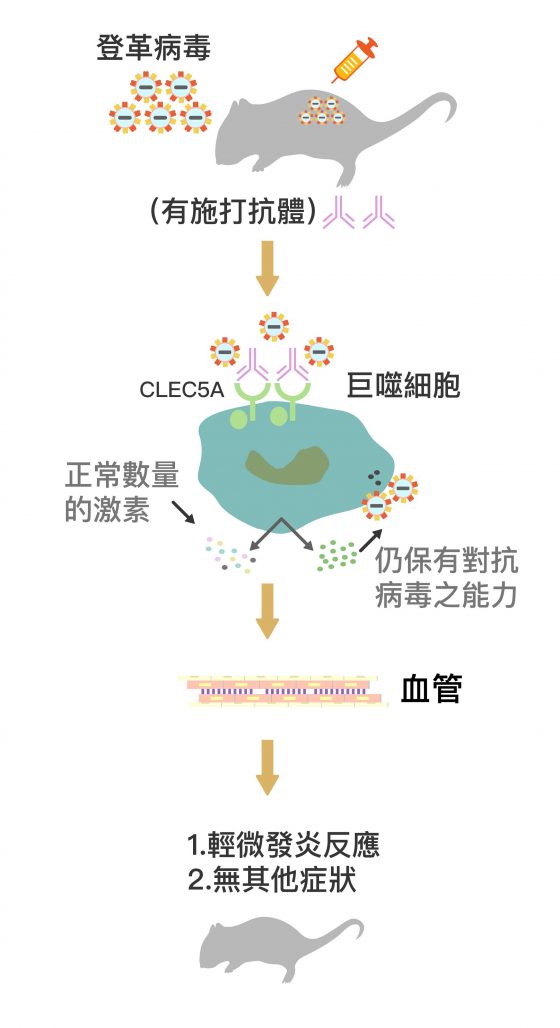
接續登革病毒的研究,謝世良團隊也發現免疫細胞的 CLEC5A 受器會和 H5N1 禽流感病毒結合,進而引發人體嚴重發炎。若阻斷這個路徑,將大幅減輕發炎症狀,讓免疫系統持續有效清除病毒。
在既有的研究基礎上,謝世良受巴斯德研究中心邀請合作,探究 CLEC5A 是否能與 H5N1 禽流感病毒結合。他將團隊精心培育的基因剔除鼠送到香港繁殖、進行實驗。結果發現,剔除 CLEC5A 基因的小鼠,因為阻斷了其與病毒結合的路徑,受 H5N1 病毒感染後的發炎症狀相對輕微許多。
抑制發炎相關的免疫因子,可以避免過度發炎反應,同時保持免疫系統正常運作以清除病毒,但不必擔心病毒產生抗藥性,也不會造成固醇類藥物的副作用。
謝世良說明,透過調控免疫細胞 CLEC5A 受器與病毒的結合,能發展以「抑制發炎」取代直接對抗病毒的療法,比傳統療法更順應自然、不易產生抗藥性。他說,此研究的主要收穫在於:「近期有 H4N1 患者對抗病毒藥物產生抗藥性,原來的藥物不再能抑制病毒,使得治療效果下降。但我們這個機制,不一定要靠藥物抑制病毒複製才能減輕症狀。」
病毒引起發炎反應的「雙重路徑」
謝世良認為, H5N1 研究的第二層重要意義,在於揭露病毒刺激人體發炎的「雙重路徑」之普遍性。
病毒可以透過核酸以外的構造引起人體發炎,這種「雙重路徑」是過去我們比較不重視,但與人體疾病關聯更緊密的部分。
他說,學界投注很多心力研究免疫系統如何對病毒的核酸產生反應。「但是,病毒能否透過其他機制,由核酸以外的構造刺激細胞上的其他受體、引起發炎?這方面的研究相對欠缺,但是與人類疾病的相關性卻更高。」
從登革熱、日本腦炎到禽流感,謝世良都觀察到病毒以核酸、多醣分子引起發炎的「雙重路徑」現象。他說「透過雙重路徑引起人體發炎的機制,並不止於引發日本腦炎、登革熱的黃病毒屬,可能是存在於多數病毒的普遍機制。基於這個觀念,我們將繼續尋找潛在的重要受器,若發現強力的病毒或細菌引起發炎的機制,就可以發展有效抑制發炎反應的療法。」
多數的研究起源,都來自觀察到有趣的現象,並保持強烈的好奇心。
「好的研究題材,可能來自對疾病的日常觀察、或尚未解答的基礎問題。更重要的,是如何透過既有的知識與設備,逐步接近問題的核心。」謝世良建議學生,實驗設計務必按部就班,任何假說都要以「控制組」進行嚴格比對驗證,絕對不能為了節省實驗時間而省略。

參考資料:
- 謝世良的個人網頁
- CLEC5A 是嗜中性白血球對抗細菌的關鍵
- Chen, S. T., Li, F. J., Hsu, T. Y., Liang, S. M., Yeh, Y. C., Liao, W. Y., … & Hsieh, S. L. (2017). CLEC5A is a critical receptor in innate immunity against Listeria infection. Nature communications, 8(1), 299.
- Chen, S. T., Liu, R. S., Wu, M. F., Lin, Y. L., Chen, S. Y., Tan, D. T. W., … & Hsieh, S. L. (2012). CLEC5A regulates Japanese encephalitis virus-induced neuroinflammation and lethality. PLoS pathogens, 8(4), e1002655.
- Chen, S. T., Lin, Y. L., Huang, M. T., Wu, M. F., Cheng, S. C., Lei, H. Y., … & Hsieh, S. L. (2008). CLEC5A is critical for dengue-virus-induced lethal disease. Nature, 453(7195), 672-676.
- Guimaraes-Costa, A. B., Nascimento, M. T., Wardini, A. B., Pinto-da-Silva, L. H., & Saraiva, E. M. (2012). ETosis: a microbicidal mechanism beyond cell death. Journal of parasitology research, 2012.
- Teng, O., Chen, S. T., Hsu, T. L., Sia, S. F., Cole, S., Valkenburg, S. A., … & Peiris, J. S. M. (2017). CLEC5A-mediated enhancement of the inflammatory response in myeloid cells contributes to influenza virus pathogenicity in vivo. Journal of virology, 91(1), e01813-16.
- Wu, M. F., Chen, S. T., Yang, A. H., Lin, W. W., Lin, Y. L., Chen, N. J., … & Hsieh, S. L. (2013). CLEC5A is critical for dengue virus–induced inflammasome activation in human macrophages. Blood, 121(1), 95-106.
本著作由研之有物製作,原文為《從登革熱到禽流感,調控「免疫反應」的樞紐:CLEC5A》以創用CC 姓名標示–非商業性–禁止改作 4.0 國際 授權條款釋出。
本文轉載自中央研究院研之有物,泛科學為宣傳推廣執行單位