- 文/ Wayne,FB粉絲頁-Medinno Catalyst 醫療器材催化器管理人,專注在醫材的尖端技術、市場動態與法規政策等資訊,
不定期發佈評析專題,為醫材業界人士提供最新最完整的產業情報。
遇到異常的醫療器材你會怎麼做?
試想一下,有天你在家使用體溫計時,發現無病無痛的自己,體溫計卻顯示 50oC,再重新測量一次,結果還是一樣,很顯然地,你手上這支體溫計壞掉囉~這時候的你會怎麼做呢?重買一個新的體溫計、打電話去客訴、假裝沒看到……之類的,有想過向政府投訴嗎?
噢,可能體溫計很便宜不值得花時間投訴。那假如是發現家裡的血糖機或是血壓計總是出現異常狀況,你上網搜尋一下評價,發現同樣買這個品牌的民眾遭遇跟你一樣的問題,你並不是單一個案。這時候的你,是可以考慮將儀器異常的狀況通報給政府單位知道。其實正確來說,當你用到有不良狀況的醫療器材,或是使用後發生不好的反應,都該告訴相關政府單位。因為我國政府有為醫療器材設計一套上市後監督系統,當民眾遇到不良醫材或是使用後有發生不良反應時,可以向相關衛生主管機關──食品藥物管理署(Taiwan Food and Drug Authority, TFDA)反應,達到監控醫療器材的目的。
圖 / Graco Children’s Products
從冠脂妥事件看上市後監督的重要性
不知道大家還記不記得三月份爆發的冠脂妥偽藥事件,地區藥局的藥師發現偽藥後,立即透過通報系統將消息傳給衛生福利部,使得衛福部能夠迅速作出反應,通知所有醫療機構回收偽藥並開放民眾更換藥品。試想,倘若沒有這樣的通報系統網,這個偽藥資訊需要多久才能傳達到衛福部呢?漫長傳達的過程中,是不是有更多民眾受害?這次冠脂妥風波沒有擴大災情,是有賴於我國衛福部持續在不良藥品與醫材的通報程序上做好管控,所以一發現問題,就可以迅速的將資訊上報給衛福部,下達給所有衛生機關。
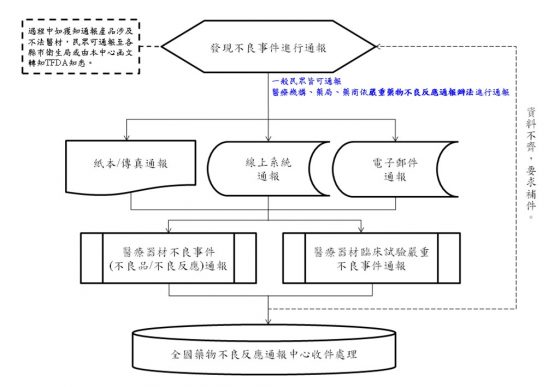
醫療器材上市後監督系統的理念
醫療器材若是要在市面上販售,需要先經過食藥署的審核,那麼審核通過的醫療器材仍會受到政府的管控,這就是「上市後監督」,在醫療器材優良安全監視規
上市後監督三階段--監控、評估、管理
監控階段
凡醫療器材經過核准上市後,就會進入監控的階段。那麼衛生主管機關是透過哪些方式進行上市後監督呢?一般來說管道有三種,除了之前提到的不良反應通報之外,還有安全監視與廠商稽核這兩種。
不良反應通報:適用於醫療機構、廠商與一般民眾,只要有發現不良品或是不良反應,可以透過傳真、電子郵件或是線上登記來通報,這些資料會統一送到專門單位-全國藥物不良反應通報中心來進行處理。那麼中央衛生主管機關會依據不良事件的嚴重性來決定是否發起產品召回。
安全監視:適用於高風險醫療器材和新創醫療器材,高風險醫材像是心臟瓣膜、心血管支架等屬於第三等級的醫療器材,新創醫療器材像是之前提過的膠囊胃氣球這類市面上獨一無二的醫材。這類型醫材經審核通過後,TFDA 會要求廠商進行為期三年的安全監視(時間依不同醫材而調整),安全監視的期間,廠商需要定期繳交報告給 TFDA,報告內容不外乎是產品基本資訊和有沒有出現不良反應,最後一期的總結報告時,會全部呈交給安全諮議委員會去評估該產品是否需要延長上市後監視的時間。

廠商稽核:TFDA 會委託第三方法人機構進行不定期的稽核,如果是國內醫材製造廠,會實際到現場進行審查,確保醫療器材是在符合規定的環境下生產。如果是國外的製造廠,則是需要請相關代理商提交完整的書面報告。
評估階段
政府在這一階段是針對醫療器材的風險進行分析,來評估醫材對人體造成的風險,及風險產生的傷害程度與頻率。像是前面提到的高風險性或是新醫材的廠商需要定期繳交安全性報告及總結報告,那麼政府會去評估說是否有需要延長監控的時間,還是說列入備查。那麼一般性的醫材並不需要繳交這些定期性報告,政府是透過民間機構的主動通報來了解一般性醫材的使用情形。倘若政府發現某個醫材主動通報的內容極嚴重或是數量比較高的時後,才會對這項醫材進行評估。
管理階段
這一階段主要是針對產品風險做出決策,常見的做法有跟廠商進行溝通與對醫材進行管制這兩種。跟廠商溝通是屬於較為寬鬆的管理,主要是希望透過溝通,讓廠商主動對產品進行改善或是為醫材相關使用者提供進一步的補救措施。然而,如果食藥署決定對醫材進行管制,那就是上一篇在《2016 年美國醫療器材五大召回事件》提到的<醫療器材回收通報>,將有風險的醫材在一定期限內回收,而且廠商需要在召回完成後,提交回收報告書到食藥署。
家裡有一台怪怪的醫材,我可以怎麼做?
這邊建議可以從兩方面進行,首先當然還是要向購買處或是廠商反應,他們屬於第一線人員,可以直接協助你處理異常的醫材。另一邊可以進行的是向政府線上平台進行通報,到衛生福利部的網站搜尋 ──「 醫療器材不良事件通報」,裡面有個「我要通報」,點進去就出現線上申報系統,申請帳號後就可以進行線上申報囉!
不過我國線上通報系統並不如美國設計的來的便利,像是我國民眾要線上通報前,還需要申請帳號,帳號獲得核准才能進行通報。反觀美國 FDA,他們非常重視醫療器材上市後監督這塊,他們為此還特地開發一套手機 APP,為了就是鼓勵民眾多多通報醫療器材的異常問題。美國推出線上通報 APP 後,接獲的通報數量明顯提高,很顯然的,線上通報 APP 是有助於推動民眾參與上市後監督,此一做法值得我國借鏡。
結論
醫療器材已經不只在醫療機構出現,隨著居家醫療、智慧醫療與行動醫療的發展,越來越多的醫材是會出現我們的生活周遭,所以我們更應該去了解當自己使用的醫材發生問題時,該如何保護自身的權益。
然而,從現實的數據顯示,我國民眾對於主動通報不良醫材的意識極微弱,舉例來說,我國在 102 年的自發性通報不良反應的案件數為 10,666 件。同年,美國 FDA 來自民眾與醫護人員的主動通報件數則為 1,380,173 件。美國人口數量約為台灣 12 倍,自發通報數量卻有 130 倍。美國通報來源有將近一半是來自民眾,而台灣民眾通報的比例可能不到一成。從這邊我們可以去思考為什麼國人不太會主動通報?
但我想更重要的是,國人對於自身權益的重視程度。希望透過這一系列的文章,能夠讓大家開始重視自己接觸到的醫療器材,以及了解在使用過程中發生狀況時,能有哪些管道可以為自己發聲。更進一步的希望大家能夠督促政府與廠商加強在醫療器材上的品質監督,才能保證我們能夠使用到品質越來越穩定的醫材。
看到這邊很認同,剛好家裡也有一個異常的醫材?快上這個網站登錄吧~
參考資料
- 衛福部食品藥物管理署網站
- 台美藥物不良反應通報流程比較及建議
- 美國 FDA 網站