雖然很甜蜜,卻讓你脹氣的乳糖
用「奶」(milk)隱喻善良與美德的說法很難被打破。馬克白夫人的丈夫有著太多「如奶般的惻隱之心」所以無法殺害君主,《出埃及記》(Exodus)第三章許諾希伯來人一個「流奶與蜜之地」,直到現在我們形容無害的東西「就像母親的乳汁」。
但對世界上超過一半的人來說,一杯健康的牛奶明顯沒有好處,它代表脹氣、打嗝和腹瀉──這是缺乏乳糖酶的結果,它可以為我們的身體預先咀嚼香甜奶中的乳糖。沒有它,身體將無法分解乳糖,只好留給腸道細菌處理。細菌快樂地清除這些未使用的燃料,留下廢物並伴隨討厭的副作用。
乳糖不耐的成人還是嬰兒時能消化母乳中的糖分,當時他們的乳糖酶基因是打開的,科學界稱之為「表現」(expressed),代表身體將乳糖酶的 DNA 指令轉錄成 RNA,再將此 RNA 轉譯成需要的蛋白質。乳糖不耐的成人則將乳糖酶基因永遠關掉並不再表現。能被我們身體打開或關掉、像乳糖酶基因這類的,就是所謂「受調控」的基因。

大部分人類歷史中,成人的乳糖酶常態處於「關閉」狀態。若你夠幸運能耐受乳糖,表示在你的乳糖酶控制區域(乳糖酶基因附近的 DNA 延伸)中有個突變,讓乳糖酶基因在成人時期能隨時打開。你的先祖有可能是喝牛奶的牧民,造成乳糖耐受的突變首先在東非和斯堪地那維亞的畜牧族群中傳開,而且速度極快。從人類首次發現畜牧生活型態開始,大約八千年,不過是曇花一現的時間,一些族群就從零突變躍升到九○%突變。這就是天擇在我們基因體留下最有力的近代特徵之一。
從消化到形態:「調控」的多樣功能
令人嘖嘖讚嘆的是,乳糖引起的消化不良和創新有密切的連結,串起它們的就是「調控」,也就是像乳糖酶基因這種分子活性轉變。調控所影響的遠比腸胃不適來得多,還牽扯到生物千變萬化的形狀:水母優雅的波浪傘狀結構、鯊魚宛如致命魚雷般的體形、玫瑰的細長莖、紅杉的巨大樹幹、蝮蛇的致命盤繞、兔子輕盈的腳,還有鳥類翱翔的翅膀。
從世上初有細胞的朦朧時刻就已經出現調控機制,為這個膜容器與 RNA 基因體的成長取得平衡。超過三十億年後,調控為地球上所有生物的身體塑形。不了解新的調控如何出現,就無法理解任何創新。
即使調控控制了最複雜生物的形狀和功能,但就像其他實驗一樣,在最簡單的細胞中最容易研究──受試的對象就是細菌。這是方斯華.賈科布(François Jacob)和賈克.莫諾(Jacques Monod)兩位法國遺傳學家贏得諾貝爾獎的原因。一九五○年代初期,當時雙股螺旋結構才剛被發現,他們便證明了像大腸桿菌這種原始細菌如何調控基因表現而能夠消化乳糖。

轉錄調控蛋白如何調控乳糖酶的表現?
基因表現起始於一種分子複製機器,它是個製造聚合物(polymer)的聚合酶(polymerase)酵素,此聚合物是許多較小建構組成的鏈狀分子,也就是我們在一個基因忠實的 RNA 產物裡找到的四種核苷酸。
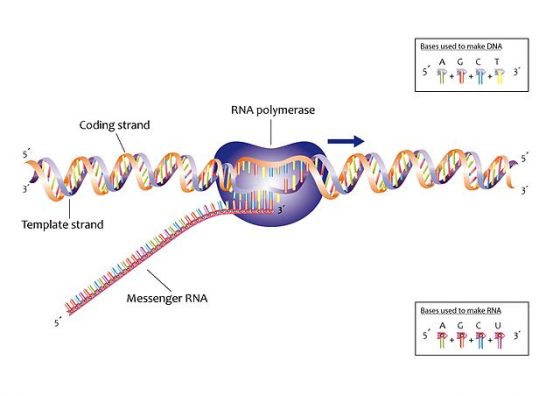
當此聚合酶要轉錄一個基因,它首先會接上基因的 DNA,沿著一個個 DNA 字母滑動,並將 RNA 分子串在一起,而 RNA 字母序列會與基因的相同。細菌也是如此表現它們使用的乳糖酶:β-半乳糖苷酶(beta-galactosidase,這個字很累贅,通常簡寫成 beta-gal)。這個酵素會將乳糖切成兩個較簡單的醣類─—葡萄糖及半乳糖,其他代謝酵素可以從它們取得能量和碳。
為了調控 β-半乳糖苷酶基因,細胞用轉錄調控蛋白(transcriptional regulator)來操控轉錄。此蛋白質基本上只做一件事:占據基因附近的一小段 DNA 延伸。
在細胞的液體環境中,多種調控蛋白在其中漂來漂去,當任何一個蛋白遇到特定 DNA 序列(DNA「字碼」)時就會結合並黏住。不同調控的蛋白有相異的關鍵字,β-半乳糖苷酶調控蛋白辨認的關鍵字是「GAATTGTGAGC」。
讓辨認工作可行的,就是像讓酵素能夠工作的摺疊蛋白質的形狀。調控蛋白和 DNA 必須有互補的形狀,類似樂高積木,一塊積木上的幾個小突起與另一塊上面的凹陷緊密貼合。這個比喻十分恰當,但仍有限制,因為形狀不是一切,例如兩個分子還需要帶有互補電性,否則會相互排斥。而且一套標準樂高積木只有幾十種形狀,但分子卻不同,蛋白質有數萬種形狀,DNA甚至還更多—就跟可能的DNA序列一樣多

更重要的是,與樂高積木不同,許多分子會自發地改變形狀,這不只發生在它們像酵素一樣震動的時候,也出現在它們彼此結合時。這種形狀的改變就像你把正確的鑰匙插入鎖中一樣,只有在當下轉動鎖芯才可以開門,而分子中除了熱以外,沒有別的方法可以讓它轉動。
調控蛋白類似於樂高積木的結合,用最簡單的可能方法調節 β-半乳糖苷酶的製造:為聚合酶創造路障。因為調控蛋白的關鍵字就被放在聚合酶開始轉錄之處,當周遭沒有乳糖時,調控蛋白(R)會結合此關鍵字並阻止聚合酶(P)讀取基因,基因便保持關閉。
為了使用富含能量的乳糖,細胞需要排除這個路障。要了解它們是怎麼辦到的之前,得先知道調控蛋白不只能跟 DNA 結合,還能結合另外的分子,就像樂高積木可以和許多其他積木連接一樣。所謂另外的分子,就是乳糖。
當乳糖這把鑰匙與調控蛋白這個鎖結合時,調控蛋白便會改變形狀,不再與 DNA 互補而分開。聚合酶現在可以自由地一字一字轉錄 DNA,細胞再從 RNA 製造 β-半乳糖苷酶。總之,當有乳糖可用時,β-半乳糖苷酶的基因打開,製造出β-半乳糖苷酶,否則轉錄會受阻而造成基因關閉。
β-半乳糖苷酶是絕佳的好東西,只不過用起來所費不貲。一個細胞開啟β-半乳糖苷酶的表現後,產生的不是幾十個蛋白質而已,而是大約三千個相同的分子,每個分子都需要供給超過一千個胺基酸並綑綁在一起,代價就是要付出分子原料和能量。
製造 β-半乳糖苷酶的成本有多高?
常識告訴我們,細胞應該要調控β-半乳糖苷酶,以避免浪費這些原料,但如果常識總是引導自然之道,那麼生物學家就要失業沒什麼事可做了。倘若細胞可以製造數以百萬計的其他分子,那麼不斷製造 β-半乳糖苷酶的成本可能就微不足道,讓基因一直開著也有實質上的優勢,當乳糖可利用時就能搶先一步。
二○○五年,以色列魏茨曼科學研究院(Weizmann Institute)的埃雷茲.德克爾(Erez Dekel)和烏里.艾隆(Uri Alon)想要算出表現 β-半乳糖苷酶真正的成本。他們耍了點花招,讓細胞相信乳糖就在周圍,但事實上並沒有。細胞不合理地打開 β-半乳糖苷酶基因,假如浪費真會造成差異,應該會拖長增殖分裂的時間。
確實如此,慢了幾個百分點。這有點像身無分文的開發商蓋房子,有座不需要的游泳池不但花掉錢和原料,還漏掉建造其他必要的房間等等。優良的建商能更快完工,賣出房子並繼續建造新房舍,有人卻還在為挑選泳池瓷磚絞盡腦汁。
建造延遲總計不過幾個百分點,看起來不多,對大腸桿菌而言,只比平常分裂所需的二十分鐘約莫多了一分鐘,但那一分鐘最後會變得很致命。一個族群剛開始時有五○%的細胞浪費了資源,八十天後比率不到一%,僅僅三百天後少於百萬分之一。快速、必然且不幸地,它們會被繁殖較快的細胞淘汰,這就是天擇迅速而殘忍的行動。

基因調控:避免資源浪費
若調控因為能避免浪費而事關緊要,那麼它應該無所不在,而事實也是如此。試想一包含數百個反應(乳糖酶只催化其中之一)的代謝作用,就像複雜且相互連接的管線網路,網路裡流動著營養,網路外流動著生物質分子。每條管子有專用泵浦,也就是能在管中推進原料的酵素,一個細胞可以根據所需來調控每個泵浦。
若有新的營養物質出現在土壤的一角,例如一顆掉落的蘋果或一具腐敗的屍體,土壤的細菌就會把能讓這些物質分子流過的泵浦打開;一旦吃乾抹淨,它們就會關閉泵浦。假若營養物質的量出現增加或減少的變化,細胞可以微調泵浦到正確的速度。
β-半乳糖苷酶基因被調控蛋白「抑制」,不過其他基因的調控方式正好相反:
細胞平時將基因關閉,只在需要時「活化」它們。轉錄調控蛋白這次不是要阻止,而是幫助 DNA聚合酶轉錄一個基因。
儘管轉錄調控是最重要的一種調控形式,但仍有許多其他類型,例如調控從轉錄的RNA製造蛋白質的速度、蛋白質活性和壽命等。也許最具說服力來說明調控重要性的證據是:生命已經發明數十種不同方法來完成這件事。
本文摘自《生命如何創新:大自然的演化創新力從何而來?》,由馬可孛羅文化出版。