-隨著巴金森病病情發展至中後期,藥物治療的效果就不如初期那麼顯著,因此低風險、微侵犯之深部腦電刺激術為目前最好的選擇。
巴金森症是僅次於失智症第二個常見的腦部運動神經退化性疾病(巴金森病發現人為詹姆士.巴金森(James Parkinson)故以此命名) 。其成因為中腦黑質區(Substantia nigra pars compacta)分泌神經傳導物質多巴胺的神經細胞(Dopaminenerve)不明原因退化,造成多巴胺量減少,而上游的原料減少就會干擾中游與下游的供應,進而影響另一個神經核區——基底核(中游)與大腦皮質(下游)的神經傳導,使得神經平衡失調,不是異常興奮放電就是過度疲勞。多巴胺這個化學傳導物質主要與我們肌肉的協調有關,所以當病患腦中缺乏多巴胺而罹患巴金森病時,其三大臨床表現包括顫抖(Tremor):尤其休息或是情緒緊張時更為明顯,手腳都會受到影響;僵硬(Rigidity):也是同時影響手腳,關節的地方會像輪軸一樣,活動時會很緊,且像齒輪一小段一小段的活動;動作遲緩(Bradykinesia):整體的行動步伐很小且緩慢,病患從外觀來看會有駝背(Stoop posture)現象。
早期治療方法
自1 9 6 0 年代, 左旋多巴胺(Levodopa)、多巴胺促動劑(Dopamineagonist)及酵素抑制劑(COMT inhibitor)等補充大腦中多巴胺藥物的問世,對於動作障礙有顯著的改善。然而伴隨著疾病的發展,仍會有藥效時間縮短,病患會有無法控制的異動症(Dyskinesia)情形發生,並產生開關現象(On-off phenomenon)。當藥物引起「開」反應時,患者可得到良好的症狀控制,但是若為「關」反應時,患者的症狀除了無法獲得控制,並喪失原有正常活動的能力。因此若巴金森病患者在平均發病十年左右後,藥物治療對於生活品質的改善就不像初期效果那麼的顯著,此時部份較嚴重的病患就會轉而尋求較具侵入性的手術。
在1980 至1990 年代,對於因藥物產生副作用而須手術治療的病患,只能選擇視丘下核(Subthalamic nucleus)或蒼白球燒灼術(Pallidotomy)。手術的原理是導自於上游的多巴胺神經細胞退化後,會投射至中游的視丘下核或蒼白球神經核區,由於多巴胺有抑制神經的作用,缺少多巴胺會造成中游兩處的神經核區異常活躍,因此燒灼破壞手術就是希望直接將異常活躍的神經破壞,來阻斷異常的神經傳導達成治療。
實際上燒灼手術並非如聽起來這樣的恐怖,只要先設定一定的溫度與雷射頻率,就可以將燒灼手術的範圍控制在半徑大約1~3公釐左右。由於過度興奮的神經被破壞,神經的放電會回到接近正常的狀態,因此不舒服的肢體動作就能夠得到緩解,此外也可以減少左多巴胺服用後造成的異動症,並增加藥物的作用時間,減緩藥物所造成的波動起伏狀態。但仍有約10~20%的病患在術後產生認知功能異常(如記憶力減退)或是更嚴重的異動症等副作用。

深部腦電刺激術
1990 年代後,法國的神經外科醫師班納比德(Dr. Alim-Louis Benabid,圖一)將脈衝電極植入靈長類腦中,以高頻電流(約130 赫茲)刺激,發現能抑制視丘下核或蒼白球異常的神經活躍,實驗結果與燒灼手術相當,而後續的實驗亦證實此手術的一致性與安全性,並在人體實驗上得到證實。
當巴金森病患者腦部植入脈衝電極,在未服用藥物的情況下,將電極刺激打開並設定在高頻,顫抖與動作緩慢的症狀會減緩,就像電燈的開關一樣,打開電源的幾秒鐘後病患動作異常的症狀會立即得到改善,而在關機後不舒服的症狀也會立刻重新出現。
此手術的問世明顯改善大部份巴金森病患者的生活,也可以避免燒灼手術的副作用,因此之後深部腦電刺激術(Deep brain stimulation, DBS)即利用此原理逐漸取代了燒灼術,並在2000 年開始成為手術治療之主流。
深部腦電刺激之脈衝電極結構
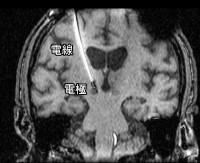
DBS 最常使用的刺激器及導線是一種四電極導線(圖二),導線的顱內端(也稱為遠端, Distal)是含有白金–銥的四個接觸頭,每個接觸點長1.5公釐,而彼此間隔為0 . 5 公釐; 導線的另一端( 近端,Proximal)則是連接到一個由電池運作的可植入式脈衝產生器(Implantable pulse generator),此類似於心律調節器的裝置將被植入病人的鎖骨皮下。

電刺激的參數包括電刺激的強度——伏特(Voltage),電刺激的長度——脈寬(Pulse width)與電刺激每分鐘的次數——頻率(Frequency)等三個參數。如果把電刺激的參數用拳擊來舉例的話,電刺激的強度就好像是每揮一拳的強度,電量越大則每拳所造成的破壞與影響越大;電刺激的長度就好像每一拳在目標上停留的時間,停留越長,影響範圍也越大;電刺激的頻率就像每分鐘所揮出的拳擊次數。因此不難想像,這三個參數的設定都會對脈衝電極置放的神經核區造成影響,而對醫生與手術的病患來說,最主要的目標就是在最低的電源消耗設定下,達到動作障礙等症狀的改善,因此手術中脈衝電極與電池的置放只完成其中一項重要的步驟,手術後參數調整的學問也是很重要的。
由於DBS 所能夠調整的三個參數對於病患原先行動不便的症狀有明顯改善,近年來也發現這3個電刺激參數若是過強,或是電極沒有放置在理想的位置,則會對病患產生副作用。目前隨著醫療工程的進步,有越來越多的研究利用數學與物理演算方法,希望能夠預測出脈衝電極在手術植入腦神經後,每位病患特殊的參數數值,以期能夠達到在最省電的情況下(電池使用年限加長),避免不需要的副作用。
醫學腦部影像的輔助
DBS 的成功除了脈衝電極本身的作用之外,能夠正確的將電極放置於特殊的腦神經區域(如視丘下核或蒼白球,圖三),以阻斷異常的神經放電也是手術步驟中非常重要的一環。自1977 年核磁共振首度於人體上進行影像的掃描開始,大部分的DBS 必須仰賴核磁共振提供腦部神經精確的影像,讓執行手術的神經外科醫師能夠利用醫學軟體的計算,定位出準確的座標,其誤差一般只有在1~2公釐之間。就像打靶一樣,必須非常精確的將脈衝電極放置於靶心,才有治療效果。

腦神經立體定位手術
DBS 估計有兩百多個手術步驟,因此手術的成功在於每個環節都必須非常謹慎,不能夠有誤差。對於巴金森病患者而言,精確的將脈衝電極放置於視丘下核這個神經核區,除了仰賴電腦影像的進步(就像提供了一張大腦的地圖,讓我們在一片森林中能夠找到目標),腦神經立體定位手術的發明也是促成手術成功不可或缺的技術。
1949年,瑞典的神經外科醫師拉爾斯(Leksell)教授(圖四)發明了立體定位弧(圖五),並提出大腦立體定位手術的概念:藉由數學計算出目標靶心(視丘下核神經區)的座標後,在立體定位弧的X,Y,Z座標軸上選定座標,然後固定於病人的頭上,此時病人處於麻醉睡著的情況,再將脈衝電極放置在立體定位弧上的靶架,緩慢地送入病人大腦內神經後固定;而遠端的電線則放置於頭皮下,等到第二次手術時連接到病人胸前放置的電池(可植入式脈衝產生器)。拉爾斯醫師立體定位弧的發明,成功將定位系統的觀念建立在穩固的外科手術儀器上,此後,立體定位手術就成為神經外科醫師例行的手術之一,除了應用在深部的腦中風出血的吸除或腦腫瘤的切片檢查外,也應用在巴金森病患者DBS 手術中。

幹細胞與基因療法
目前對於巴金森病的患者來說,手術治療的選擇仍是以DBS 為首選,因為從開始在人體使用,到現在已經有超過10 年的長期追蹤資料,不管在安全性或是手術風險上都已經證實對患者有幫助。但是近幾年在手術治療的選擇上,基因治療與幹細胞療法也因為立體定位手術的進步,與對神經之間聯繫作用的了解,全世界的科學家也紛紛針對這2 個治療方式進行人體試驗。
基因治療的基本原理其實與DBS 手術相似,許多研究發現在巴金森病患者的腦部,視丘下核神經核區的神經會異常放電,所以用電刺激把它轉為正常,而基因治療就是利用植入無致病性的病毒,讓視丘下核的神經能夠增加抑制神經傳遞訊息的傳導物質——伽傌丁胺酪酸(γ -AminoButyricAcid,GABA),讓異常神經放電的情況得到有效的改善。

結 語
自從1990 年代DBS開始治療巴金森病患者,無論是早期手術後的病人追蹤報告,或是如今發表在醫學頂尖期刊的研究報告,皆證實DBS 對病患生活品質的幫助與好處。DBS 在近幾年也延伸至精神疾病的治療應用,如強迫症或是重度憂鬱症,此外也促使了許多科學家投入DBS 作用機轉的基礎研究上。藉由在巴金森病治療上的豐富經驗,醫學界可以展望未來,相信DBS 將可用來治療更多樣性的神經退化性疾病。
蔡昇宗:花蓮慈濟醫院神經外科專科醫師







































