本文轉載自諾貝爾化學獎專題系列,原文為《【2003 諾貝爾化學獎】細胞膜的分子通道》
- 譯者/蔡蘊明|台大化學系名譽教授
譯者前言:今年的諾貝爾化學獎頒給了兩位醫生,或許有些奇怪,然而仔細的去瞭解他們所做的工作就會發現,其實他們的研究已經深入到了原子的層次,那不是化學又會是什麼呢!這其實也告訴了眾多對生命科學有興趣的年輕人,其實真正精采的還是在這個化學的層次。考慮加入我們吧。
所有的生命體都是由細胞所構成,一個人身上所擁有的細胞數目就好像銀河中的星星一般,約有上千億個,在每一個人身上,例如肌肉,腎臟與神經等不同的細胞,聯合的運作而形成一個精密的系統。透過他們有關細胞中水與離子通道的開創性發現,今年的化學諾貝爾獎得主, Peter Agre 與 Roderick MacKinnon,在增進瞭解細胞如何運作的基礎化學知識方面,有重要的貢獻。他們讓大家看到一個精采的分子機器家族:通道、閘門與活栓,這些元件是細胞功能所必須的。
通過細胞膜的分子通道
為了維持細胞內外壓力的平衡,讓水能通過細胞膜是非常重要的,這是早為大家所熟知的。然而這種通道的形狀與功能,卻成為生物化學中一個典型的久未解開的問題,一直等到約 1990 年 Peter Agre 發現了第一個水的通道,就如同細胞中許多其它功能所需一般,都是由於一個蛋白質。
水分子並非唯一能進出細胞的分子,為了讓成千上萬的細胞成功的運作而非聚集在一起的肉塊而已,協調是很重要的,因此細胞之間必須溝通,而細胞之間的訊號傳遞則是靠著離子或是一些小分子,由此導致一系列的化學反應,造成我們的肌肉緊繃,眼睛濕潤 ─ 實際上包括了整個身體的運作。在我們腦部的訊號亦與這些化學反應有關。當我們弄斷了一個腳趾時,一個訊號就會上傳至腦部,透過一連串的神經細胞以及化學訊號及離子的流動,訊息就好像接力賽的棒子般在細胞間傳遞。
在 1998 年 Roderick MacKinnon 第一次成功的展示了離子通道在原子的層次到底長的是什麼樣子 ─ 這個成就加上 Agre 的水通道之發現,打開了生化與生物學中一個嶄新的研究領域。
Agre 與 MacKinnon 的發現在醫學上的貢獻也是很重要的,有一些疾病的成因就是因為水與離子的通道不能流暢的運作有關。隨著逐漸的瞭解這些通道的長相以及它們如何運作,我們就有機會發展更新更有效率的藥物。
水通道
搜尋水通道
早在 19 世紀中葉,人們就知道細胞一定有一個管道讓水與鹽類流通。在 1950 年代中期,發現有一個只能讓水分子迅速進出細胞的通道存在,在這之後的三十年間,透過詳細的研究,結論是一定有某種選擇性的過濾裝置能阻斷離子通過細胞膜,但卻能讓中性的水分子自由通過,而且每秒鐘有成千上萬的水分子通過一個單一的通道!
雖然知道這些,但一直等到 1992 年都尚無人能指出這個分子機器到底長相如何;換言之,就是能找到一個或多個蛋白質所構成的真正通道。在 1980 年代中期,Peter Agre 研究紅血球細胞上的各種細胞膜蛋白質(插在細胞膜上),他也在腎臟中發現一個同類型的蛋白質,在解開了這個蛋白質的序列以及相對應的 DNA 序列之後,他體認到這一定就是在他之前的眾多學者所搜尋的那個蛋白質:細胞的水通道。
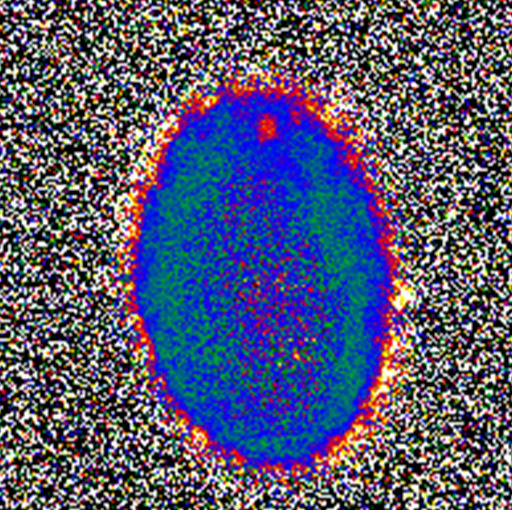
Agre 利用一個簡單的實驗(圖 1)來測試他的假設,在此實驗中,他比較含有此膜蛋白與不含此膜蛋白的細胞,當這些細胞放入水中時,那些含有此膜蛋白的細胞因為滲透壓之故會吸收水分而漲大,而那些沒有此膜蛋白者則聞風不動。Agre 又利用一種稱為 liposome 的人造細胞來測試,那是一種內外都是水的一種肥皂泡泡,他發現當此肥皂泡的膜上植有此膜蛋白時,水就可以自由進出。

由於 Agre 知道汞離子會阻礙細胞吸收及釋放水,因此他也證明了這個他所發現能控制水進出細胞的蛋白質,也會因為汞離子的存在而無法讓水通過。這使得他更確定這個蛋白質就是真正的水通道,他命其名為 aquaporin,即"水洞"之意。
一個結構與功能的問題:水通道如何運作?
在 2000 年,透過與其他研究團隊的合作,Agre 發表了一個 aquaporin 的高解析度 3D 圖像,藉這這些數據,就能按圖索驥,仔細的描繪出一個水通道是如何運作的(圖 2)。為何它只讓水通過而不讓其它的分子或離子放行?例如細胞膜是不允許質子(H+)滲漏的,這點非常重要,因為細胞就是靠著內外質子濃度的差異來維持細胞能量儲存的系統。
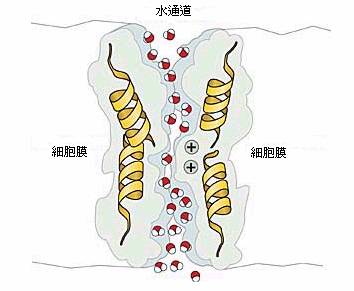
選擇性是這個通道的主要性質,水分子必須順著由構成通道壁的原子所形成的電場方向,鑽過一個狹窄的通道,質子(或應稱之為 oxonium 離子,H3O+)將會在中途因為其所帶的正電荷而被驅逐。
水通道在醫學上的重要性
在過去十年裡,水通道已發展成為一個不斷被討論的研究領域。大家發現 aquaporin 是屬於一個蛋白質大家族的成員,它們存在於細菌與動植物中;僅在人體就發現至少有七種不同的變體。
這些蛋白質在細菌與動植物中的功能正被勘測中,特別集中在企圖瞭解它們在生理上扮演的角色。在人體的各組織中,水通道在腎臟扮演了重要的角色。
腎臟是一個人體用來排除廢棄物的精巧裝置,在它做為篩子用的線圈中(稱為絲球體),水、離子與其它的小分子與血液分離成為所謂的初尿,在 24 小時中,約生成 170公升的初尿,其中大部分透過一系列靈巧的機制被重新吸收,最終每日產生約 1 公升的尿排出體外。
初尿通過絲球體後繼續通過一個彎管,在其中約 70% 的水通過 aquaporin AQP1 而被重新吸收回血液中,在此管的末端,另外 10% 的水通過另一個類似的 aquaporin AQP2 而被吸收。除此之外,鈉、鉀與氯離子亦被吸收回血液中。抑制尿分泌荷爾蒙(vasopressin)的功能,是促進 AQP2 傳送到腎管壁的細胞膜,因此增加了初尿中水的回收,如果一個人缺乏這種荷爾蒙,將會得到一種稱為 diabetes insipidus 的疾病,每天產生10-15 公升的尿。
離子通道
鹽類產生的細胞訊號
第一個物理化學家奧斯華(Wilhelm Ostwald , 1909 年諾貝爾化學獎)在 1890 年就認為在活體組織中所量到的電流訊號,應該是來自於離子透過細胞的進出,這個電化學的想法很快的廣為接受。到了 1920 年代,又興起了一種看法,認為有某種狹窄的離子通道存在,有兩位英國的學者 Alan Hodgkin 與 Andrew Huxley 在 1950 年代初期得到了一項重大的突破,因此得到了 1963 年的諾貝爾醫學獎,他們的研究顯示,透過神經細胞膜的離子傳輸,所產生的訊號可透過一個個神經細胞,以接力賽的方式傳遞,這些反應裡面最主要的角色就是鈉離子(Na+)與鉀離子(K+)。
這也就是說,早在 50 年前就已經充分瞭解了離子通道的主要功能,這些通道必須選擇性的只讓一種離子通過,同樣的這些通道也必須有能力打開、關閉或只讓離子往一個方向流動。然而這個分子機器到底真正是如何運作的,卻長久以來一直是個謎團。
選擇性的離子通道
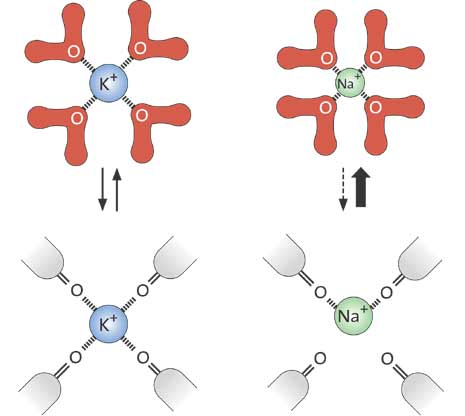
在 1970 年代的研究就已顯示,離子通道只能讓某些離子通過,是因為它裝有某種"離子過濾器"。特別有趣的是,雖然鈉離子比鉀離子要小,卻發現有一種通道只能讓鉀離子通過,卻不會讓鈉離子通過。猜測這可能是由於蛋白質中的氧原子們扮演了一個重要的"取代角色",取代了原先溶於水中的鉀離子周圍所包的水分子層,當鉀離子要進入通道中,必須先脫離這個水層的包圍。
但是進一部要證實這個猜測卻很困難,因為真正需要做的是需取得只有 X-射線晶體繞射才能得到的清楚圖像,問題是運用這種方式去解膜蛋白的結構是非常困難的,當然要去解鉀離子通道的結構也不會例外。動植物的膜蛋白比細菌中者要更複雜而更難研究,但是藉著與人類離子通道非常類似的細菌通道蛋白質之研究,或許能提供進一步的瞭解。
許多研究人員在這個方面的努力均無功而返,可是卻在另一個方向的研究中意外的得到了突破。 Roderick MacKinnon 在修完生化的學位後,轉入了醫學的領域,成為一個合格的醫師。在成為醫師之後若干年,他開始對離子通道產生極高的興趣,並開始了這方面的研究。他自承"我的研究生涯從 30 歲才開始",不過他的研究卻快速的起飛。由於體認到要瞭解離子通道如何運作,必須要有更好而且更高解析度的結構圖像,他決定從最基本的 X-射線結晶學開始學起,在短短的數年之後,他提出了一個清楚的離子通道圖像而震撼了整個學界,這個重要的事件正是發生在 1998 年的一個四月天。
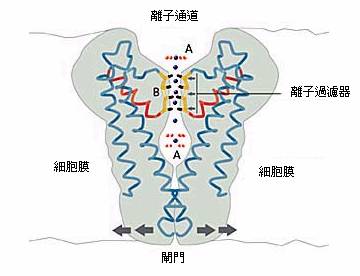
第一個被圖解的離子通道
在 1998 年 MacKinnon 所決定的第一個高解析度的離子通道結構稱為 KcsA,乃是由一個稱為 Streptomyces liridans 的菌株得到的。 MacKinnon 第一次展示了在原子的層次,一個離子通道是如何運作的,那個只允許鉀離子通過而拒絕鈉離子的離子過濾器,現在可以仔細的去研究,他不僅能弄清楚離子如何通過這個通道,其實在其晶體結構中甚至於可看到正在通道前被水包圍著的離子,在過濾器之中的離子,以及離開過濾器的離子,水是如何的來迎接它們(圖 3)。 MacKinnon 也能解釋為何是鉀離子而非鈉離子被允許通過此過濾器,說穿了,這主要是由於鉀離子在過濾器中,周圍所圍繞的氧原子之位置,與在外面被水分子包圍著時,水分子的氧原子之位置是相同的,但是對較小的鈉離子而言,它在過濾器中與氧原子的相對位置,就無法與在水中時一樣(圖 4),因此就較喜歡留在水中(因為有較佳的水合能)。這種能讓鉀離子脫離水層,通過通道而且不損失能量的做法,屬於一種所謂選擇性催化的離子傳輸。
細胞也需要能控制通道的開啟與關閉, MacKinnon 也說明了這是藉著一個通道下方的閘門,這個閘門可開啟或關閉一個分子"感知器",這個感知器就在門的附近。不同的感知器會回應於不同的訊號,例如,鈣離子濃度的增加,或一個細胞膜兩邊的電壓差異,或與某種訊息分子的螫合,藉著不同的感知器與離子通道的連接,大自然創造了能回應於眾多不同訊號的各種通道。
瞭解疾病
膜上的通道是所有生命體的基本要件,由於此,增加對它們的認識就成為瞭解許多疾病狀態的重要基礎。各種不同的脫水現象,以及對熱的敏感度,就與 aquaporin 的效率有關;例如最近幾年歐洲的熱浪,導致了許多的死亡,這些死亡,有部分是歸諸於無法保持體液的平衡,在這些過程中 aquaporin 是非常重要的。
離子通道的功能一但受到干擾,就會導致神經系統方面的疾病,以及肌肉,例如心肌,方面的問題,這使得離子通道成為一個製藥界開發新藥的重要目標。
參考資料
這份文章是譯自諾貝爾獎委員會公佈給大眾的閱讀資料:
http://www.nobel.se/chemistry/laureates/2003/public.html
有意進一步的瞭解就得詳讀以下資訊:
http://www.nobel.se/chemistry/laureates/2003/public.html