本文轉載自諾貝爾化學獎專題系列,原文為《【2012諾貝爾化學獎】細胞與感知》
- 譯者/蔡蘊明|台大化學系名譽教授
- 譯者/曹一允|美國德州農工大學 Karen Wooley 教授指導下取得博士,現於日本萊雅公司進行研究。
- 譯者/陳竹亭|台大化學系教授
細胞與感知(Cell and Senses)
我們眼、鼻及口中的感官擁有對光、嗅或味的感測器。在人體內,細胞具有類似的感測器來探知荷爾蒙以及各種訊號物質,常知的有腎上腺素(adrenalin)、血清素(serotonin)、組織胺(histamine)與多巴胺(dopamine)。當生命在演化時,細胞不斷的利用同樣的基本機制來讀取它們的環境:但是負責感測的主角——G-蛋白偶聯受體(G-protein coupled receptors)多年來卻隱藏在研究者未知之處。

如果你工作到很晚,月亮已高懸夜空,你正從偏僻的公車站走回家。你突然聽見後方傳來的腳步聲,聲音快速的迫近。「沒什麼好擔心的。」你告訴自己:「不過是另一個被操到太晚的員工罷了。」但是,一種毛骨悚然的感覺油然而升,有人似乎迫近到了你身後…
你立刻拔腿向家門狂奔,打開前門的鎖時,你整個身體都在顫抖,心在狂跳,而且不斷大力的喘息。
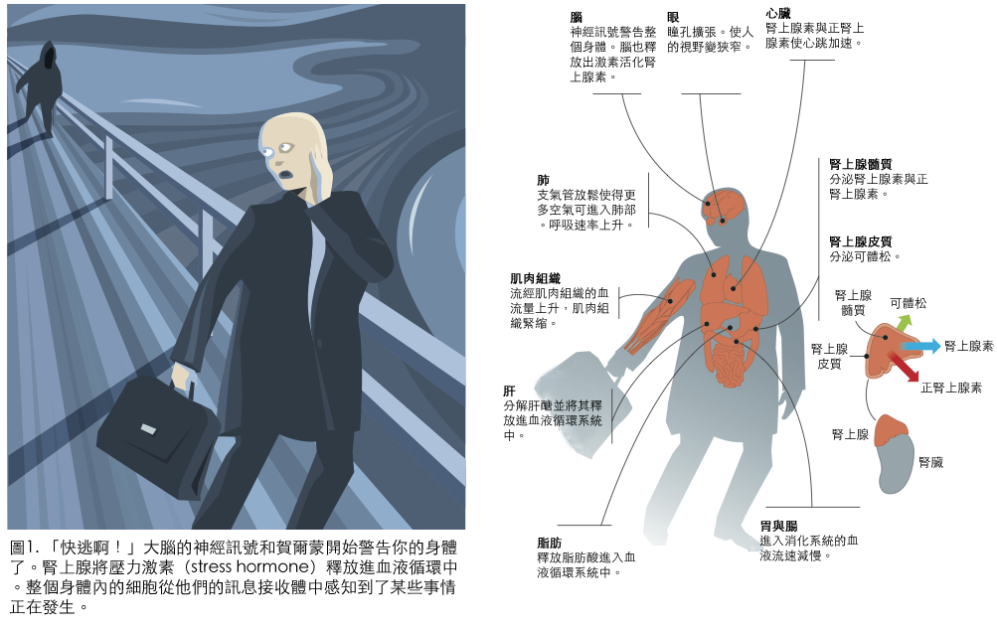
當你的眼睛瞥到迫近的黑影時,整個身體已經轉換到逃跑的模式(圖1)。腦部傳來的神經訊號傳給了身體一個初步的警訊。腦下腺將激素(或稱荷爾蒙)釋放到血流中,被喚醒的腎上腺開始湧出皮質醇(cortisol,或稱可體松)、腎上腺素以及去甲基腎上腺素(noradrenalin,又稱正腎上腺素)。這些物質發布了第二次的警告:應該是拔腳而逃的時機了!脂肪細胞、肌肉細胞、肝、心臟、肺以及血管全部立即反應,血管內湧入了糖與脂肪,氣管擴張,心跳加快 — 這些都可讓你的肌肉獲得能量與氧氣,目標在使你跑得愈快愈好,以便救命。
一個人的體內,有數十億計的細胞相互作用,它們大部分各自發展出了不同的角色。有些儲存脂肪,有些產生視覺,又有的產生激素或製造肌肉組織…。為了能讓身體適當運作,非常重要的是細胞必須和協運作。要能感知環境,而且認知道周遭發生的事情,身體就需要感知器。
位於細胞表面的感知器稱為受體(receptors),美國杜克大學(Duke University)的羅伯雷柯維茲(Robert J. Lefkowitz)與史丹福大學的布萊恩柯比卡 Brian K. Kobilka 二人因為釐清了一類被稱為 G-蛋白偶聯受體家族(簡稱GPCRs)的物質及其在體內的運作,共享今年(2012)諾貝爾化學獎的桂冠。在這個龐大的生化物質家族中,包括了腎上腺素、多巴胺、血清素、光線、口味與嗅覺等…的受體物質。許多的生理作用大都與 GPCRs 有關,大約有一半的藥物例如 b-阻斷劑、抗組織胺以及各種精神藥物等,是透過 GPCRs 受體物質發揮作用。
了解 GPCRs 生化運作的知識會大大的造福人類,不過這些受體卻在科學家的眼下藏匿了很久。
那個受體:一個隱藏的謎團
十九世紀末期,科學家們開始實驗腎上腺素對人體的影響時,就發現它會使心跳加速、血壓升高、以及瞳孔舒張。由於他們懷疑腎上腺素是透過體內的神經來運作,就癱瘓動物來實驗。然而,腎上腺素的作用仍然可以表現。他們當時的結論是:細胞一定具有某種受體,能在其環境中感知一些化學物質——可能是激素、毒物或藥物。
但是當研究人員企圖找尋那些受體時,他們卻撞了壁。科學家希望瞭解受體的長像以及它們如何輸送訊號給細胞。當腎上腺素施加於細胞的外側時,會導致細胞內部的代謝發生變化。每一個細胞都有一面外膜壁:就是一層脂肪分子膜將細胞物質與環境區隔。到底訊號是如何穿透這面膜壁的?細胞的內部如何知道外面發生了什麼事?
有數十年,一直無法找到這些受體。即便如此,科學家們仍發展出了一些藥物能專一的針對這一類受體中的特定類型發揮效果。在 1940 年代,美國科學家雷蒙阿爾奎斯特(Raymond Ahlquist)檢驗不同的組織對各種腎上腺素類似的物質如何反應,得到一個結論:一定有兩種不同的腎上腺素受體存在。一種主要讓血管平滑肌細胞收縮,而另一種主要刺激心臟。他稱這兩種受體為 a 和 b。很快的,科學家們發展出了第一個 b-阻斷劑,那正是我們現在最常使用的心臟藥物之一。
這種藥物毫無疑問的是在細胞內發生作用,但是它們是如何做到的卻一直成謎。我們現在知道為什麼這些受體是如此難以發現。因為它們的數量很少,而且大部分被包夾在細胞膜內。又經過了幾十年,甚至於阿爾奎斯特都開始覺得迷失在自己提出的兩個 a、b 受體理論之中時,他如此記載:「對我而言,它們像一種抽象概念。是假想出來解釋組織受到不同結構的化學物質刺激時,所觀察到的生理反應」。
就這 1960 年代末尾之時,今年的諾貝爾化學獎得主之一,雷柯維茲走進了這些受體的歷史。
將受體誘出它們的藏匿處
這位年輕的頂尖學生立下了要成為一位心臟病科醫師的目標,不過他在越戰高峰時期畢業,在美國公衛醫療服務體系的一個國家研究機構服役,那就是美國國家衛生研究院。在那裡他所面對的挑戰就是:找出那些受體。
雷柯維茲的主管已經有一個研究策略,他建議將具有輻射性的碘接在一個激素上。當這個激素結合到一個細胞表面時,碘的輻射線就可以用來追蹤受體。為了進一步的強化他的論點,雷柯維茲必須證明當這個激素結合在細胞膜壁時,真的會引發細胞內會產生的已知作用。如果能成功展示,就沒有人會質疑他真的發現了一個具有生物活性的受體。
雷柯維茲開始研究促進腎上腺皮質的激素,它會刺激腎上腺分泌腎上腺素。然而所有的實驗都失敗了。一年過去,仍然沒有任何進展。雷柯維茲打一開始並沒有對做研究那麼熱衷,現在卻已經開始喪失信心了,他雖然仍持續研究,但同時也夢想著成為一個醫生。
這個計畫進入了第二年,雷柯維茲終於有了進展。在 1970年,他在兩個聲譽卓著的期刊,國家科學院會報(Prceedings of the National Academy of Sciences,PNAS)與科學(Science)發表了幾篇重要論文,他描述發現了一個有效受體。這項成就讓他感受到做研究的興奮,最後他被延攬至北卡羅來納州的杜克大學。他並非特別想去杜大,只是對方給的條件實在好得讓他無法拒絕。
在嶄新的實驗室裡,雷柯維茲組成自己的研究小組。雖然看起來他可能永遠無法成為一位心臟病科醫師了,但他仍然想要研究心臟的疾病。因此,他開始把焦點放在腎上腺素與去甲基腎上腺素的受體,它們被稱為腎上腺素激導性受體(adrenergic receptors)。利用輻射性標記的物質,包括了 b-阻斷劑。他的研究小組檢驗了這些受體如何運作,在精細的調整所使用的工具後,他們終於掌握了高超的技巧來取得一系列從生物組織中萃取得到的受體。
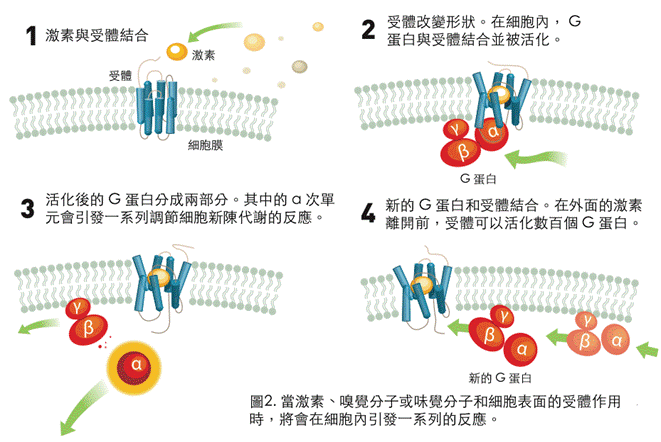
同時,有關細胞內部作用的知識不斷累積,研究者發現了他們稱之為 G-蛋白(1994年諾貝爾生理醫學獎)的物質。它會接到受體傳來的訊號而活化,接著 G-蛋白開啟一系列的反應,導致細胞代謝的改變。在 1980 年代初期,科學家們開始瞭解訊號從細胞外面傳遞到裡面的過程(圖2)。
基因:新看法的一個關鍵
在 1980 年代,雷柯維茲決定他的研究小組應該去尋找 b-阻斷劑受體的基因密碼,這項決定應可確定是今年諾貝爾化學獎獲獎的關鍵。一個基因就好像是個藍圖,它包含了一個密碼,能被細胞讀取,依照指示將許多胺基酸組合製成蛋白質,譬如製造一個蛋白質受體。他的想法是,如果研究小組能分離出負責的基因,並讀取 b-阻斷劑受體的藍圖,他們就可以得到該受體如何運作的線索。
差不多在同時,雷柯維茲錄用了一位年輕的醫師,布萊恩柯比卡。柯比卡對腎上腺素激導性受體之著迷,來自於醫院加護病房的經驗,一針腎上腺素可以決定病人的生與死。這個激素可以打開一個腫脹的呼吸系統,並加速心跳。柯比卡想要從腎上腺素的基礎結構細節來研究它的力量來源,也因此加入雷柯維茲的團隊。
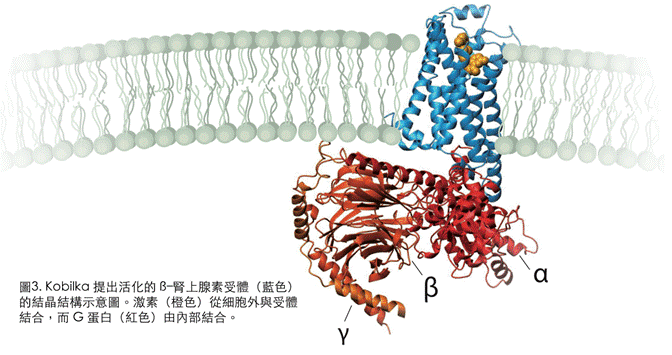
柯比卡作了基因搜尋。然而,在 1980 年代想要在人體龐大的基因體內尋找一個特定基因,就好像在大海裡撈針一樣困難。這個在技術上高度挑戰的計畫因此進展得十分緩慢。不過柯比卡利用了一個很巧妙的想法,使得這個基因終於被分離出來。帶著高度的期待,這些研究者開始分析基因密碼。研究顯示受體具有七條長而且具油性(疏水性)的螺旋形帶子─稱為螺旋體(圖3),這暗示了科學家們,這個受體可能繞進和繞出細胞膜七次。
七次!這與在人體內其它地方已經找到的另一個受體,具有相同數目的帶子以及同樣的螺旋形狀。那就是眼睛視網膜上的視紫質(rhodopsin)光受體。這巧合孕育出一個新的想法:這兩種受體有無可能是相關的,雖然兩者的功能不同?
雷柯維茲後來描述那才是『真正的發現時刻』(real eureka moment)。他知道這兩種受體都會在細胞內側與 G-蛋白作用,他也知道約有 30 個其它的受體是透過 G-蛋白運作。結論是:一定有一個完整的受體家族,長相類似而且運作的方式相同!
因為這個突破性的發現,謎底一步步的被組合浮現出來。現在科學家們對於 GPCRs 已經具有詳盡的知識——它們如何運作,以及如何在分子的層次被調控。雷柯維茲與柯比卡一直站在這整個科學探索工作的最前線。去年,2011 年,柯比卡與其研究團隊報導了一項新發現,他們的工作終於讓他們戴上了桂冠。
腎上腺運作的顯像
成功的分離出基因後,柯比卡搬到了加州史丹福大學的藥學院,他在那裡開始研究如何取得一個受體的影像:大部分科學界的人認為是不可能的任務——而對柯比卡來說,那成為了一條漫長的旅途。
要將一個蛋白質顯像,牽涉到許多複雜的步驟,蛋白質小到無法用普通的電子顯微鏡來觀察,因此科學家們使用一種稱為 X-射線結晶學(X-ray crystallography)的方法,他們先培養出一顆蛋白質的晶體,其中蛋白質分子以整齊且具對稱性的模式整齊排列,就好像水分子在冰晶中,或是碳原子在鑽石中的排列一般。研究者用 X-射線照射這個蛋白質晶體,當射線打到蛋白質時發生繞射(diffraction),科學家們可從繞射的圖譜推導出蛋白質在分子層次的構造與排列。
歷史上第一個蛋白質晶體的結構圖像是在 1950 年代產生。從那時開始,科學家們已經利用 X-射線將上千的蛋白質顯像。不過它們大都是水溶性的,使得養晶較為容易。少有研究者能將位於油性細胞膜上的蛋白質單離顯像。在水裡,這類蛋白質就像油難溶於水,而且非常容易形成非晶性的油團。此外,GPCRs 天生游動性較高。(記得它們是藉著移動來傳遞訊號!)可是在晶體中,GPCRs 的分子又幾乎完全靜止,要讓它們單離結晶出來遂成為極大的挑戰。
柯比卡花了超過二十年的時間去找到這所有問題的解答,要感謝研究者的決心、創意和分子生物實驗的巧手,柯比卡與其研究團隊終於在 2011 年完成了最終目標:他們得到了一張圖像,顯示受體正在將來自於細胞外激素的訊號,傳到細胞內的 G-蛋白(圖3)。
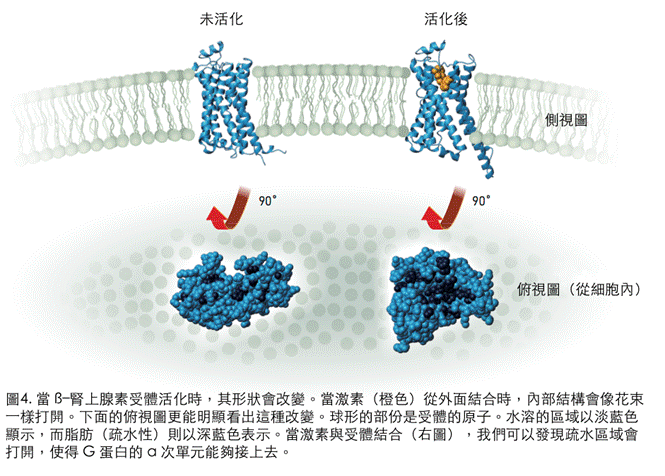
這個圖像發表在「自然」期刊上,論文顯示了 GPCRs 新的細節。例如,當被活化的受體打開一個孔洞,準備與 G-蛋白在該處結合時的長像為何(圖4),這種資訊對未來發展新的藥物極為有用。
人類基因體的按圖索驥,暴露了約有一千個基因是 GPCRs 的密碼。大約一半的 GPCRs 受體接受氣味,並且是嗅覺系統的一部分。約三分之一是激素與訊號物質的受體,像是多巴胺、血清素,前列腺素、升糖素(glucagon)或組織胺。有一些受體可捕捉進入眼睛的光線,還有一些位於舌頭,給我們味覺。超過百種的受體仍然是科學家的挑戰,它們的功能仍然有待確認。
除了發現這些受體的各種變體,跟在雷柯維茲與柯比卡腳步之後的研究者發現它們具有多重功能。一個單一的受體也許可以辨識好幾種細胞外的激素。此外,它們在細胞內側不僅僅與 G-蛋白作用,它們也可與被稱為受體抑制(arrestins)的蛋白質作用。科學家開始認識到這類受體不見得一定與 G-蛋白偶合,導致科學家們開始稱呼它們為七跨膜蛋白質(7TM),因為它們具有七個螺旋形的帶子繞進繞出細胞膜。
這些受體的數目和靈活性,賦予細胞為了生命所需,經過精細調控程序而具備的調節能力。我們再回到一開始在公車站逃跑的場景,當血液湧入了腎上腺素,不同的組織會有不同的反應。流到消化器官的血液減少;同時,流到肌肉的血液增加。腎上腺素的不同效應,有賴於體內至少有九種不同的受體對此一激素發生反應。某些受體啟動細胞的活動,而另一些則具有鎮定的作用。
所以下一次你感到害怕時,回味一下美好食物的味道,或是單純的望向天際的星星,想一下你那與 G-蛋白偶合的受體。沒有它們,你的細胞將會相互衝突,混亂將控制你的身體。
參考資料
本文譯自諾貝爾化學獎委員會公佈給大眾的新聞稿,原文可自以下網站取得:
http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2012/popular.html