- 作者/林家揚|臺大昆蟲學系碩士生。
- 作者/林鈺淳|臺大昆蟲學系博士生。
- 作者/吳岳隆|臺大昆蟲學系副教授。
- 作者/黃榮南|臺大昆蟲學系教授。
Take Home Message
為了大規模生產出我們想要的蛋白質,以製造出疫苗、蛋白質藥物、保養品等產品,目前已有許多方式能進行蛋白質表現。而昆蟲表現系統在細胞培養的成本低,且其蛋白質轉譯後修飾系統和真核生物比較接近,使其具有生產上的優勢,但它還是難以供應大量市場需求。
若能直接把昆蟲當作生產蛋白質的工廠,利用病毒感染蟲體後,再從蟲體的體液中回收蛋白質,便能提高產量、降低生產成本,而這也是所謂「生物工廠」的概念。
嚴寒的冬季往往是許多病毒歡樂肆虐的嘉年華,狡猾的它們趁著天氣寒冷、人們免疫力下降時趁虛而入,並在人體內引起如發燒、咳嗽、流鼻水等症狀。為了避免這樣的情況發生,許多人選擇施打疫苗以抵抗這些病毒,但是我們該如何快速生產這麼多疫苗來供應所有需求?
傳統疫苗大多由蛋白質組成,而且需求量極高。因此需要一個能夠大規模生產、效率夠高,同時成本較低的蛋白質生產模式,而此生產模式也可以應用在其他和蛋白質相關的產品上,例如蛋白質藥物或保養品等,不過有哪種生產模式能符合這麼多要求呢?
哪些方法能製造出想要的蛋白質?
你第一個想到的也許是基因改造生物(genetically modified organism, GMO,簡稱基改生物),只要靠著修改生物的基因序列,便能替我們生產出需要的蛋白質。雖然這是一種可行的方式,不過以大規模生產的角度來說卻不可行,因為創造基改生物並非一朝一夕就能達成,從完整的生物個體層級來看也是非常困難的事情,更牽涉到生物體內各式各樣的生物系統。
也許我們修改的基因會對生物造成負面影響;又或是修改的基因序列表現量不佳,無法工業化大規模生產,這些潛在因素都可能使得修改基因序列難以成功且無法預測。此外,創造基改生物的成本高昂,以表現特定蛋白質來說,投資基改生物所需的時間和成本並不符合效益。
隨著科技進步,我們目前已經有更多選擇能進行蛋白質表現,包括大腸桿菌表現系統、酵母菌表現系統、昆蟲表現系統、哺乳動物表現系統等(圖一)。由於真核生物(eukaryote)和原核生物(prokaryote)的蛋白質轉譯後修飾(post-translational modification)有所差異,因此大部分會將大腸桿菌和酵母菌的表現系統,應用在原核生物的蛋白質表現;而昆蟲和哺乳動物的表現系統,則應用在真核生物的蛋白質表現。雖然酵母菌是真核生物,但因為其蛋白質轉譯後修飾系統和原核生物比較接近,所以大多還是使用在原核生物的蛋白質表現,那麼我們要如何選擇這幾個表現系統?
圖一:四種不同的蛋白質表現系統

若是從人類的角度來看,由於人類屬於真核生物,我們該選擇的不是昆蟲表現系統,就是哺乳動物表現系統。而這兩個表現系統又以昆蟲更勝一籌,在大規模生產的考量之下,昆蟲的表現系統在細胞培養的成本遠低於哺乳動物。哺乳動物的細胞培養需要非常多精密又昂貴的儀器和消耗品,例如能控制溫度和二氧化碳濃度的恆溫箱及細胞培養液,使得培養哺乳動物細胞的條件變得非常嚴苛。
由於生產過程的高成本,若想利用哺乳動物的表現系統大量生產蛋白質,便會有一定的困難度,更不用說哺乳動物系統不管是在細胞層級,還是生物個體等,大多都有法規上的問題,這些因素造就昆蟲表現系統在生產上的優勢。
用「病毒」製造出我們要的蛋白質吧!
既然如此,究竟要如何利用昆蟲來大量製造特定的蛋白質呢?答案其實很簡單,就是「病毒」。
病毒在感染寄主細胞後,能夠用寄主細胞內的資源來表現自己的基因,因此只要將病毒基因中的一部分序列,修改成我們想要的目標蛋白質序列,就能藉由病毒製造出特定蛋白質。也因此,「選擇何種病毒」是昆蟲表現系統中的關鍵,這個病毒必須具備能大量表現特定基因的能力,而且其宿主細胞也必須容易培養,這樣才能將產量提升到最高。而在這麼多種的病毒中,能滿足這麼多條件的就只有「桿狀病毒」(baculovirus)了。
目前在昆蟲表現系統上,最被廣泛使用的桿狀病毒是加州苜蓿夜蛾核多角體病毒(Autographa californica multiple nucleopolyhedrovirus, AcMNPV),屬於桿狀病毒科的一員,是一種雙股 DNA 病毒。核多角體病毒(nucleopolyhedrovirus, NPV)能感染多種鱗翅目(Lepidoptera)幼蟲,例如蝴蝶、飛蛾類幼蟲,而且在病毒感染蟲體後,會產生一種由「多角體蛋白」組成的結構,稱為「包涵體」(inclusion body)。
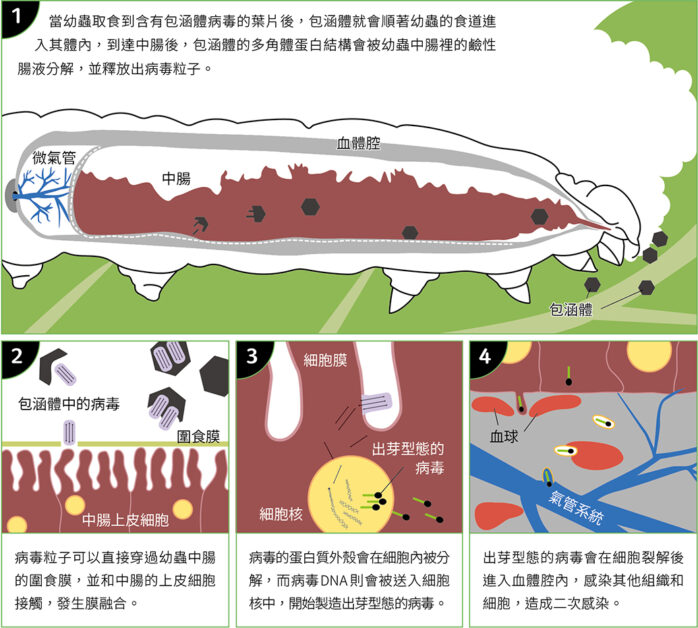
我們可把包涵體想像為一個用來包裹病毒的堅硬外殼,不只能保護病毒不受到外界傷害,甚至還可以讓病毒在自然環境中存續一年以上。這些能力讓它成為一種具有防治潛力的生物農藥,能以不使用化學農藥的方式控制蟲害。核多角體病毒的感染途徑從鱗翅目幼蟲的口器開始,當幼蟲取食到含有包涵體病毒的葉片後,包涵體就會順著幼蟲的食道進入其體內,到達中腸後,包涵體的多角體蛋白結構會被幼蟲中腸裡的鹼性腸液分解,並釋放出病毒粒子。
由於病毒粒子非常細小,直徑只有 250~300 奈米(nm),寬度也只有 30~60 奈米,可以直接穿過幼蟲中腸的圍食膜(peritrophic membrane)〔註〕;當病毒粒子穿過圍食膜後,會和中腸的上皮細胞接觸並發生膜融合。此時,病毒的蛋白質外殼會在細胞內被分解,而病毒 DNA 則會被送入細胞核中,開始製造出芽型態的病毒(budded virus),這些出芽型態的病毒會在細胞裂解後進入血體腔(hemocoel)內,進一步感染其他組織和細胞,造成二次感染(圖二)。在感染階段的晚期,病毒會大量表現多角體蛋白並組裝成包涵體,在蟲體死亡後釋出到環境中,因此多角體蛋白結構正是昆蟲表現系統中的關鍵。
圖二:核多角體病毒的感染機制
該怎麼做出目標蛋白質?
由於多角體蛋白會在病毒感染晚期大量表現,所以只要將多角體蛋白序列換成目標蛋白質序列,就能靠著核多角體病毒大量製造出我們想要的蛋白質。這個概念聽起來非常簡單,不過步驟卻有些複雜。
首先,需要準備一個複製載體(cloning vector)和一個轉移載體(transfer vector),複製載體裡含有我們要插入的蛋白質基因序列,並藉由聚合酶鏈鎖反應(polymerase chain reaction, PCR)或是大腸桿菌培養的方式來大量複製;轉移載體則含有多角體蛋白的啟動子(polyhedrin promoter)和一個外來基因的插入位置(multi-cloning site)。之後再利用限制酶(restriction enzyme)和連接酶(ligase),我們便可以將目標基因序列插入轉移載體中,形成重組轉移載體(recombinant transfer vector)。
第二步要準備切除處理過,呈現線狀的桿狀病毒 DNA。由於切除處理過的病毒 DNA 不具活性,因此不會影響接下來轉染(transfection)細胞的步驟;此外,因為它們可能也會被細胞攝入,感染與生成不含有目標序列的野生型病毒,因此先行去除病毒活性對實驗成功率來說相當重要。
最後一個步驟是轉染,將桿狀病毒 DNA 和重組轉移載體一同加進培養好的細胞中。由於重組轉移載體上有桿狀病毒的同源基因(homologous genes),所以當細胞攝入重組轉移載體和桿狀病毒 DNA 後,兩者會發生同源重組(homologous recombination),使得轉移載體上含有目標序列的同源片段,與桿狀病毒 DNA 上同源的位置互換,形成含有目標序列的桿狀病毒,也就是重組桿狀病毒(recombinant baculovirus)。這些重組桿狀病毒便會開始感染細胞,並表現出我們想要的蛋白質(圖三)。
圖三:桿狀病毒表現蛋白質的步驟
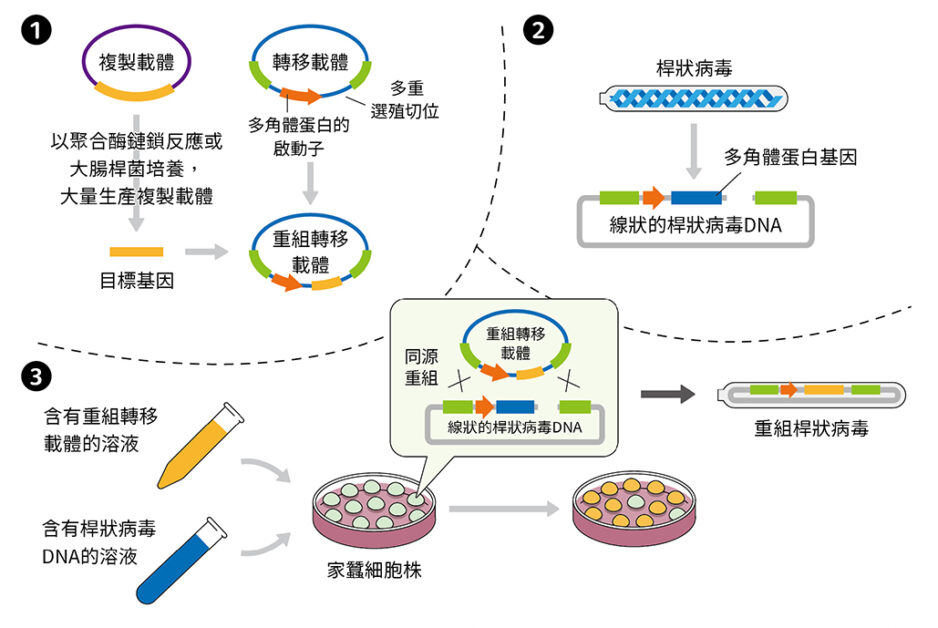
❶準備複製載體和轉移載體,複製載體裡含有要插入的目標基因序列,再以聚合酶鏈鎖反應或大腸桿菌培養大量複製;轉移載體含有多角體蛋白的啟動子,和外來基因的插入位置。之後利用限制酶和連接酶,將目標基因序列插入轉移載體中,形成重組轉移載體。
❷準備切除處理過線狀的桿狀病毒 DNA。
❸將桿狀病毒 DNA 和重組轉移載體一同加進培養好的細胞中。由於重組轉移載體上有桿狀病毒的同源基因,當細胞攝入重組轉移載體和桿狀病毒 DNA 後,兩者會發生同源重組,使得轉移載體上含有目標序列的同源片段,與桿狀病毒 DNA 上同源的位置互換,形成含有目標序列的桿狀病毒,也就是重組桿狀病毒。這些重組桿狀病毒便會開始感染細胞,並表現出我們想要的蛋白質。
將昆蟲當做「生物工廠」?
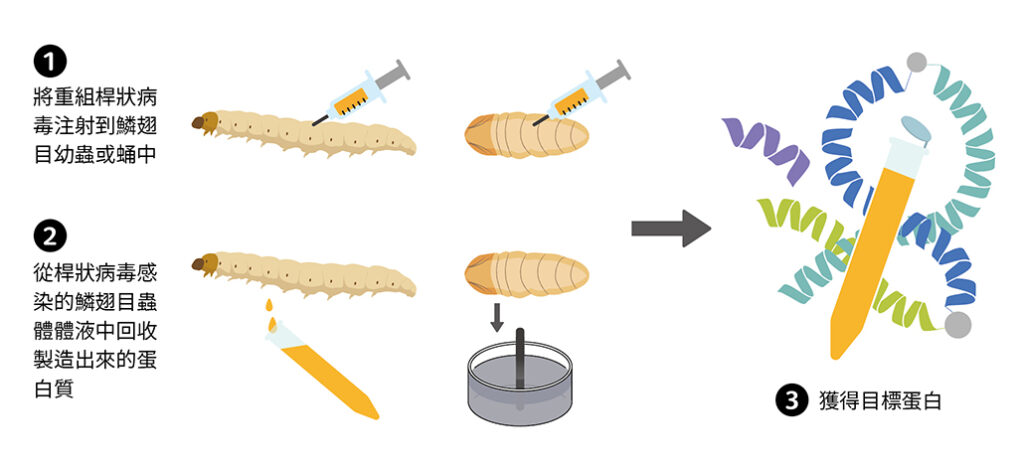
以目前桿狀病毒的發展來說,不論生產成本、速度還是生產線建立的難易度,都比哺乳動物的表現系統優勢很多,然而它還是難以供應大量的市場需求。利用昆蟲細胞生產蛋白質依然有一定的成本,若想擴大細胞培養系統也不容易,那如果我們使用整隻昆蟲進行蛋白質生產呢?利用病毒感染蟲體後,再從蟲體的體液中回收這些蛋白質,這樣是否能提高產量、同時降低生產成本呢?
其實這就是所謂「生物工廠」的概念,也就是直接把昆蟲當作我們生產蛋白質的工廠(圖四)。和細胞相比,昆蟲在培養上更加簡單,操作也更為容易,不像細胞需要特別注意有無汙染的情況,也不需要無菌操作台、細胞培養液、恆溫箱,以及提供細胞生長因子的胎牛血清(fetal bovine sera, FBS)等昂貴設備和耗材。以鱗翅目幼蟲的寄主來說,只需要透氣的塑膠容器和人工飼料就可以培養,而這些東西的成本都遠低於細胞所需,加上一隻幼蟲個體所含有的細胞數量也遠超過一個細胞培養皿,使得生物工廠這個概念成為昆蟲表現系統的一個新方向。
以真核生物或是人類需要的蛋白質來說,昆蟲表現系統具有許多哺乳動物的表現系統所沒有的優勢。以桿狀病毒感染昆蟲寄主、從而表現特定蛋白質的方式,不僅成本低、產量高、不受法規上的限制,也更容易設計出產業上的供應鏈,若是有真核生物蛋白質的需求,不妨考慮看看昆蟲表現系統吧!
圖四:利用蟲體作為生物工廠
註解
- 〔註1〕圍食膜是一種在昆蟲中腸裡,用來保護腸壁細胞的膜狀結構,有如人類腸胃中的黏膜。

- 〈本文選自《科學月刊》第621期〉
- 科學月刊/在一個資訊不值錢的時代中,試圖緊握那知識餘溫外,也不忘科學事實和自由價值至上的科普雜誌。