本文轉載自中央研究院「研之有物」,為「中研院廣告」
又一「國際關注公共衛生緊急事件」 2022 年的猴痘病毒大概是除了新型冠狀病毒以外,最被社會關注的病毒之一,在這波的全球感染趨勢下,臺灣疾病管制署 2022 年 10 月 9 日公布,國內出現第 4 例猴痘境外移入確定病例。我們該繼續擔心猴痘病毒嗎?中央研究院研之有物團隊專訪院內分子生物研究所張雯研究員,請她解析痘病毒進入宿主細胞的機制,以及猴痘病毒的感染風險。
2022 年的猴痘疫情是繼 2020 年新冠肺炎疫情之後的「國際關注公共衛生緊急事件」。圖/iStock 根據世界衛生組織(World Health Organization, WHO)統計,自 2022 年 5 月英國出現首例猴痘(Monkeypox,或稱 Mpox)個案之後,迄 10 月為止,全球已通報超過 7 萬確診病例。[註1]
WHO 也在 7 月 23 日正式宣布,猴痘是繼 2020 年新冠肺炎疫情之後,又一「國際關注公共衛生緊急事件」(Public Health Emergency of International Concern,PHEIC),呼籲各國應該對此波病毒傳染加以重視。
猴痘病毒是什麼?這類型的痘病毒如何感染人類?讓我們接著看下去吧!
註1:為避免汙名化,2022 年 11 月 WHO 開始鼓勵使用「Mpox 」作為「Monkeypox」的同義詞。 自 2022 年起,全球頻繁出現人傳人 猴痘病毒在分類學上,屬於痘病毒科 (Poxviridae),正痘病毒屬(Orthopoxvirus)。該病毒於 1958 年首次從實驗用猴的皮膚病灶中被分離,故命名為「猴痘」病毒。雖然它可以感染猴子,但是寄主範圍廣泛,尚包括齧齒動物如甘比亞袋鼠與其他靈長類動物。
猴痘病毒的真正野外宿主尚未有定論,可能為小型哺乳類。猴痘病毒透過這些中間宿主傳播給人類,屬於人畜共通傳染病。
病毒由野生動物傳播給人類的方式,通常透過直接接觸,像是碰觸到受病毒感染動物的血液、體液或黏膜;食用受感染動物也有感染風險。
在過去,猴痘的傳播幾乎都侷限在非洲大陸,直到 2003 年美國爆出 40~50 例之感染案例。經追查後發現,感染源頭為走私進口之非洲寵物鼠,將病毒傳染給當地土撥鼠及人類。值得一提的是,此次感染人類之猴痘病毒株毒性較弱,無人死亡,整個疫情在半年內就平息了,而且鮮少出現人傳人的案例。
在非洲流行的猴痘病毒可分為中非和西非兩個分支,中非分支比西非分支病毒更容易傳播,且致死率更高,可達 10%。然而,因為疫情僅限於非洲,即使致死率高也鮮少受到國際關注。
自 2022 年 5 月以來,造成全球頻繁出現人傳人的猴痘病毒,經定序確認屬於西非分支,致死率約為 1%。 此次疫情人與人之間的傳播多半是經由密切接觸,像是身體接觸時沾染到感染者分泌物、黏膜,或是皮膚水泡破裂流出的體液等等。另外也有機會經由口鼻噴出的飛沫,或是日常用品如衣物表面傳播病毒。
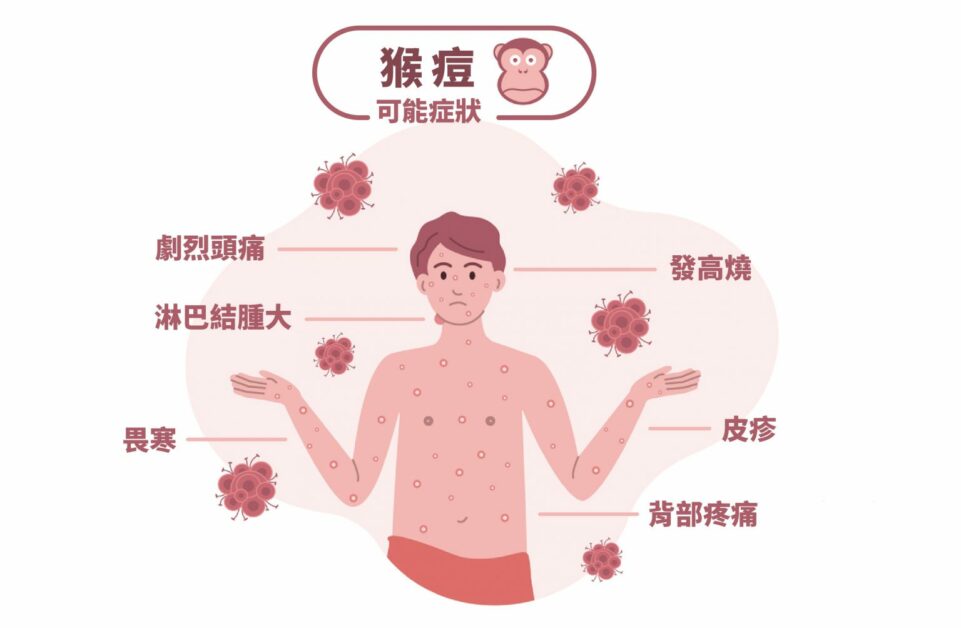
傳統上,感染猴痘後會出現發燒、畏寒、頭痛、淋巴腺腫大等典型症狀,並在發病後起疹子,自患部蔓延至身體其他部位,繼而發展成水泡、膿疱等。
不過,美國疾病管制與預防中心指出,2022 年疫情的病患多半由於性接觸造成傳染,因此出現較不典型的症狀,像是疹子最早出現在生殖器或肛門周圍,且不一定會擴散至身體其他部位,發燒等症狀也比較不明顯,因此不易辨別、常常誤診成其他傳染病。目前臺灣衛生福利部疾病管制署,已把猴痘列為第二類法定傳染病,不敢輕忽大意。
天花疫苗也可以抵禦猴痘 說到猴痘病毒,便不得不提到同樣是正痘病毒屬,且惡名昭彰的近親:天花病毒(Variola Virus)。感染天花病毒產生的症狀跟猴痘類似,但更為嚴重。歷史上幾次天花大流行,至少帶走三億人的性命。不過在十八世紀,愛德華,金納(Edward Jenner)醫師倡導以牛痘病毒(Vaccinia Virus)製成的天花疫苗,已經於二十世紀成功的將天花病毒趕盡殺絕,目前僅有美、俄兩國的中央疾管機構仍保存些許天花病毒。
天花疫情之所以能被完全清除於人類社會,一個很重要的原因是因為其沒有人類以外的其他宿主。
天花病毒只會在人類之間散佈;當疫苗逐漸普及,民眾逐漸獲得抵抗力之後,天花病毒就無法生存。至於近期快速散播的猴痘病毒則不同,由於寄主範圍較廣,可感染多種野生嚙齒及靈長類等動物,導致猴痘病毒較不易完全根除。
針對此一波猴痘疫情,張雯指出,雖然病毒基因組上已經出現多個鹼基的變異,但不必然產生功能性影響。此外,因為痘病毒表面有多種相似度高之抗原,接種天花疫苗產生之免疫細胞仍具有可辨認猴痘病毒之能力 ,產生具有中和活性之抗體來保護個體。目前的第三代天花疫苗對猴痘仍具有相當的防禦能力,民眾毋需過於恐慌。
為什麼用牛痘病毒製作的天花疫苗可以抵禦猴痘病毒?
原因在於牛痘、猴痘與天花病毒親緣關係接近,不僅病毒表面有同源性高的蛋白質用以進入寄主細胞,三者入侵細胞的機制也類似。長期研究牛痘病毒進入細胞機制的張雯認為,目前的研究成果可以協助科學家了解猴痘病毒的生活史。
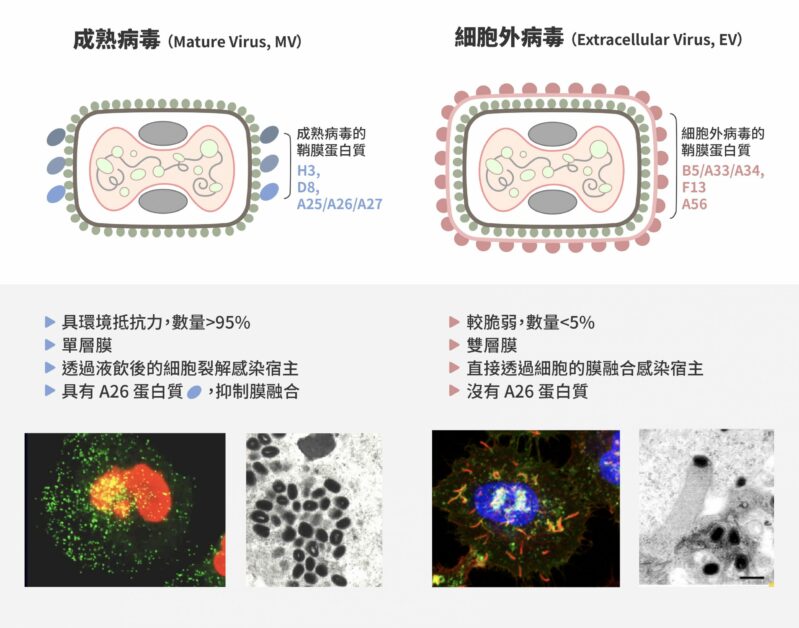
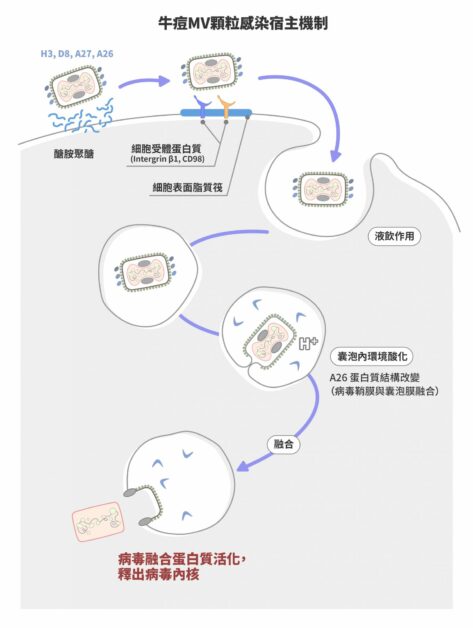
關鍵在於表面鞘膜蛋白 對於痘病毒進入細胞的機制,以牛痘病毒當作模式物種研究的張雯指出,有感染力的痘病毒具有兩種形式,成熟病毒(Mature Virus,MV)及細胞外病毒(Extracellular Virus,EV)。兩者均帶鞘膜,但 95% 以上細胞內產生的病毒為成熟病毒。
成熟病毒藉由鞘膜上的四種鞘膜蛋白質,分別是:H3、D8、A26 及 A27,以附著在細胞表面的醣胺聚醣(Glycosaminoglycans)。接著病毒會聚集於細胞表面脂質筏(Lipid rafts)與細胞受體蛋白質 Intergrin β1 以及 CD98 結合,誘導宿主細胞內的訊息活化,產生細胞肌動蛋白質的聚合作用(Actin polymerization),促成液飲作用 ( Fluid phase endocytosis ) 將病毒吞入細胞內。
牛痘病毒有兩種感染顆粒,一種是成熟病毒(Mature Virus,MV),數量佔 95% 以上;另一種是細胞外病毒(Extracellular Virus,EV),數量只佔 5% 以下。圖/研之有物(資料來源|張雯) 牛痘病毒的成熟病毒顆粒進入宿主細胞的機制。 牛痘成熟病毒被液飲作用產生的囊泡所包裹進入細胞質,接下來囊泡內環境會逐漸酸化,而酸性會誘導病毒鞘膜蛋白質 A26 結構改變,使得病毒融合蛋白質活化,促使病毒鞘膜與囊泡膜融合,脫去鞘膜的病毒內核進入細胞質內,開始新一波的基因複製及病毒組裝。
大部分 DNA 病毒是進入到細胞核,因為合成 DNA 所需之核苷酸原料在宿主的細胞核裡面;但痘病毒卻不是,反而在細胞質裡進行它的生活史。
張雯指出,痘病毒具它自身專用之 RNA 及 DNA 聚合酶,連基因轉錄及基因複製的過程都不假手宿主細胞之聚合酶。
牛痘病毒的感染顆粒進入宿主細胞的動態影像,紅色為成熟病毒顆粒(MV)、綠色為細胞外病毒顆粒(EV)。註:可開啟「循環播放」功能方便觀看。資料來源/張雯 從單層到雙層膜 牛痘病毒進到宿主細胞後,早期反應基因(Early gene)會立刻開始表現,產生早期病毒蛋白質,包括中期轉錄因子和 DNA 聚合酶以 DNA 複製;病毒會接續產生其他中後期的蛋白質,並且修飾內質網,把遺傳物質與蛋白質組裝成新的成熟病毒顆粒,完成牛痘病毒的生活史。
細胞產生之 MV 是非常穩定的病毒狀態,製造出來後會留在細胞質內,待細胞死亡破裂才會釋出。然而,少部分的 MV 會被運輸到寄主細胞的高基氏體進行「加工」,多包兩層高基氏體的膜,形成三層膜的病毒顆粒(Wrapped Virus,WV),並藉著細胞的微管移動到細胞邊緣。
接著,三層膜的 WV 病毒會透過「內向外」的細胞膜融合,脫去最外層的膜,剩下兩層膜之 EV 便裸露在寄主細胞膜的「外面」,伺機尋找下一個細胞。EV 與 MV 不同,在環境中極不穩定,也因其鞘膜特性的不同,兩層膜的 EV 較脆弱,一旦附著在細胞表面後,其第一層外膜產生撕裂,露出第二層膜,不需經由胞飲過程及酸性環境的催化,此時 EV 可以直接與細胞表面之細胞膜進行膜融合 ,完成感染過程。
A26 蛋白質影響感染途徑 「成熟病毒 MV 藉胞飲作用後的酸性環境觸發病毒膜與囊泡膜融合,跟 EV 病毒在中性條件下直接與細胞膜融合,這兩種模式最大的差異,就取決於病毒表面是否有 A26 鞘膜蛋白質。」
張雯指出,A26 的作用就是抑制病毒膜融合的進行,而 A26 鞘膜蛋白質只存在 MV 表面,卻不在 EV 表面。A26 蛋白質組裝在病毒顆粒上,抑制膜融合,以維持 MV 病毒的穩定。 直到病毒感染細胞後,它的抑制功能會在囊泡形成的酸性環境下被解除,膜融合才得以順利進行,將病毒內核送入細胞質中。
不只是牛痘,天花跟 2022 年流行的猴痘病毒表面都有 A26 鞘膜蛋白,藉由解開鞘膜蛋白質如何調控病毒入侵細胞的機制,或許可以在未來變成圍堵猴痘病毒的籌碼。
表面抗原蛋白多,不必擔心免疫逃脫 目前已報導的猴痘病毒有多達 50 處基因突變,而突變帶來的效果還有待進一步研究,但張雯卻不那麼擔心會有免疫逃脫的狀況出現。張雯指出,已經有實驗證明天花疫苗可以預防猴痘病毒,不論是先前提到一層膜或兩層膜的痘病毒狀態,被疫苗激活的人體免疫細胞都有能力辨認。
「新冠肺炎只有一個棘蛋白當作抗原,要是一出現突變就很麻煩;但猴痘病毒不一樣。」張雯解釋說,猴痘病毒表面的鞘膜蛋白例如 H3、D8、A27、L1 及 B5 都具有多樣的抗原區域,可刺激強大的免疫反應,產生各式各樣中和抗體。 當中和抗體辨認的病毒抗原目標大且多時,病毒就很容易被發現、殲滅,即使少許突變也無法讓病毒逃脫其餘中和抗體的辨識。
因此,張雯表示,對付猴痘病毒用現有的第三代天花疫苗就夠了!「其實不論哪一代天花疫苗,刺激免疫力的能力都夠好,差別主要在於疫苗本身的安全性。」張雯強調,因為天花在 1980 以後就已經滅絕,沒有必要實施接種。各國現有的天花疫苗庫存是為了少數高危險群工作者之防護,或是防範天花病毒作為生化武器之用途,存量不夠多,短時間內無法供應大量民眾施打,所以猴痘疫情才會在爆發初期就引起恐慌。
如今猴痘病毒在特定群體中傳播只是暫時的表象,張雯指出,猴痘病毒傳播主要是靠接觸傳染,而且無關性別、性傾向或是否有發生性關係,只要有近距離的「肢體接觸」或污染物接觸都有可能沾到病毒而感染。各國有關當局應盡快鎖定確診個案的接觸者,以及接觸者的親朋好友們,讓他們優先施打疫苗,並追蹤成效。動作越快就越能有效圍堵疫情。
張雯解釋,新冠病毒僅有一個棘蛋白當作抗原,而猴痘病毒表面鞘膜蛋白有 H3、D8、A27、L1 及 B5 等多個蛋白質,可以提供中和抗體諸多可以辨認的抗原區域。圖/研之有物 阻斷病毒進入本土生態鏈是當務之急 過去各國科學家花費許多心思研究天花病毒,讓 WHO 存有足夠的天花相關資料,一舉成功用疫苗滅絕天花病毒。這也是至今人類醫療史上唯一成功滅絕病毒的案例。以此為基礎,想要防治相近的猴痘病毒並非難事。張雯也不認為短期內猴痘疫情會一發不可收拾。
回顧 2022 年,有很多個案是因從事性行為產生的密切接觸而被傳染,「當然固定性伴侶是可以減少病毒傳播的機會」張雯說。然而,過度簡化個案特徵與傳染途徑,再加上現任 WHO 秘書長譚德賽的發言 ,以及媒體大肆渲染下,容易誤導民眾以為猴痘是只會在男同性戀間傳播的性病。
「就跟當初 1980 年代的愛滋病一樣,一開始社會大眾以為只有同性戀社群才會被感染;猴痘也要多注意,不然也會污名化少數社群,帶給他們很大的傷害。」張雯再次強調,猴痘病毒會在人類全身流竄,不只侷限於性器官。
想要知道猴痘病毒在全球感染趨勢,張雯建議臺灣民眾可以追蹤有公信力的媒體跟網站,如 WHO 網站;由於美國猴痘病例約佔全球病例之半,美國疾病管制與預防中心也時常更新相關資訊。而臺灣目前只有 4 例境外移入,且都被快速攔截,應該還沒機會讓病毒散佈到其他人或動物身上造成本土感染,故暫時不用恐慌。
不過,由於猴痘病毒還會感染人以外的動物,為了預防未來出現本土感染,當前之務即是要注意並阻斷外來病毒進入當地寄主生物之生態鏈中。
延伸閱讀 Ahmed, S. F., Sohail, M. S., Quadeer, A. A., & McKay, M. R. (2022). Vaccinia-virus-based vaccines are expected to elicit highly cross-reactive immunity to the 2022 Monkeypox virus . Viruses , 14(9), 1960. Alakunle, E. F., & Okeke, M. I. (2022). Monkeypox virus: A neglected zoonotic pathogen spreads globally . Nature Reviews Microbiology , 20(9), 507–508. Isidro, J., Borges, V., Pinto, M., Sobral, D., Santos, J. D., Nunes, A., . . . Gomes, J. P. (2022). Phylogenomic characterization and signs of microevolution in the 2022 multi-country outbreak of Monkeypox virus . Nature Medicine , 28(8), 1569-1572. Tomori, O., & Ogoina, D. (2022). Monkeypox: The consequences of neglecting a disease, anywhere . Science , 377(6612), 1261–1263. World Health Organization. (n.d.). Monkeypox https://www.who.int/news-room/fact-sheets/detail/monkeypox Fenner, F. (1993). Smallpox: Emergence, Global Spread, and Eradication .History and Philosophy of the Life Sciences , 15(3), 397–420. Foster, S. O., Brink, E. W., Hutchins, D. L., Pifer, J. M., Lourie, B., Moser, C. R., . . . Foege, W. H. (1972). Human monkeypox . Bulletin of the World Health Organization , 46(5), 569–576.