由頑皮狗工作室開發,於2013年發行的恐怖生存遊戲《最後生還者》(The Last of Us)以,寫實風格的末日場景、動人的角色刻畫等特色撼動人心(不管是感動或是怕到發抖XD)。被突變真菌毀滅的文明讓道德界線變得模糊,我們扮演的遊戲角色為了生存只能憑依著有限資源,在充滿惡意的新世界中殺出一條血路。
喪屍一直是各種娛樂媒體喜愛的創作元素,死而復生的認知衝突再加上腐爛肢體的身體恐怖,有著為數不少像是《惡靈古堡》、《活人牲吃》、《死亡復甦》、《陰屍路》等經典IP。從失控的生化兵器到遠古黑魔法,不同的世界觀對喪屍的設定往往都有各自的巧思,唯一不變的只有它們對其他生命的敵意(或者是更直接的「食慾」)。

即便最近剛出的續作引發不少爭議,《最後生還者》仍用細緻且別出心裁的喪屍設定在百家爭鳴的遊戲市場中贏取自己的歷史地位。這方面的成功得歸功於製作團隊對現實喪屍的考據,為整個故事增添不少沉重的真實感。
是的,你沒看錯。遊戲團隊參考的可是現實世界真實存在的「喪屍」!就讓我們一起來看看這到底是怎麼回事、《最後生還者》的喪屍末日距離我們又有多遠呢?
______ 防雷分隔線,本文涉及《最後生還者》劇透______
被拿來入藥的喪屍?
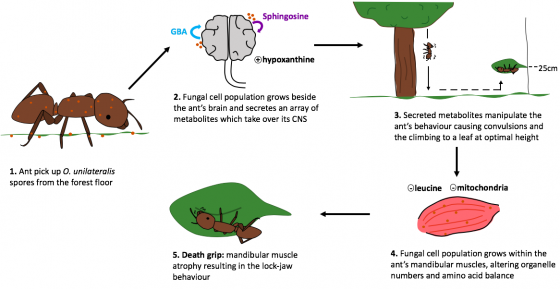
遊戲所取材的「喪屍真菌」其名為偏側蛇蟲草(Ophiocordyceps unilateralis)。這個名字對一般大眾或許有些陌生,但是它的近親正是台灣社會耳熟能詳的中藥材──冬蟲夏草(Ophiocordyceps sinensis)。他們都是蛇形蟲草屬(Ophiocordyceps)的一員:此屬的重要特徵便是會寄生在昆蟲體內,以宿主的養分為食、成長茁壯。
被寄生的昆蟲死後軀體會迅速被真菌菌絲佔據,接著子實體(真菌的有性生殖結構)會穿出宿主軀殼散播孢子,尋找下一個宿主。
既然都是寄生,為什麼只有偏側蛇蟲草得到「喪屍真菌」的稱號?
其中決定性的差異便是:不同於冬蟲夏草靜靜在原處消化宿主,偏側蛇蟲草更喜歡把宿主當成代步工具四處爬爬走。偏側蛇蟲草主要以巨山蟻屬(Camponotus)為宿主,當孢子接觸到螞蟻體表後便會分泌酵素蝕穿外骨骼,讓菌絲向內生長、侵占宿主全身的肌肉纖維。

即便偏側蛇蟲草為了確保宿主生命機能不破壞其腦部,此時的螞蟻也已經是名符其實的「牽線木偶」,任由真菌駕著自己前往適合真菌生長的潮濕陰暗場所,然後控制宿主螞蟻用下顎固定好身體,而後偏側蛇蟲草的子實體會破開頭殼、向外伸展,讓宿主變成驚悚版天線寶寶,用新生孢子對世界說你好:)
- 編按:還有其他哪些「喪屍」呢?歡迎參考我們這集科學布袋戲喔:
很近又很遠的喪屍末日
在《最後生還者》的世界中,原本只寄生小型宿主的蟲草(遊戲內統稱其為 Cordyceps)發生突變,開始侵蝕人類與其他大型動物,最終抹除世界上超過6成的人口。
只要被孢子感染,蟲草的菌絲都會在1到2天內抵達宿主的大腦。這也是遊戲與現實世界最大的差異。偏側蛇蟲草透過劫持肌肉組織來控制宿主行動,卻放過了掌管生命機能的腦部;遊戲裡的蟲草卻是打從一開始就是直奔宿主大腦而去,就算是從腳趾開始感染也會不惜千里迢迢趕到人體另一端定居。

雖然是以大腦為目標,蟲草還是保留了偏側蛇蟲草不輕易殺害宿主的特性,畢竟蟲草是外來者,無法完全取代腦細胞的工作。這也代表被感染者仍保有一定程度的知覺,蟲草只能透過間接的方式引導宿主做出有利於傳播孢子的行動(例如咬人)。
蟲草到底是怎麼驅使被感染者攻擊其他生命的?根據遊戲內的文件記錄,被感染者很可能是被菌絲侵蝕大腦邊緣系統(limbic system)才有如此強烈的攻擊性。在過去的腦傷與動物實驗中,邊緣系統(特別是杏仁核)與個體的威脅偵測、情緒控管以及攻擊行為皆有關聯,再加上菌絲在體內深入造成的痛苦,被感染者見人就咬的瘋狂行徑似乎也不是那麼難以理解了。
《最後生還者》的蟲草固然可怕,但真要在現實世界引發喪屍末日恐怕還要先克服一些技術上的限制。即便真菌感染在現實世界並不少見,「真菌病」卻鮮少進入大眾視線、更不要說引發社會恐慌了。這是因為人體複雜的結構與免疫系統的保護都能有效抑制菌絲侵蝕,也讓我們比較容易切除受感染的部位切除或針對性投藥。雖然據統計每年約有160萬人死於真菌感染,但是這些案例大多都跟患者輕忽病情、免疫系統無法正常運作或當地醫療資源匱乏有關。
換言之,只要能及時得到妥善照顧,就算真的被蟲草感染,我們與人形秀珍菇之間還是有一段不小的距離。不過事情總是不怕一萬只怕萬一,要是《最後生還者》的蟲草末日真實現了,我們又該怎麼與它對抗?
喪屍「疫苗」真的能拯救世界嗎?
蟲草帶來的喪屍末日有沒有解決之道?《最後生還者》透過民兵火螢(Fireflies)提出一個可能的答案:疫苗。
但是這個可以帶給人類希望的疫苗真的可行嗎?阻止火螢研究的喬爾是否真的毀了人類僅有的希望?這也是《最後生還者》粉絲社群至今仍爭論不休的議題之一。除了道德、個人情感等因素,還有一個很重要的關鍵在於──沒有前例可以參考,根本無從判斷醫生的做法可不可行⋯⋯咦?

是的沒錯,在《最後生還者》的末日世界中不僅元凶蟲草是虛構產物,就連帶來希望的疫苗也是現實世界中並不存在的東西。即便疫苗已經是當代不可或缺的要件之一,也讓許多兇惡的疾病在人類社會絕跡,但是我們仍未有針對真菌感染的可用疫苗或免疫治療(immunotherapy)手段。即便已經有不少團隊在進行相關研究,截至目前為止都還卡在臨床試驗階段,距離實際投入生產還有很長一段路要走。
不過這並不妨礙我們用手上的線索來推敲可能的結果,畢竟這也是玩遊戲的樂趣之一嘛!
《最後生還者》把製作疫苗的希望放在女主角艾莉身上。被蟲草感染卻沒有變成喪屍的她被視為具有「免疫力」的存在,然而當火螢負責人瑪琳在跟喬爾討論艾莉時,卻提到她體內的真菌「突變」了。在火螢醫院撿到的錄音筆也告訴我們艾莉體內確實有蟲草寄生的證據(包括血液、血清與腦髓液都有檢出),唯有邊緣系統沒有菌絲侵蝕的跡象,判斷這可能是她仍能保持神智的主因。
這也讓艾莉的「免疫」有兩種可能的解釋:到底是她「能抑制蟲草感染」,還是「被感染了也沒有變成喪屍」?

若是艾莉的免疫系統真的有辦法抑制蟲草感染,那最合理的研究對象正是抗體本身。癒後血清治療(convalescent plasma therapy)便是透過分離痊癒患者的血漿,將抗體直接打進其他病患體內,縮短免疫系統反應的時間。這樣直接了當的治療方式雖然有一定風險,卻很適合用應急的過渡期,也成為許多國家對抗武漢肺炎的重點療法。
如果艾莉的奇特狀態根本與免疫系統無關,完全出自於蟲草本身的突變,那研究對象自然也得轉移到蟲草身上。雖然沒辦法從免疫系統著手,但也不代表醫生關於「疫苗」的構想就一定是錯的──只是得稍微替換一下概念。疫苗是透過「主動感染」毒害較低的病原體,避免往後發生真正有害的感染。如果退而求其次,不強求「避免感染」,而是著重在消除「有害」的影響,火螢試圖摘除艾莉腦內菌株的舉動就很耐人尋味了。
從艾莉不需要面罩也能在充滿孢子的空間暢快呼吸這點來看,來看,蟲草的感染很可能是採「先到先贏」的機制,也就是已經是被感染者的艾莉無法再成為其他蟲草的宿主,達到某種意義上的「免疫」。如果有辦法培養出艾莉體內的突變蟲草並接種到其他人身上,藉此讓對方免除被有害蟲草感染的風險,從廣義的定義來說這也能算是一種「疫苗」。
可惜的是,我們終究沒來得及弄清楚艾莉是哪一種狀況,被喬爾射成篩子的醫生也不可能有機會為自己辯護了。然而說穿了,《最後生還者》的兩難打從一開始就跟疫苗是否可行無關,而是在考驗「人性」。
人生如戲,戲如人生,就算喪屍末日離我們還很遠很遠,也會有其他大規模傳染病出現(例如已經糾纏我們大半年的武漢肺炎)。這時我們是否能夠從遊戲中有所收穫、有所成長,甚至是對未來超前部署才是最重要的。

參考資料
- Buchanan TW, Tranel D, Adolphs R (2009). “The Human Amygdala in Social Function”. In Whalen PJ, Phelps EA (eds.). The Human Amygdala. New York: Guilford.
- Hill, K. (2013). The Fungus that Reduced Humanity to The Last of Us. Scientific American, retrieved from https://blogs.scientificamerican.com/but-not-simpler/the-fungus-that-reduced-humanity-to-the-last-of-us/
- Leading International Fungal Education. The Burden of Fungal Disease: New Evidence to Show the Scale of the Problem Across the Globe, retrieved from http://www.life-worldwide.org/media-centre/article/the-burden-of-fungal-disease-new-evidence-to-show-the-scale-of-the-problem
- Machado, C. J., Kazama, A. M., & Bachevalier, J. (2009). Impact of amygdala, orbital frontal, or hippocampal lesions on threat avoidance and emotional reactivity in nonhuman primates. Emotion, 9(2), 147.
- Nami, S., Mohammadi, R., Vakili, M., Khezripour, K., Mirzaei, H., & Morovati, H. (2019). Fungal vaccines, mechanism of actions and immunology: a comprehensive review. Biomedicine & Pharmacotherapy, 109, 333-344.
- Nature Microbiology (2017). Stop Neglecting Fungi, retrieved from https://www.nature.com/articles/nmicrobiol2017120
- Santos, E., & Levitz, S. M. (2014). Fungal vaccines and immunotherapeutics. Cold Spring Harbor perspectives in medicine, 4(11), a019711.
- The Last of Us Wiki. Cordyceps Brain Infection, retrieved from https://thelastofus.fandom.com/wiki/Cordyceps_Brain_Infection
- The Last of Us Wiki. Medical Pamphlet, retrieved from
- https://thelastofus.fandom.com/wiki/Medical_Pamphlet
- The Last of Us Wiki. Surgeon’s Recorder, retrieved from https://thelastofus.fandom.com/wiki/Surgeon%27s_Recorder
- Wikipedia. Ophiocordyceps sinensis, retrieved from https://en.wikipedia.org/wiki/Ophiocordyceps_sinensis
- Wikipedia. Ophiocordyceps unilateralis, retrieved from https://en.wikipedia.org/wiki/Ophiocordyceps_unilateralis