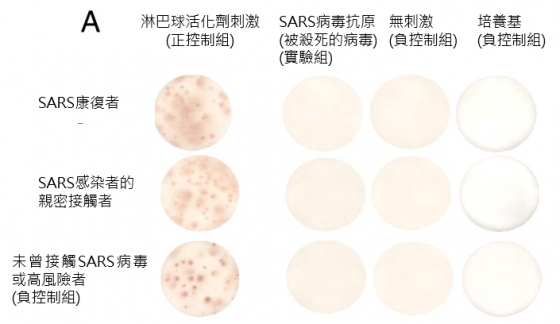
追蹤 2003 年的 SARS 康復者,發現抗體可維持到 2 年;但到了第 3 年,只剩半數還有抗體。

對抗病毒,最好的策略就是體內已有抗體能抵禦入侵。然而,面對新型冠狀病毒(SARS-CoV-2),我們不僅沒有疫苗,更不知道就算注射疫苗,體內抗體能維持多久的保護力?
然而,透過研究 17 年前感染了 SARS 病毒後的倖存者,我們能一窺「如果感染冠狀病毒後,抗體能保護我多久?」的可能解答!
阻絕再感染的 2 條防線:抗體、B和T細胞
針對病毒再感染的防禦線,包括三個關鍵成分:先備好的抗體、記憶B細胞 (memory B cell)和記憶T細胞(memory T cell) 1。
2003 年的 SARS 肆虐時,科學界已發現康復者血清裡有高專一性的抗體(IgG, Immunoglobulin G),能快速辨認冠狀病毒(SARS-CoV-1)蛋白質 2。血清抗體會隨著時間自然消失。倘若病毒再入侵,後續防線-記憶B細胞能否快速活化、擊殺病毒?成了避免再感染的關鍵。
然而,不同疾病的記憶 B 細胞壽命也不相同。以天花病毒而言,辨認該病毒的記憶 B 細胞壽命超過 50 年以上 1,因此天花被認為終生只會得一次。而針對其他疾病的記憶 B 細胞,則不一定如此長壽,因此有些疫苗需要補打,以重新訓練體內的白血球。
如果感染過SARS,抗體可維持多久?
持續追蹤 176 名SARS的康復者,發現 200 天內,100% 有抗體(IgG),而 1 和 2 年後,分別約 93.9 %和 89.6% 的康復者仍有抗體;然而 3 年後,擁有抗體的人,掉到僅剩 50%。
換言之,血清裡 SARS 病毒抗體,平均維持 2 年。而第三年時,血清抗體百分比和效價(titers)顯著降低。因此,SARS 康復者 3 年後,就可能會再次感染 3。
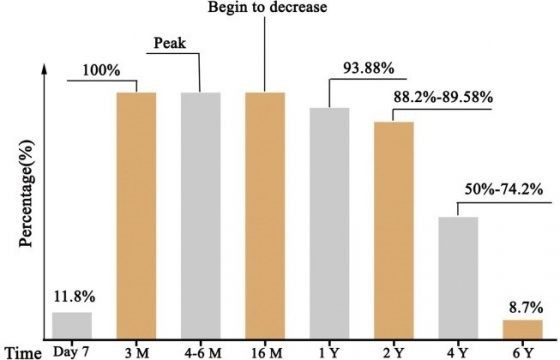
橫軸為被病毒感染後的時間,縱軸為擁有血清抗體的比例(%)。圖/參考文獻 4
如果感染過 SARS,記憶性 B 和 T 細胞可維持多久?
如前文所述,血清的抗體是第一道防禦線;而記憶性 B、T 細胞則是免疫力能維持多久的關鍵。
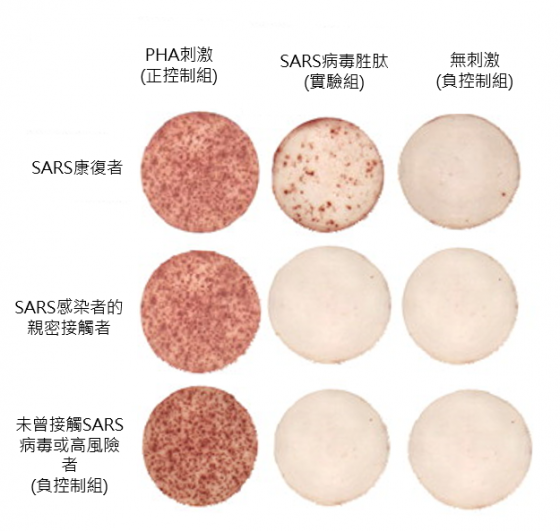
研究發現六年後,23 名康復者裡,沒有人帶有對 SARS 有專一性的記憶性B細胞;而具有對 SARS 有專一性的記憶性T細胞的康復者,則有 14 例(60.9%) 1。
但需注意,單只擁有記憶性 T 細胞,不一定能對抗再感染,因免疫作用的複雜性極高,僅有記憶性 T 細胞的人體,不代表免疫系統再遭遇 SARS 病毒時,也能快速反應、避免感染 1。
除上述發現之外,研究也發現男性抗體下降明顯快於女性,且有統計意義,目前並不清楚其原因2。
遭遇病毒或施打疫苗後,抗體的維持時間及記憶性 B 細胞壽命,是評估疫苗保護力,甚至是預測下一次大流行的依據之一。
我們並不知道人體對新型冠狀病毒,產生抗體的時間能維持多久。然而研究告訴我們,2003 年的 SARS 康復者,抗體僅能維持二年。且參考另兩株冠狀病毒(HCoV-OC43 和 HCoV-HKU1),其人體的抗體約維持 40 週 5。也許可大膽的推測,未來即使有疫苗,也將變成每年施打的措施;而因瘟疫(COVID-19)而改變、疏離的社交,未來也將變成常態。
保持冷靜,繼續前進。Keep Calm and Carry On.
參考文獻
- Fang Tang, Yan Quan, Zhong-Tao Xin, Jens Wrammert, Mai-Juan Ma, Hui Lv, Tian-Bao Wang, Hong Yang, Jan H. Richardus, Wei Liu and Wu-Chun Cao (2011) Lack of Peripheral Memory B Cell Responses in Recovered Patients with Severe Acute Respiratory Syndrome: A Six-Year Follow-Up Study. The Journal of Immunology. DOI: https://doi.org/10.4049/jimmunol.0903490
- Wei Liu, Arnaud Fontanet, Pan-He Zhang, Lin Zhan, Zhong-Tao Xin, Laurence Baril, Fang Tang, Hui Lv, and Wu-Chun Cao (2006) Two-Year Prospective Study of the Humoral Immune Response of Patients with Severe Acute Respiratory Syndrome. The Journal of Infectious Diseases. DOI: 10.1086/500469
- Li-Ping Wu, Nai-Chang Wang, Yi-Hua Chang, Xiang-Yi Tian, Dan-Yu Na, Li-Yuan Zhang,* Lei Zheng, Tao Lan, Lin-Fa Wang, Guo-Dong Liang (2007) Duration of Antibody Responses after Severe Acute Respiratory Syndrome. Emerging Infectious Diseases. DOI: 10.3201/eid1310.070576
- Qingqing Lin (2020) Duration of serum neutralizing antibodies for SARS-CoV-2: Lessons from SARS-CoV infection. Journal of Microbiology, Immunology and Infection. DOI: 10.1016/j.jmii.2020.03.015
- Stephen M. Kissler, Christine Tedijanto, Edward Goldstein, Yonatan H. Grad, Marc Lipsitch (2020) Projecting the transmission dynamics of SARS-CoV-2 through the postpandemic period. Science. DOI: 10.1126/science.abb5793