癌症的治療是近幾年醫學研究的一大重點,其中,又以「癌症免疫療法」被視為近幾年的一大突破。關於免疫療法的原理,尤其是免疫檢查點抑制劑(immune checkpoint inhibitor)的原理與優缺點,我們已在上一篇〈免疫療法:讓癌症治療不再傷敵一千自損八百〉有所介紹。接下來本文中要來談談現行實務上,在台灣看得到的相關療法現況,以及未來可能的走向。
台灣已核准上市的免疫檢查點抑制劑有哪些?
截至 2019 年 10 月,台灣衛福部已核准上市的免疫檢查點抑制劑有這三類共六種:
| 類型 | 學名 | 中英文商品名 |
| Anti-PD-1 | Pembrolizumab | 吉舒達,KEYTRUDA |
| Nivolumab | 保疾伏,OPDIVO | |
| Anti-PD-L1 | Atezolizumab | 癌自禦,TECENTRIQ |
| Avelumab | 百穩益,BAVENCIO | |
| Durvalumab | 抑癌寧,IMFINZI | |
| Anti-CTLA-4 | Ipilimumab | 益伏,YERVOY |
以上有很多眼花撩亂的複雜英文名詞,不過概念上其實很簡單:
anti-PD-1 / anti-PD-L1 是同一條免疫檢查點路徑(差異是 anti-PD-1 作用在免疫細胞,anti-PD-L1 在癌細胞);anti-CTLA-4 則是另一條路徑。這些藥物都能夠解開癌細胞對免疫系統的封印,來達到治療癌症的效果。
目前於台灣可應用的癌症種類
接著重點來了,並「不是所有癌症」都被核准使用這些免疫檢查點抑制劑。因為必須先有充份的療效與安全性數據,食藥署才會核准能夠使用的適應症。

這些數據還得仰賴負責研發的藥廠們各顯神通,進行不同癌症的臨床試驗、完成數據累積才能達成。基本上薑是老的辣,推出時間越久的藥品,通常能取得的適應症會越多。
不同免疫檢查點抑制劑的適應症整理於下表,資料截至 2019 年 10 月台灣衛福部的資料(未來可能會陸續增加)。這裡需要多提醒一下,除了符合的「適應症」也就是癌症種類外,目前資料上提及的各種癌症,也都有必須符合的資格條件才能使用,可以詳見文末參考資料中的連結。假如不符合這些資格,就屬於仿單標示外使用(off-label use),需要與醫師充分溝通與討論,作出最適當的治療決策。
| 類型 | 學名 | 適應症(各種癌症有不同的治療資格條件) |
| Anti-PD-1 | Pembrolizumab | 1. 無法切除或轉移性黑色素瘤 2. 晚期非小細胞肺癌 3. 典型何杰金氏淋巴瘤 4. 晚期頭頸部鱗狀細胞癌 5. 晚期泌尿道上皮癌 6. 晚期胃癌 7. 原發性縱膈腔 B 細胞淋巴瘤 8. MSI-H(dMMR)實體腫瘤(含大腸直腸癌) 9. 晚期肝細胞癌 10. 晚期子宮頸癌 |
| Nivolumab | 1. 無法切除或轉移性黑色素瘤 2. 黑色素瘤之輔助治療 3. 晚期非小細胞肺癌 4. 晚期腎細胞癌 5. 晚期頭頸部鱗狀細胞癌 6. 典型何杰金氏淋巴瘤 7. 晚期泌尿道上皮癌 8. 無法切除的晚期或復發性胃癌 9. 晚期肝細胞癌 10. 轉移性 MSI-H(dMMR)大腸直腸癌 |
|
| Anti-PD-L1 | Atezolizumab | 1. 局部晚期或轉移性泌尿道上皮癌 2. 局部晚期或轉移性非小細胞肺癌 3. 晚期三陰性乳癌 |
| Avelumab | 1. 轉移性默克細胞癌(Merkel cell carcinoma) | |
| Durvalumab | 1. 局部晚期或轉移性泌尿道上皮癌 2. 局部晚期非小細胞肺癌 |
|
| Anti-CTLA-4 | Ipilimumab | 1. 無法切除或轉移性黑色素瘤 2. 晚期腎細胞癌 3. 轉移性 MSI-H(dMMR)大腸直腸癌 |
啟用免疫檢查點抑制劑治療的時機?
癌症治療十分複雜,不同癌症或是不同患者之間的差異也很大,因此應該要將免疫檢查點抑制劑這項新方法視為對抗癌症的其中一項武器。越來越多研究也顯示,免疫檢查點抑制劑有機會在第一線治療漸漸展露頭角,效果更勝傳統的化學治療,因此國際的癌症治療指引也隨著這些研究證據而改進,並定義出哪些患者族群較適合在第一線使用。

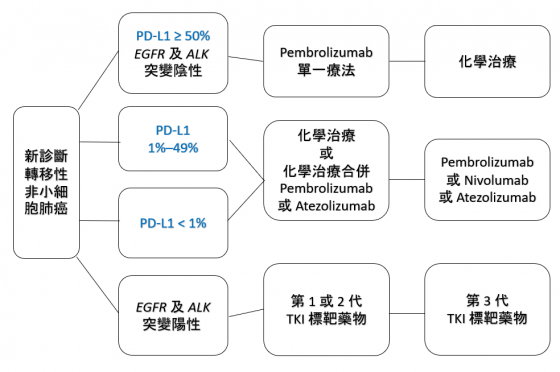
以2019 年最新的歐洲治療指引(ESMO Guidelines)對於「轉移性非小細胞肺癌」的建議為例,在排除一些致癌基因突變的條件後,最重要的是評估「PD-L1 表現量」。假如是 PD-L1 ≥ 50% 第一線治療就適用 anti-PD-1 的 pembrolizumab,但如果低於 50% 以化學治療或是化學治療合併免疫檢查點抑制劑作為第一線較為恰當。
2017 年 ESMO Open 的文獻8與2019 ESMO Guidelines9,其建議的簡易治療流程圖如下,可以更加理解 PD-L1 表現量在此類治療中是影響治療決策的關鍵角色。
貴松松的治療法,健保有哪些給付規定?
台灣健保為了將錢花在刀口上,因此對於所費不貲的免疫檢查點抑制劑有不少給付限制,但這些都是為了找出真的已無藥可治,以及最能獲益於治療的患者族群。截至 2019 年 10 月有給付的藥物只有「atezolizumab、nivolumab、pembrolizumab」這三個,並且也有限制給付的適應症,如下表。
| 給付藥品 | 給付適應症 |
| Atezolizumab | 1. 晚期鱗狀非小細胞肺癌第二線用藥 2. 晚期非小細胞肺腺癌 3. Platinum 類化學治療失敗,有疾病惡化的局部晚期無法切除或轉移性泌尿道上皮癌 4. 無法接受化學治療之轉移性泌尿道上皮癌 |
| Nivolumab | 1. 無法切除或轉移之第三期或第四期黑色素瘤 2. 晚期鱗狀非小細胞肺癌第二線用藥 3. 晚期非小細胞肺腺癌 4. 典型何杰金氏淋巴瘤 5. Platinum 類化學治療失敗,有疾病惡化的局部晚期無法切除或轉移性泌尿道上皮癌 6. 二線(含)以上化學治療均失敗之轉移性胃腺癌 7. 晚期腎細胞癌 8. 晚期或轉移性肝細胞癌 9. 復發或轉移性頭頸部鱗狀細胞癌 |
| Pembrolizumab | 1. 無法切除或轉移之第三期或第四期黑色素瘤 2. 晚期鱗狀非小細胞肺癌第二線用藥 3. 晚期非小細胞肺腺癌第三線用藥 4. 轉移性非小細胞肺癌第一線用藥 5. 典型何杰金氏淋巴瘤 6. Platinum 類化學治療失敗,有疾病惡化的局部晚期無法切除或轉移性泌尿道上皮癌 7. 無法接受化學治療之轉移性泌尿道上皮癌 8. 二線(含)以上化學治療均失敗之轉移性胃腺癌 9. 復發或轉移性頭頸部鱗狀細胞癌 |
除了藥品及適應症的給付限制,患者還得符合以下這三大項條件:
- 無法接受化學治療、標靶治療,或者治療無效的患者
- 體能狀態良好、心肺與肝腎功能等符合數值
- 生物標記符合數值(評估 PD-L1 表現量)
符合條件者,還需要醫院協助申請資格審查(有名額管控),通過審查後才能開始獲得健保給付。此外,用藥後的每三個月,主治醫師須向健保署回報患者的治療反應結果,如果有效才可持續給付(總療程以 52 週為上限);但如果無效或惡化,將停止給付。
這些規定總結來說,即為符合條件、審核通過、且治療有效者,最長可取得約一年的健保給付。
免疫檢查點抑制劑正在研究中的癌症種類
為了擴展免疫檢查點抑制劑的適應症,各大藥廠的相關臨床試驗正在如火如荼的展開,下表列舉台灣已核准之免疫檢查點抑制劑正在進行試驗的癌症種類:
| 類型 | 學名 | 發展中的癌症種類 |
| Anti-PD-1 | Pembrolizumab | 小細胞肺癌、腎細胞癌、鼻咽癌、胸膜間皮瘤、三陰性乳癌、食道癌、多發性骨髓瘤 |
| Nivolumab | 間皮瘤、轉移性亮細胞腎癌 | |
| Anti-PD-L1 | Atezolizumab | 卵巢癌、小細胞肺癌、腎細胞癌、膀胱癌、前列腺癌 |
| Avelumab | 非小細胞肺癌、泌尿道上皮癌、瀰漫性大 B 細胞淋巴瘤、腎細胞癌、胃癌 | |
| Durvalumab | 鱗狀細胞肺癌、頭頸部鱗狀細胞癌、晚期實體惡性腫瘤 | |
| Anti-CTLA-4 | Ipilimumab | 鱗狀細胞肺癌、間皮瘤、胃癌 |
透過免疫檢查點抑制劑的持續研究,相信未來可以造福更多的癌症病患,也感謝免疫檢查點抑制劑帶來了癌症治療的劃時代躍進。
參考資料
- 衛生福利部中央健康保險署,Pembrolizumab 許可證詳細內容
- 衛生福利部中央健康保險署,Nivolumab 許可證詳細內容
- 衛生福利部中央健康保險署,Atezolizumab 許可證詳細內容
- 衛生福利部中央健康保險署,Avelumab 許可證詳細內容
- 衛生福利部中央健康保險署,Durvalumab 許可證詳細內容
- 衛生福利部中央健康保險署,Ipilimumab 許可證詳細內容
- ESMO Clinical Practice Guidelines 2019. Metastatic Non-Small-Cell Lung Cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up.
- Aguiar PN Jr, et al. ESMO Open. 2017;2:e000200. Immune checkpoint inhibitors for advanced non-small cell lung cancer: emerging sequencing for new treatment targets.
- 衛生福利部中央健康保險署,癌症免疫新藥專區
- Darvin P, et al. Exp Mol Med. 2018;50:165. Immune checkpoint inhibitors: recent progress and potential biomarkers.