發現有助於提供癌症與老化的線索
發表意見

本文與 PAMO車禍線上律師 合作,泛科學企劃執行
走在台灣的街頭,你是否發現馬路變得越來越「急躁」?滿街穿梭的外送員、分秒必爭的多元計程車,為了拚單量與獎金,每個人都在跟時間賽跑 。與此同時,拜經濟發展所賜,路上的豪車也變多了 。
這場關於速度與金錢的博弈,讓車禍不再只是一場意外,更是一場複雜的經濟算計。PAMO 車禍線上律師施尚宏律師在接受《思想實驗室 video podcast》訪談時指出,我們正處於一個交通生態的轉折點,當「把車當生財工具」的職業駕駛,撞上了「將車視為珍貴資產」的豪車車主,傳統的理賠邏輯往往會失靈 。
在「停工即停薪」(有跑才有錢,沒跑就沒收入)的零工經濟時代,如果運氣不好遇上車禍,我們該如何證明自己的時間價值?又該如何在保險無法覆蓋的灰色地帶中全身而退?

薪資證明的難題:零工經濟者的「隱形損失」
過去處理車禍理賠,邏輯相對單純:拿出公司的薪資單或扣繳憑單,計算這幾個月的平均薪資,就能算出因傷停工的「薪資損失」。
但在零工經濟時代,這套邏輯卡關了!施尚宏律師指出,許多外送員、自由接案者或是工地打工者,他們的收入往往是領現金,或者分散在多個不同的 App 平台中 。更麻煩的是,零工經濟的特性是「高度變動」,上個月可能拚了 7 萬,這個月休息可能只有 0 元,導致「平均收入」難以定義 。
這時候,律師的角色就不只是法條的背誦者,更像是一名「翻譯」。
施律師解釋「PAMO車禍線上律師的工作是把外送員口中零散的『跑單損失』,轉譯成法官或保險公司聽得懂的法律語言。」 這包括將不同平台(如 Uber、台灣大車隊)的流水帳整合,或是找出過往的接單紀錄來證明當事人的「勞動能力」。即使當下沒有收入(例如學生開學期間),只要能證明過往的接單能力與紀錄,在談判桌上就有籌碼要求合理的「勞動力減損賠償 」。

300 萬張罰單背後的僥倖:你的直覺,正在害死你
根據警政署統計,台灣交通違規的第一名常年是「違規停車」,一年可以開出約 300 萬張罰單 。這龐大的數字背後,藏著兩個台灣駕駛人最容易誤判的「直覺陷阱」。
陷阱 A:我在紅線違停,人還在車上,沒撞到也要負責? 許多人認為:「我人就在車上,車子也沒動,甚至是熄火狀態。結果一台機車為了閃避我,自己操作不當摔倒了,這關我什麼事?」
施律師警告,這是一個致命的陷阱。「人在車上」或「車子沒動」在法律上並不是免死金牌 。法律看重的是「因果關係」。只要你的違停行為阻礙了視線或壓縮了車道,導致後方車輛必須閃避而發生事故,你就可能必須背負民事賠償責任,甚至揹上「過失傷害」的刑責 。
數據會說話: 台灣每年約有 700 件車禍是直接因違規停車導致的 。這 300 萬張罰單背後的僥倖心態,其巨大的代價可能是人命。
陷阱 B:變換車道沒擦撞,對方自己嚇到摔車也算我的? 另一個常年霸榜的肇事原因是「變換車道不當」 。如果你切換車道時,後方騎士因為嚇到而摔車,但你感覺車身「沒震動、沒碰撞」,能不能直接開走?
答案是:絕對不行。
施律師強調,車禍不以「碰撞」為前提 。只要你的駕駛行為與對方的事故有因果關係,你若直接離開現場,在法律上就構成了「肇事逃逸」。這是一條公訴罪,後果遠比你想像的嚴重。正確的做法永遠是:停下來報警,釐清責任,並保留行車記錄器自保 。

保險不夠賠?豪車時代的「超額算計」
另一個現代駕駛的惡夢,是撞到豪車。這不僅是因為修車費貴,更因為衍生出的「代步費用」驚人。
施律師舉例,過去撞到車,只要把車修好就沒事。但現在如果撞到一台 BMW 320,車主可能會主張修車的 8 天期間,他需要租一台同等級的 BMW 320 來代步 。以一天租金 4000 元計算,光是代步費就多了 3 萬多塊 。這時候,一般人會發現「全險」竟然不夠用。為什麼?
因為保險公司承擔的是「合理的賠償責任」,他們有內部的數據庫,只願意賠償一般行情的修車費或代步費 。但對方車主可能不這麼想,為了拿到這筆額外的錢,對方可能會採取「以刑逼民」的策略:提告過失傷害,利用刑事訴訟的壓力(背上前科的恐懼),迫使你自掏腰包補足保險公司不願賠償的差額 。
這就是為什麼在全險之外,駕駛人仍需要懂得談判策略,或考慮尋求律師協助,在保險公司與對方的漫天喊價之間,找到一個停損點 。
談判桌的最佳姿態:「溫柔而堅定」最有效?
除了有單據的財損,車禍中最難談判的往往是「精神慰撫金」。施律師直言,這在法律上沒有公式,甚至有點像「開獎」,高度依賴法官的自由心證 。
雖然保險公司內部有一套簡單的算法(例如醫療費用的 2 到 5 倍),但到了法院,法官會考量雙方的社會地位、傷勢嚴重程度 。在缺乏標準公式的情況下,正確的「態度」能幫您起到加分效果。
施律師建議,在談判桌上最好的姿態是「溫柔而堅定」。有些人會試圖「扮窮」或「裝兇」,這通常會有反效果。特別是面對看過無數案件的保險理賠員,裝兇只會讓對方心裡想著:「進了法院我保證你一毛都拿不到,準備看你笑話」。
相反地,如果你能客氣地溝通,但手中握有完整的接單紀錄、醫療單據,清楚知道自己的底線與權益,這種「堅定」反而能讓談判對手買單,甚至在證明不足的情況下(如外送員的開學期間收入),更願意採信你的主張 。
車禍不只是一場意外,它是認知、情緒、金錢與法律邏輯的總和 。
在這個交通環境日益複雜的時代,無論你是為了生計奔波的職業駕駛,還是天天上路的通勤族,光靠保險或許已經不夠。大部分的車禍其實都是小案子,可能只是賠償 2000 元的輕微擦撞,或是責任不明的糾紛。為了這點錢,要花幾萬塊請律師打官司絕對「不划算」。但當事人往往會因為資訊落差,恐懼於「會不會被告肇逃?」、「會不會留案底?」、「賠償多少才合理?」而整夜睡不著覺 。
PAMO看準了這個「焦慮商機」, 推出了一種顛覆傳統的解決方案——「年費 1200 元的訂閱制法律服務 」。
這就像是「法律界的 Netflix」或「汽車強制險」的概念。PAMO 的核心邏輯不是「代打」,而是「賦能」。不同於傳統律師收費高昂,PAMO 提倡的是「大腦武裝」,當車禍發生時,線上律師團提供策略,教你怎麼做筆錄、怎麼蒐證、怎麼判斷對方開價合不合理等。
施律師表示,他們的目標是讓客戶在面對不確定的風險時,背後有個軍師,能安心地睡個好覺 。平時保留好收入證明、發生事故時懂得不亂說話、與各方談判時掌握對應策略 。

從違停的陷阱到訂閱制的解方,我們正處於交通與法律的轉型期。未來,挑戰將更加嚴峻。
當 AI 與自駕車(Level 4/5)真正上路,一旦發生事故,責任主體將從「駕駛人」轉向「車廠」或「演算法系統」 。屆時,誰該負責?怎麼舉證?
但在那天來臨之前,面對馬路上的豪車、零工騎士與法律陷阱,你選擇相信運氣,還是相信策略? 先「武裝好自己的大腦」,或許才是現代駕駛人最明智的保險。
PAMO車禍線上律師官網:https://pse.is/8juv6k
發表意見

討論功能關閉中。
本文轉載自顯微觀點
許多癌症患者在初期對藥物反應良好,腫瘤明顯縮小,但經過一段時間後因為癌細胞會適應治療,例如可能改變藥物的目標分子,使藥物無法再有效作用;或是繞過原本被切斷的「生存」路徑,變得對藥物不再敏感,使得原本的化療、標靶藥物失效。因此癌症治療的一大挑戰「抗藥性」。
為了解決這項難題,臨床治療上有些使用「雞尾酒療法」,也就是同時使用多種藥物攻擊癌細胞的不同弱點;有的則是積極開發新一代藥物,針對已知的抗藥性機制設計不同路徑;或是透過改變腫瘤微環境讓患者產生持久的免疫反應,延緩或克服抗藥性產生。
但癌症逐漸走向精準醫療,藥物是否能夠針對特定癌細胞甚至癌細胞的特定機轉、基因產生作用,是醫療界正努力研究的方向。而從中國醫藥大學生命科學院細胞生物學研究所助理教授徐昭業的觀點,細胞機械力便是一個可以切入的研究窗口。
微小機械力 左右細胞表現力
過去,生物學多注重在基因、化學對對細胞的影響,而力學生物學(或稱機械生物學,Mechanobiology)則在近二十年迅速興起。因為科學家發現,不論是細胞要維持形狀、移動,或是回應微環境的變化,都受到力學影響。
徐昭業解釋,其實細胞的機械力在生命活動中非常重要,例如大多數細胞都需要貼附在周圍的環境中,無論是與其他細胞形成組織,或是與細胞外基質(ECM, Extracellular Matrix)連結。而這個「貼附」的行為就是一種機械力的展現。
另外,當細胞在分化時,機械力的影響尤其顯著。例如,將幹細胞培養在柔軟如果凍的基材上時,它們傾向分化為脂肪細胞或神經細胞。然而若是培養在像桌子一樣硬的表面時,則更可能分化為骨細胞。這顯示細胞對外在物理環境具有高度的「機械感知」能力。
這些細胞從外部環境(例如黏附表面、周遭組織)感受到的「機械訊號」,會透過細胞膜上的蛋白傳遞進入細胞內部,影響基因表達並調整行為,例如分化或增生。
傳統上判定癌症藥效(或是是否出現抗藥性)多是透過測量細胞存活率,例如計算 IC50(半數抑制濃度)──也就是殺死 50% 細胞所需的藥物濃度。但徐昭業表示,這樣的測量方式存在著「非死即活」的二分法限制。例如:針對 100 顆細胞投藥,最後存活 50 顆,只知道存活率是 50%,但無法得知那剩下細胞的實際狀態;可能完全健康、也可能受到藥物影響變得半死不活。
不只管死活 力學訊號看抗藥性更精準

透過細胞機械力的偵測則可以彌補這樣的空缺。徐昭業和研究團隊開發出一套生物力學量測系統,結合微結構與光學反射,成功簡化細胞力學的觀察與量化方式。
他們將細胞培養於表面覆有密集奈米圓柱的結構裝置上,當細胞貼附並施力於這些奈米圓柱時會導致彎曲,進而改變表面反射鏡的反射角度,影響光訊號的強度。藉由觀察反射光的衰減量,便可快速推估細胞的力學變化。
這些奈米圓柱通常使用 PDMS(polydimethylsiloxane,聚二甲基矽氧烷)等彈性材料製成,直徑約為1至2微米,高度約 5 微米,排列間距也僅有 1 至 2 微米。
徐昭業表示,過去這類「micropost array」(微柱陣列)主要透過螢光標記位移來計算細胞所施加的力量,但這樣一來不但需要仰賴高倍率顯微鏡,影像分析也較為繁複。
因此,研究團隊改以反射訊號的變化來替代位移量測。他們將金屬反射層鍍於奈米圓柱頂端形成靈敏的反射面。當細胞攤開在表面時,張力會造成圓柱微幅形變,反射光因此產生角度偏移與散射。通常光強度會下降至原始強度的 20% 至 30%,藉此就能反推出細胞所施加的實際力值,依此分析細胞活力。不僅能大幅簡化操作流程,同時提升訊號讀取的效率與數量。
徐昭業說,當細胞死亡或停止活動時,力學(光學)訊號會完全消失,但「活力下降」的細胞則有部分訊號,但弱於「完全未受影響」的細胞。而這樣分群概念在癌症抗藥性研究的重要性在於:即使多數癌細胞對藥物反應良好,仍可能潛伏少數「對藥無感」或「苟延殘喘」的細胞。這些細胞若存活下來,將來就可能演化出抗藥性的癌細胞。
為了驗證設計出的平台在癌細胞檢測上有效果,徐昭業也和中國醫藥大學從事肺癌研究的老師合作,利用對方既有現成的抗藥性細胞株資料庫和相對應生物標記,與力學檢測平台的標記結合進行確認。
徐昭業表示,過去要確認癌細胞是否出現抗藥性需透過長時間持續給藥,並耗費三至六個月時間培養,看細胞是否出現變異。但一方面長時間持續投藥,訓練出的是「後天抗藥性」癌細胞,和在真實情境不同;人體中可能部分癌細胞一開始就有「先天抗藥性」,卻難以在一開始就揪出來。另一方面,長期、持續的投藥也不符合臨床投藥方式,且耗時過長。
團隊利用力學檢測平台比較抗藥細胞與敏感細胞,發現兩者之間存在顯著差異,且這些力學特徵與既有的生物標記完全對應,證明了這個檢測系統可以直接辨識抗藥性細胞。
研究到臨床 盼打造癌症抗藥性快篩
由於系統採用的是非螢光染色(label-free)設計,偵測的是光學訊號,大幅縮短樣本製備和觀察時間。一片約一平方公分的生物晶片能同時觀測十萬個細胞,儘管有些細胞會彼此黏連,無法進行單細胞分析,但通常仍能取得五萬筆單細胞的力學分布資料。團隊再把這些數據輸入AI模型進行辨識訓練,系統便能在活細胞上快速量測,約半天到一天即可完成分析。
徐昭業表示,癌症病人通常有幾種可選用的藥物,但每個人對藥物的反應不同,第一線有效的藥物不見得適合所有病人。臨床上,醫師通常根據經驗與基因表現推估藥物敏感性,仍難以預測抗藥性的發生;即使用單細胞基因定序也很昂貴且不容易操作。
「雖然一開始仍需仰賴傳統細胞株去建立模型,但當這一系列流程建構完成,後續就能成為精準醫療的重要輔助工具」,徐昭業說,若是透過此平台,就能以「快篩」的概念檢驗不同病人檢體暴露於不同藥物,哪些藥物最容易產生抗藥性表現型(phenotype),進而提供臨床醫師一份建議清單,選擇不易產生抗藥性、最合適的治療策略。
目前團隊也致力於讓系統更具備高度規律性與可重複性,並易於製作母模再複製,以大幅降低成本與技術門檻。徐昭業期待這套系統除了加速細胞力學研究的量測過程,也能為生醫材料、藥物開發與細胞品質檢測等領域提供實用的解決方案。
參考資料:
- 為什麼癌症治療會出現抗藥性?看懂 6 種抗藥性機轉
- Why Do Cancer Treatments Stop Working? Overcoming Treatment Resistance
- 漫談力學生物學
延伸閱讀:
發表意見

討論功能關閉中。
本文轉載自顯微觀點
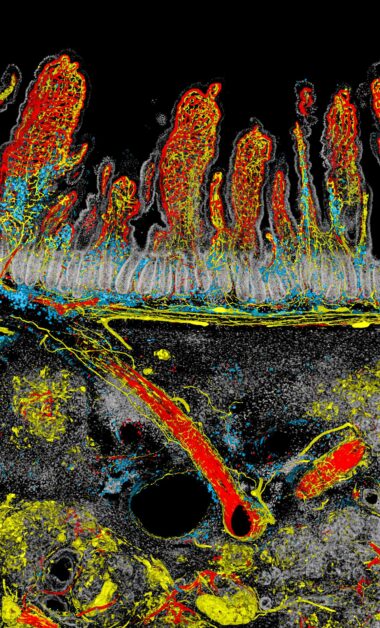
畫面中以腫瘤與腸道的交界處作為分割,上方為十二指腸的腸絨毛血管和神經網絡,下方則是侵襲的胰臟癌腫瘤,呈現出生命與疾病在邊界對峙的氛圍
連2024台灣顯微攝影競賽評審都忍不住讚嘆:「影像具有魄力與情緒渲染力,讓人直觀感受到人體對抗癌症的不適和緊張。」
這幅「劍拔弩張」的影像由中研院基因體中心的博士後研究員簡宏任所拍攝。他目前的研究主題之一為探討胰臟癌的漸進發病過程中,出現的病變(lesion)和微環境變化。
他提到拍攝這張影像契機是當時正在做腫瘤轉移的試驗,正巧收到這個小鼠胰臟樣本。
「那隻老鼠的胰臟腫瘤剛好長在十二指腸的旁邊」,簡宏任表示,胰臟有很多神經,而胰臟癌特別之處在於腫瘤長大後,神經也會跟著長進去。
「但腫瘤中的神經從哪裡來?是從胰臟裡面自己長進去,還是從旁邊的器官?以概念上來說,你各自的器官神經理論上應該不會交錯吧!」但過去很少有人做過這樣的觀察和研究,而透過顯微鏡的觀察,發現神經從十二指腸的肌肉層,沿著血管長到胰臟腫瘤裡面。
「下面這是腫瘤範圍,神經會長進去耶!這還滿神奇的」,簡宏任一邊對著影像比劃,一邊興奮地分享研究發現。
胰臟癌很難治療的原因之一是腫瘤中沒有或是很少具有免疫細胞浸潤,即無免疫源性的腫瘤-「冷」腫瘤。但從影像中看到標記成藍色的免疫細胞順著血管和神經的網路進到腫瘤生長區域。「可見免疫細胞其實是可以進去的,但是為何這些免疫細胞無法發揮殺死癌細胞的作用或是僅駐留在腫瘤中的局部位置」,簡宏任坦言目前還沒有答案。
雖然對於免疫細胞和癌症之間的作用尚無明確解答,但影像的呈現仍然多少解開過去對於神經、血管和腫瘤之間如何交錯的疑惑。簡宏任表示,這都得歸功於3D組織學技術的發展。
器官很大病變很小 從2D走向3D找目標
胰臟癌又稱為「癌王」,因為癌症初期病人沒有任何不適,加上胰臟在腹腔深處,難以用超音波早期發現癌症病變,等到壓迫到其他器官出現腹痛、胃口差等症狀,腫瘤都已長得很大或是出現轉移,惡化速度快。
簡宏任研究的一部分就是觀察癌前病變的病理樣態。
胰臟很重要的功能分為內分泌和外分泌。內分泌為分泌胰島素調解血糖,外分泌則是分泌胰液含有多種消化酵素,進行醣類、蛋白質、和脂肪的消化作用。
簡宏任表示,胰臟腺泡細胞分泌的消化液需要透過導管結構送到消化系統,而研究發現這種導管結構可能會出現癌前病變,這些病變稱為胰臟上皮內瘤樣病變(pancreatic intraepithelial neoplasia, PanIN)。而PanIN也可能會由胰腺泡到導管化生(acinar-to-ductal metaplasia, ADM)發展而來。病變的進展是多重步驟的過程,除了病變細胞本身基因層面的改變之外,外在的微環境也會影響這些PanIN的發育。
因為胰臟組織裡細胞種類眾多,不同種類細胞的組成可能塑造出適合病變成長的環境;雖然這些病變並不一定最後都會走向癌症。而他所待的胡春美老師研究室,就在關注病變過程微環境的變化。
另一方面,胰臟癌難以早期發現,通常是轉移到肝臟,發現肝臟腫瘤後才回頭找出胰臟腫瘤。而發生遠端轉移之前,從原位胰臟腫瘤脫離的細胞團可能在血液中循環,這些細胞團被稱為循環腫瘤細胞簇(Circulating tumor microemboli, CTM)。
簡宏任另一部分的研究重心便是放在這些循環腫瘤細胞簇的特徵及其是否有喜歡的微環境,藉以找出可能的轉移熱點,以更好地了解癌症轉移並尋找治療的契機。
然而微環境「長成什麼樣子」,難以用一般分子生物的技術觀察,必須整合病理學的技術來「看見」其真實的樣態。
「但問題又來了,要怎麼找到這些小小的、開始發生病變的位置?」簡宏任說,在模式小鼠中,胰臟病變的平均直徑僅約100至200微米(µm,micrometer),以老鼠胰臟2公分乘以1.5公分的面積、厚度0.5公分來看,一個病變保守估計可能只佔胰臟體積的十萬分之一到百萬分之一。
過去受限於常規組織學技術的切片方法,研究者只能製備厚度3到5微米左右的樣本,以觀察組織薄片上二維(2D)空間的訊息。而且切片過程不僅得破壞樣本,對於無法明確知道起始位置、難以定位的目標來說,也無法準確擷取到想要的影像。
但是組織透明化技術允許研究者在不切片或是增加切片厚度的方式下製備出「厚」樣本,如此一來樣本就能保有立體的三維(3D)空間訊息。使用3D組織學技術便可以看到整體結構,再去找尋「不一樣」、「可能是病變」的部位加以觀察、分析。
簡宏任表示,3D組織學技術對於觀察隨機分布或是網狀、網路性質的結構特別有利。
組織透明化技術
使用光學系統觀察生物組織時,常會面臨因為光散色(light scatter )的問題,觀察深層樣本時會因為難以對焦而模糊。就算使用連續薄切片再3D重建,不僅耗時費力也常發生影像對位不易或是資訊不連續的問題。組織透明化技術則是將組織內部不同構成物質的折射率趨近一致化,將組織呈現出透明的效果。
不過3D組織學技術並不是這麼簡單,其中組織透明化是十分關鍵的步驟。2010年代初期第一代透明化技術出世後,應用這項技術的研究開始變得熱門,但主要都是以大腦為研究主體並加以改良。然而像是胰臟或是其他器官,當時應用此技術的研究較少且製備高品質樣本的過程充滿挑戰。
簡宏任提到,以胰臟為例,製備透明胰臟樣本的難處在於,作為消化器官的胰臟本身會分泌消化液。當實驗進行,老鼠一犧牲,血液停止循環時,那些消化液就「停留在原地,開始消化牠自己」。一旦前置處理不理想,看到有點缺損的器官就無法判定是已經發生病變,還是被消化液破壞,影響後續的影像品質。
除了胰臟外,肝臟也是不易製備出透明化樣本的器官之一。因肝臟受到膽紅素(Bilirubin)影響而有顏色,這些色素一方面會阻擋雷射激發組織內的標定結構,也會限制激發出的螢光訊號回到偵測器。如何漂白可以達到透明化效果又不會去除掉標定的抗原,便成為一大學問。因此,透明化技術必須對應不同器官建立合適的前處理流程以提升樣本品質。
前處理之外,折射率也是需要考量的因素,簡宏任碩博班期間的指導教授湯學成提出將組織「固化」的想法。
「90%以上的透明化技術最後都處在溶劑中漂浮的狀態,雖然可以從四面八方觀察,但折射率固態大於液態,液態大於氣態。若能把折射率提升,透明度更好便能看到更多資訊」,湯學成教授的團隊反覆試驗後研發出可同時將生物樣本透明化與固化的技術。
由於光在不同介質中的因不同折射率導致光的散射。他們依據流體折射率與密度之間所滿足的Gladstone-Dale關係式,以高折射率的高n丙烯醯胺共聚物(high-n acrylamide-based copolymer)來填充組織的空隙,使折射率一致,達到透明化目的。
再進一步用紫外光(UV)照射成為固態高密度共聚物,提高折射率並成為穩定的透明樣本。
這樣的透明化技術相較過去,不僅克服組織放在溶劑裡攜帶不易、蒸發等問題,在實驗過程中也發現固體透明組織具有抗螢光淬滅(antifade)的特性。
由於使用共軛焦顯微鏡觀測時,需要使用雷射激發抗體螢光,如果照射多次可能因為螢光強度衰減而漸漸觀測不到訊號。
但是湯學成教授團隊所開發的固態透明化技術,儘管進行500次雷射掃描,螢光訊號僅下降9% ± 2%;相比其他液態透明化技術的樣本下降幅度在55%至95%,可說是非常穩定,適合長時間、多次成像。
「當別人對研究存疑時,以往只能就影片或是拍好的圖片討論,但有了這個材料,就可以將樣本直接寄給對方」,除了上述的優勢,簡宏任認為新材料還能促進學術交流。

點滿技能樹 喜獲銀獎
不過,組織透明化後雖能更加輕易找到病變位置,但拍攝「有拍照」跟「拍好照」是天差地遠的事。
「既然已經花了那麼多的精力、資源,做了這麼好的片子(樣本),那你要怎麼吸引『觀眾』(論文審查者、同儕),讓人家覺得研究、看到的東西,有那麼重要?」簡宏任認為安排顏色對比、構圖,以突顯影像中的重點是非常關鍵的。
以「對峙」這幅作品來看,簡宏任解釋,他通常將畫面面積最大的部分以白或灰等顏色處理,因此佔據畫面最大的腸道細胞以白色呈現並降低對比。至於神經與血管是他想強調的部分,便用較亮的紅、黃等色系,尤其大部分的人直覺認為血管是紅色,因此血管套上紅色,神經便給予黃色標示。免疫細胞則選擇藍色,在紅、黃色當中得以突顯,也避免以為是組織間交疊出的疊加色。紅、黃與藍的選色也應用了消減型的三原色(subtractive mixing color model)的概念,以不交疊的原色(primary color)凸顯不同結構的特色。
對於顏色、構圖呈現的敏銳度,也源自簡宏任過去的學經歷。簡宏任並非一開始就走上研究之路。國中畢業後選擇高職就讀的他,選修科目的平面設計與視覺藝術奠定了他美學的基礎;但在學術學程的課程中,他也發現自己對生物也挺感興趣,因此大學選擇分子生物暨人類遺傳學系就讀。
只是相較於「看不見」的分子生物,簡宏任更喜歡「看得見」的生物(顯微)影像。投身固態組織透明化技術的研究後,當中有些需要用到紫外光等儀器設備,也因為簡宏任高職時曾參加微控制相關的社團,喜歡動手操作,因此可以自己架設一些小型機台。
簡宏任笑說:「這次得獎算是把過去學的技能串在一起,技能樹剛好都點滿。」不過他也謙稱,得獎是運氣,在作品展看到其他人的作品時,可以看到不同技術在製備上也都有其厲害之處;銀獎抑或優選還是看評審的選擇,只能把自己最好的部分拿出來展現。

固化過程若是讓液態慢慢凝固,一方面時間漫長,另一方面容易出現不均勻的問題。因此簡宏任索性運用過去社團習得的技術,自行動手製作「固化系統」。從選擇適合波長的紫外線光源和照射時間,以避免蛋白質變性或是氣泡跑進透明化樣本,到組裝焊接,簡宏任全都自己來。
發表意見

討論功能關閉中。