海邊戲水要小心!一次帶你認識刺毒魚類,與被刺傷後的自救方法
刺毒魚類是什麼?有刺的魚 ≠ 刺毒魚類
海洋是生命的發源地,其環境複雜多樣,孕育出多種多樣的海洋生物。在漫長的演化過程魚類發展出多樣適應環境的機制,包括物理性、化學性及生物性的調適,其中刺毒(venoms) 屬於較為複雜的化學性防禦機制。
然而具有尖刺的魚類就等於是刺毒魚類嗎?答案是「否」的。
刺毒魚類的硬棘上附有毒腺,除了能為掠食者帶來物理性(刺傷)傷害以外,並會造成化學性(毒液)的二次傷害,毒腺所分泌的毒液會使傷口產生更為強烈的疼痛感,是一種特殊的防禦機制。
可能比你想像中多:世界上的刺毒魚類有多少?
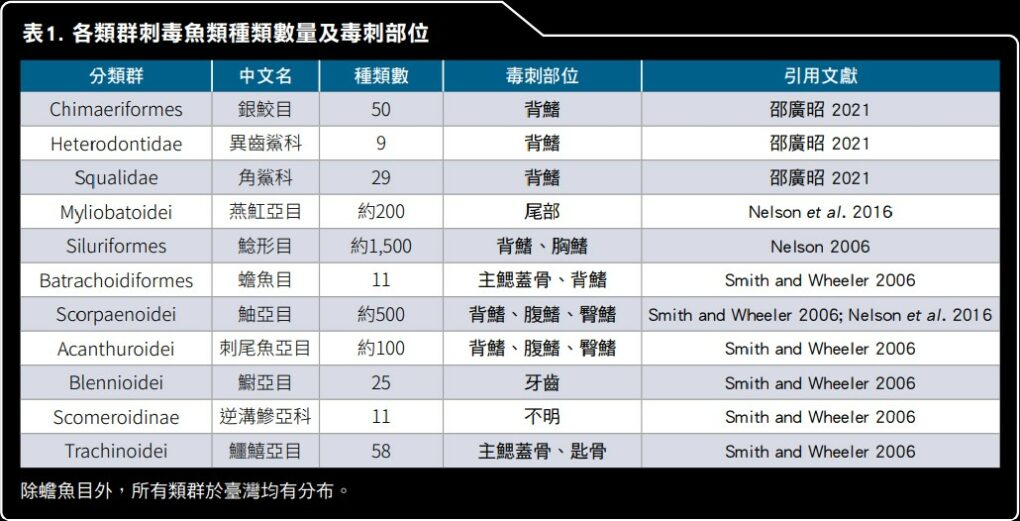
全世界的魚類約有 30,000 多種,曾被報導過的刺毒魚類約有 2,500 多種(表 1),約占所有魚類的 8%,其主要可分為四大類,分別為:
(一)軟骨魚類中的銀鮫目(Chimaeriformes)、異齒鯊科(Heterodontidae)、角鯊科(Squalidae)
(二)軟骨魚類中的燕魟亞目(Myliobatoidei)
(三)硬骨魚類中的鯰形目(Siluriformes)
(四)硬骨魚類中的鰭棘魚類(Acanthomorphs)(Smith and Wheeler 2006;邵廣昭 2021)。
表 1 各類群刺毒魚類種類數量及毒刺部位。表/自然保育季刊 第一類刺毒軟骨魚類 的毒刺主要分布於背鰭上,數量 1 至 2 根。
第二類 為魟類 ,現生種類約 200 多種,毒刺分布於尾柄上(Nelson et al. 2016),當其尾柄上的毒刺擊中掠食者後,毒液會經由外皮鞘(integumentary sheath)的破壞而全數釋出(Fenner 2004)。著名的電視節目主持人鱷魚先生 Steve Irwin 就是被大型魟類尾部的毒刺傷及心臟而喪命的。
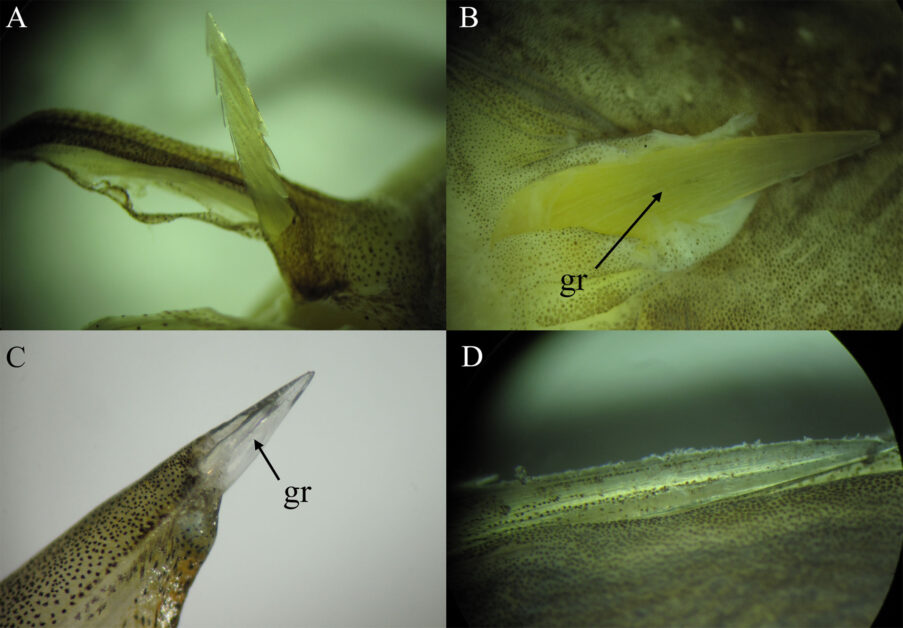
黑線銀鮫(Chimaera phantasma)。箭頭標示處為其毒刺。圖/自然保育季刊 第三類 為鯰形目魚類 ,大多為淡水種類,其中有毒的種類大約為 1,500 種,毒刺分布於胸鰭及背鰭(Wright 2009),其毒刺外緣具鋸齒(圖 1A)。
鯰形目魚類在美洲具較高的多樣性,占所有種類的 60%(Nelson 2006)。臺灣產12種,淡水的種類有鈍頭鮠科(Amblycipitidae)1 種、鯰科(Siluridae)1 種、鬍鯰科(Clariidae)2 種、鱨科(Bagridae)2 種,鱨科的種類因背鰭(1 根毒刺)、胸鰭(2 根毒刺)具毒刺,故俗稱為三角姑;
海水的種類有鰻鯰科(Plotosidae)1 種,及海鯰科(Ariidae)5 種,兩者的俗稱分別為沙毛及成仔丁,毒刺的位置與鱨科一致。
圖 1 刺毒魚類毒刺形態之一。圖/自然保育季刊 A. 線紋鰻鯰(Plotosus lineatus)胸鰭硬棘。 B. 瞻星魚(Uranoscopus sp.)匙骨上的棘。C. 褐臭肚魚(Siganus fuscescens)背鰭硬棘。 D. 托爾逆鈎鰺(Scomberoides tol)背鰭硬棘。縮寫:gr,groove 溝槽。
第四類 為鰭棘魚類 ,由六個類群所組成,分別為蟾魚目(Batrachoidiformes)、鮋亞目(Scorpaenoidei)、刺尾魚亞目(Acanthuroidei)、䲁亞目(Blennioidei)、逆溝鰺亞科(Scomeroidinae)及鱷亞目(Trachinoidei),雖然僅有 585 至 650 種,但相對於前面的三個大類群,毒刺的形態則顯得更為多樣化,毒腺可發現於牙齒、主鰓蓋骨(opercle)、匙骨(cleithrum) (圖 1B)、背鰭、腹鰭和臀鰭多個部位(Smith and Wheeler 2006)。
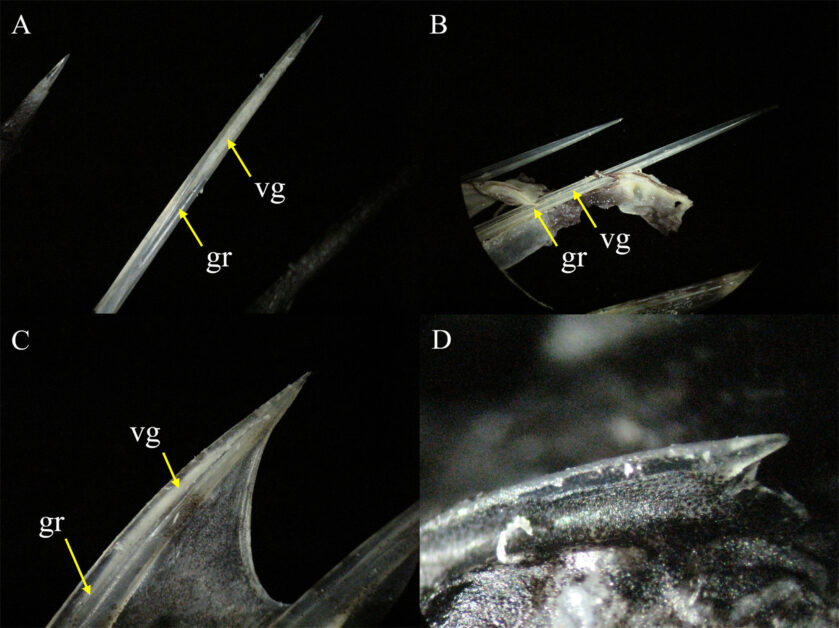
圖 2 刺毒魚類毒刺形態之二。圖/自然保育季刊 A. 中華鬼鮋(Inimicus sinensis )背鰭硬棘。 B. 魔鬼簑鮋(Pterois volitans )背鰭硬棘。C. 眉鬚鱗頭鮋(Sebastapistes strongia)背鰭硬棘。 D. 眉鬚鱗頭鮋頭部的棘。縮寫:gr, groove 溝槽;vg, venom gland 毒腺。
雙斑櫛齒刺尾鯛(Ctenochaetus binotatus)。圖/自然保育季刊 臺語有云:「一魟、二虎、三沙毛」
在海岸活動頻繁的臺灣,亦不乏關於刺毒魚類的諺語:一魟、二虎、三沙毛、四斑五、五象耳、六倒吊,或者是四臭肚、五變身苦;四變身苦、五成仔丁。
不管何種版本,「魟、虎、沙毛」均是刺毒危險程度的前三名。
線紋刺尾鯛(Acanthurus lineatus)。圖/自然保育季刊 線紋鰻鯰(Plotosus lineatus)。箭頭標示處為其毒刺。圖/自然保育季刊 諺語中的魟 ,是泛指所有尾部具有毒刺結構的燕魟亞目魚類,身體呈圓盤形,大部分種類尾巴為細長的鞭狀,依不同種類尾部毒刺的數量可達 2 根或以上,大部分漁民在捕獲後,均會把尾部的毒刺去除。多數的魟類為底棲性魚類,部分種類更具潛藏於沙中的習性,因此在沙灘嬉水遊玩時,須多加注意腳下情況以免誤踩而被其刺傷。
沙毛 指的是線紋鰻鯰(Plotosus lineatus),廣泛分布於臺灣沿海並常被釣獲,其體表光滑無鱗不易被抓住,故處理時須多加注意以免被刺傷;其幼魚常成聚集成群,被稱為鯰球。
黑帶稀棘䲁(Meiacanthus grammiste)。其毒腺位於下頜兩顆大型犬齒中。圖/自然保育季刊 二虎:多樣性豐富的刺毒魚類大家族
虎魚 泛指臺灣產鮋亞目(Scorpaenoidei)的種類,其英文俗名有 scorpionfishes、stonefishes 、 waspfishes 等,有關 scorpionfishes 名稱的由來,或許命名者對其毒刺如蝎子螫到的觸感有著很深刻的體會。
除了虎魚這俗名外,石狗公、石頭魚亦為牠們常見的中文俗稱,因其偽裝(camouflage,一些種類會利用特化的皮瓣偽裝成礁石及表面的生物)或保護色,致使體態、體色與棲地環境極為相似而得名。
該類群是著名且危險的刺毒魚類,毒刺十分發達(圖 2),雖然鮋亞目魚類的頭部具有不少的棘(圖 2D),但具毒腺的部位僅為背鰭、腹鰭及臀鰭之硬棘(圖 2A-C) (Nelson et al. 2016),為海洋刺毒魚類的最大宗(Low et al. 1993;Church and Hodgson 2002;Vetrano et al. 2002;Fenner 2004),臺灣大約有 42 屬 100種(邵廣昭 2021)。
多數種類為底棲性魚類,棲息於沿海岩礁地形,行動緩慢並常靜止於礁石上,即使靠近之亦不動如山,其體色與環境十分相似不易被察覺,因此在潮間帶或岩礁海岸活動時,稍一不慎則有可能誤踩而遭其刺傷。目前被刺傷的個案僅國外有報導,被刺傷者大部分為漁業從事人員(Haddad et al. 2003),臺灣雖暫無相關學術文章報導,但大部分地區的海洋活動亦相對頻繁,相信有不少被刺傷的個案。
金圓鱗鮋(Parascorpaena aurita)。鮋科魚類多具備良好的偽裝能力,其體色與周遭環境融為一體。圖/自然保育季刊 鮋亞目魚類毒素均為蛋白質(Kiriake et al. 2013),結構並不穩定,遇熱後因蛋白質變性而失去毒性(伍漢霖 2006),亦有研究顯示斑點鮋(Scorpaena guttata)的毒素在 50°C 的條件下處理,短期內即失去活性(Schaeffer et al. 1971),表示魚肉在加熱煮熟後可食用。
俗稱獅子魚(Lionfish, Turkeyfish)的危險刺毒魚類亦同屬於鮋亞目家族的成員(簑鮋類 Pteroini),但與石狗公、石頭魚的不同之處在於其十分花枝招展的外觀,平常毫不躲藏、並徐徐地遊弋於礁石間。
因其華麗的外觀而常見於觀賞魚市場,亦因此經由水族觀賞魚途徑被棄養放生(Hamner et al. 2007;Betancur et al. 2011;Johnson et al. 2016),魔鬼簑鮋(Pterois volitans)自 1980 年起現踪於佛羅里達(Florida) (Freshwater et al. 2009),延長及發達的毒刺使其在當地幾乎沒有天敵,並逐漸擴張遍布整個大西洋西岸形成穩定的族群 (Betancur et al. 2011;Ferreira et al. 2015;Johnson et al. 2016),而其驚人的食量對當地魚類族群造成極大的威脅,與另一種獅子魚—斑鰭簑鮋(P. miles)為知名的入侵物種。
毒擬鮋(Scorpaenopsis diabolus)。具備良好偽裝能力的鮋科魚類之一,喜靜止於礁石上伺機捕食路過之獵物。圖/自然保育季刊 毒刺的部位、結構及釋出毒液的機制
刺毒魚類的毒刺結構可發現於胸鰭、腹鰭、背鰭、臀鰭、尾柄、牙齒、主鰓蓋骨、肩帶上的匙骨等部位。大部分毒刺均由硬棘(spine)、溝槽(groove)及毒腺(venom gland)所組成。刺毒魚類這類用毒動物不同於河魨,其毒素由自體產生(河魨毒素由食物累積於體內),經毒腺分泌,藉由硬棘導引或注射到防禦對象身上(Bulaj et al. 2003;Fenner 2004;Smith and Wheeler 2006)。
毒腺附著於硬棘上,硬棘具溝槽。毒液的釋放是一種被動形式,並不能主動發射,當毒腺受壓迫時,毒液釋出並沿著溝槽導流至防禦對象的傷口上。被刺後傷口附近立刻產生劇烈疼痛感,隨後延伸擴散,會伴隨噁心、嘔吐、呼吸困難等症狀 (伍漢霖 2006)。疼痛感可持續數小時之久,過敏體質者更會休克、甚至死亡。
波氏擬鮋(Scorpaenopsis possi)。具備良好偽裝能力的鮋科魚類之一,體表具備海藻狀之皮瓣。圖/自然保育季刊 如何預防刺傷,刺傷後應該如何處理?
刺毒魚類並不會主動利用毒刺進行攻擊,因此進行海岸活動或沿海作業時,應注意隨時週遭環境並穿戴相關保護措施(如手套、涉水鞋等)避免身體裸露、降低被刺傷的機會;若在必要情況下須接觸具尖刺且種類不明的魚類時,應避免徒手直接捕捉並藉由工具謹慎處理之。
刺毒魚類另一個對人類造成危害的地方,在於其造成的傷口可能會因為細菌感染而產生二次傷害,嚴重者會導致局部組織壞死、敗血症,甚至感染創傷弧菌(Vibrio vulnificus),而創傷弧菌感染後惡化快速,其所引致的併發症通常具較高的死亡率。
輻紋簑鮋(Pterois radiata)。獅子魚在遭遇威脅時,胸鰭及背鰭會展開,並以腹部朝著礁石、背部朝外的方式抵禦掠食者。圖/自然保育季刊 刺毒魚類的毒性依種類及釋放量而有所不同,而毒素主要為蛋白質,其結構不穩定,易受熱、酸鹼所破壞而失去毒性。遭刺傷後應盡快移除毒刺,在適當的條件下擠出毒液,使用熱、酸、鹼條件處理傷口 ,破壞毒素的活性,並做好傷口的清潔及消毒的工作,防止細菌的感染。
刺毒魚類所造成的傷害反應因人而異,經過現場初步處理後,應盡早送醫處理。
野外活動時要注意
刺毒魚類約占所有魚類的 8%。牠們形態多樣,彼此並非姐妹群關係,亦即起源於多個祖先,換言之,刺毒機制是多次獨立演化出來的,刺毒魚類一共可分為四個大類群,軟骨魚和硬骨魚各占兩大類,包括軟骨魚中的:(一)銀鮫目、異齒鯊科、角鯊科,(二)燕魟亞目;以及硬骨魚類中的(三)鯰形目,(四)鰭棘魚類。毒刺結構可發現於多個部位,如胸鰭、腹鰭、背鰭、臀鰭、尾柄、牙齒、主鰓蓋骨、肩帶上的匙骨等。
因為臺灣為海島地形,海岸線曲折漫長,周邊海域均有刺毒魚類的分布,民眾於海域進行經濟或休閒活動時均有機會接觸到刺毒魚類。雖然刺毒多為被動的防禦機制,並不是主動攻擊的手段,但部分刺毒魚類具備十分良好的偽裝能力,在靜止的狀態下難以被察覺,因此在野外活動時應隨時注意周遭環境是否存在刺毒魚類 ,並穿戴相關防護衣物、鞋子,避免誤觸而受傷,增加海域活動的安全性。
若不幸被刺毒魚類刺傷,在現場進行緊急處理後,應盡早求醫,以策安全。
斑馬短鰭簑鮋(Dendrochirus zebra)。胸鰭內側顏色鮮艷,具警戒作用。圖/自然保育季刊