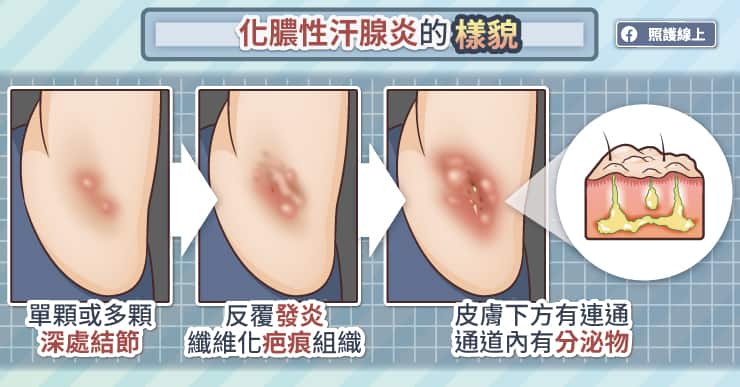
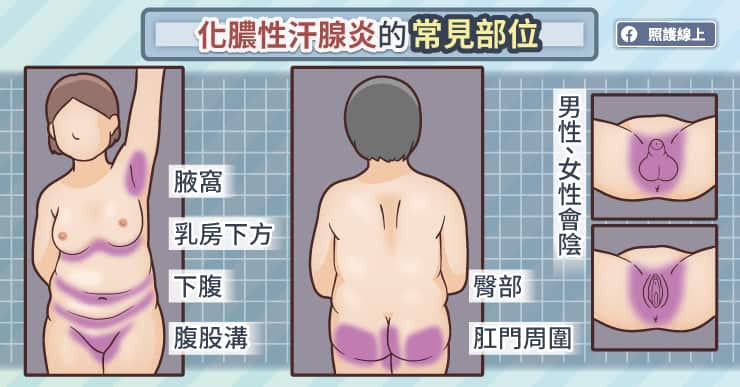
千萬別再說「我寂寞寂寞就好」,因為邊緣人再不翻身、突破社交困境,免疫系統就可能會出問題!
在人類社會,一個人的社會地位和他的健康狀況經常有所關聯。以美國人為例,社經地位最高與最低的成人壽命可以相差到十幾年[1]。一般認為社會地位較低的人壽命較短,可能是因為他們較容易暴露在危險之中,像是酗酒、抽菸、藥物濫用、飲食品質不良或是環境毒素的威脅。但在今年11月一份刊載在《科學》(Science)期刊上的動物免疫行為學研究卻發現:就算照護資源和食物供給都相同,光是社會地位較低就可能會讓免疫系統出問題。[2]
封閉社群裡,恆河猴的「母猴幫」
還記得一度風靡台灣的宮廷劇《後宮甄嬛傳》嗎?劇中後宮的世界就像是個階級的牢籠:在宮中地位較高的寵妃們擁有更多的時間和資源與妃子們社交,而且只跟地位高的人來往;新加入的妃子,則較不受青睞、地位較低,也經常受到其他資深妃子的排擠和惡意攻擊,如果不想辦法提升自己在宮中的地位,就準備抑鬱終生。

而恆河猴(Rhesus macaques,學名 Macaca mulatta)母猴群的社會階級,和《甄嬛傳》的後宮生態有些類似,但稍有差異。在圈養環境中,母猴在族群裡的地位尊卑是由先來後到的順序所決定,而且社會地位會影響一隻母猴如何和同伴互動:那些較早加入「母猴幫」的元老級母猴會有較高的社會地位,而且彼此之間會有較為頻繁的梳毛(grooming)行為,互動較為親密;相反的,新來的母猴們沒什麼猴緣,社會地位較低,容易受到較為頻繁的侵擾(harassment)。
研究團隊找來了 45 隻母猴,平均分成 9 組、每組各 5 隻,進行兩階段的操作實驗,如下圖所示:
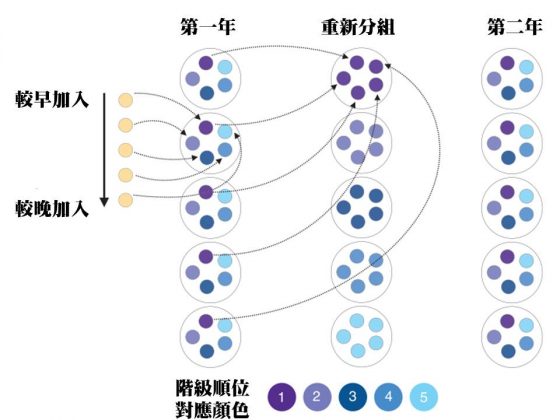
利用先前文中提到「母猴幫」社會地位的內規,依序加入猴群的母猴形成了尊卑階級,而且階級越高、越有親密行為,階級越低、越會受到侵擾。等到階級形成的三個月後,研究團隊為母猴們第一次抽血,並且將目光集中在五種免疫白血球身上,並檢驗與其相關基因的表現差異,看看地位高和地位低的母猴們血液中隱藏著什麼樣的免疫訊息。
一年之後,各組中母猴們會再按照階級依序抽出進行重新分組。某些高階的母猴在重新分組之後淪為「邊緣人」,有些低階的母猴則因此順利的晉升「大姐頭」。此時,研究團隊再次為這些社會階級重排的母猴們抽血,分析地位的變化會對牠們的免疫系統造成什麼樣的影響。
不只人際關係變好,免疫系統也提升了呢!
抽血結果出爐,研究團隊發現社會地位與免疫系統的表現息息相關,特別是這兩種白血球:會破壞被病毒感染的細胞或腫瘤細胞的「自然殺手細胞」(Natural killer cell)和負責調控免疫系統、協助抗原辨識的「輔助型T細胞」(helper T cell)。
階級高、有親密梳毛行為的母猴,血液中的自然殺手細胞有較良好的免疫反應,能抵禦病毒的入侵。階級低、容易受到侵擾的母猴的免疫狀況則比較差,經常處於組織發炎、隨時警戒著細菌入侵的狀態。雖然發炎本身是屬於免疫反應的一環,然而失控的發炎反應對身體並非好事,除了使組織長期腫脹,也和心臟病、糖尿病等慢性病有關。在更進一步地用脂多醣(lipopolysaccharide)模擬細菌感染、處理不同血液樣本中萃取出的白血球之後,研究結果也顯示低階母猴對抗感染的免疫力較弱。
這項研究告訴我們,光是長期的社會壓力就會讓免疫系統的表現較差。然而有趣的是,在第二年的階級重新洗牌、階級低的母猴在升級之後,免疫表現竟也順利改善,變成近似於高階母猴的免疫表現!而原本的高階母猴在失去地位之後,免疫狀況也會隨之變差。也就是說,社會地位的提升確實會改善母猴的免疫力。
母恆河猴實驗的啟示
從母恆河猴的身上,我們看見了什麼啟示?在這篇動物研究裡,即使供給資源、健康照護和風險行為都差不多,社會地位還是影響了母猴的免疫反應。「如果你能改變你的社會條件,你的免疫相關基因表現會更像你現在的樣子,而不是你過去的處境。」本文的共同作者 Jenny Tung 表示 [3]。此外,另一位共同作者 Luis Barriero 更認為,在社會地位低的母猴身上的發炎反應,可能解釋了為何貧窮和工人階級,有較高的機率罹患與發炎有關的疾病,像是心臟病和糖尿病。
「雖然強烈的免疫反應在面對感染時能救你一命,但相同的機制如果控制不好也會造成傷害。」[4]
其他科學家又是怎麼看待這份研究的呢?表觀遺傳學家 Michael Kobor 認為「研究團隊並未控制這些母猴成年前的生活史,而許多研究顯示:成年前所發生的不幸,能夠對往後的健康造成長期影響。」此外,他也指出本研究未考慮到母猴個體之間的遺傳差異,某些猴子天生就是比較對不幸的遭遇比較敏感[5]。而且就算人類和恆河猴都是靈長類,但社會地位的建構方式和個體的反應方式可不見得完全相同,不能輕易畫上等號。
雖然尚不能直接將母恆河猴的研究結果套用在人類身上,但至少我們可以相信:提升自己的社會地位,有助於改善健康。如同本研究的第一作者.演化人類學家 Noah Snyder-Mackler 所說:「我認為這是個正面的社會訊息。如果你能帶著某人離開他所處的惡劣社會環境,至少以成人來說,免疫細胞功能所受到的影響是能夠被逆轉的。」[5]
參考文獻
- Fiscella, Kevin. “Relationships Between Income, Health Behaviors, and Life Expectancy.”Jama 8 (2016): 880-880.
- Snyder-Mackler, Noah, et al. “Social status alters immune regulation and response to infection in macaques.”Science 6315 (2016): 1041-1045.
- Caruso, Catherine. “Who’s top monkey? How social status affects immune health.”Scientific American. November 24 (2016).
- Duke University. “Upward mobility boosts immunity in monkeys: Changes in social status affect the way genes turn on and off within immune cells.” November 24 (2016).
- Callier, Viviane. “Climbing the social ladder can strengthen your immune system, monkey study suggests.” Science Magazine. November 24 (2016).